

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
Топ:
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Цель опыта
Установить влияние увеличения концентрации одноименного катиона на степень диссоциации основания.
Ход опыта
· В две пробирки внесите по 2 мл разбавленного раствора аммиака и по 2–3 капли индикатора – фенолфталеина.
· Одну из пробирок оставьте в качестве контрольной.
· В другую пробирку добавьте 3–4 микрошпателя хлорида аммония, раствор перемешайте стеклянной палочкой.
· Сравните окраски полученного раствора и раствора в контрольной пробирке.
Результаты и наблюдения
· При добавлении фенолфталеина к раствору аммиака
____________________________________________________________________
· Добавление кристаллов хлорида аммония приводит к
____________________________________________________________________
Обработка результатов
· Окраска фенолфталеина в растворе аммиака свидетельствует о наличии
ионов ________ .
(формула)
Уравнение диссоциации гидрата аммиака NH3∙H2O:
____________________________________________________________________
· Математическое выражение и численное значение константы диссоциации:
____________________________________________________________________
· Хлорид аммония – _____________________ электролит:
(сильный, слабый)
____________________________________________________________________
(уравнение диссоциации)
· Изменение окраски фенолфталеина при добавлении хлорида аммония
вызвано ____________________ концентрации гидроксид-ионов вследствие
(увеличением, снижением)
смещения химического равновесия сторону _____________________________________________ .
(недиссоциированного вещества,
продуктов диссоциации)
Вывод
· Добавление соли аммония в раствор аммиака ______________________________ степень
(увеличивает, снижает)
его диссоциации.
· Введение в раствор слабого основания одноименного катиона приводит к
______________________ степени диссоциации основания.
(увеличению, снижению)
Опыт 3. Получение кислой соли
Цель опыта
Получить гидрокарбонат кальция и перевести его в среднюю соль.
Ход опыта
· В пробирку налейте 1–2 мл раствора гидроксида кальция.
· Введите в раствор газоотводную трубку аппарата Киппа; откройте кран аппарата и пропускайте углекислый газ через раствор до исчезновения первоначально образующегося осадка (помутнения).
· К полученному раствору добавьте 0,5–1,0 мл раствора гидроксида кальция.
Результаты опыта
· При пропускании углекислого газа наблюдается________________________
____________________________________________________________________
· Дальнейшее пропускание газа приводит к _____________________________
____________________________________________________________________
· При добавлении гидроксида кальция__________________________________
____________________________________________________________________
|
|
Обработка результатов
· Появление осадка при пропускании углекислого газа обусловлено
образованием ________________________________________
(название соединения)
Молекулярное и ионное уравнения реакции (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________
· Исчезновение осадка обусловлено взаимодействием _____________________
(название соединения)
______________________ с избытком угольной кислоты и образованием кислой
соли – гидрокарбоната кальция _________________
(формула)
Молекулярное и ионное уравнения реакции (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________
· Уравнение диссоциации гидрокарбоната кальция:
________________________________________________________________________________________________________________________________________
· При взаимодействии гидрокарбоната кальция с гидроксидом кальция
образуются средняя соль _____________________________________ и вода.
(название)
Молекулярное и ионное уравнения реакции (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы
· Один из способов получения кислых солей – взаимодействие _____________
____________________________________________________________________
· Кислые соли можно перевести в средние действием _____________________
· Кислые соли ______________________________________________________
(растворимы или нерастворимы в воде)
Опыт 4. Получение основной соли
Цель опыта
Получить гидроксосульфат меди (II) и провести реакции с кислотой и щелочью.
Ход опыта
· В две пробирки налейте 0,5–1,0 мл раствора сульфата меди (II).
· В одну пробирку добавьте раствор гидроксида натрия (щелочи) до образования обильного осадка – гидроксида меди (II).
· В другую пробирку добавьте несколько капель раствора гидроксида натрия до появления помутнения – осадка основной соли, гидроксосульфата меди (II).
· Через 3 минуты отметьте цвета осадков гидроксида и основной соли меди (II).
|
|
· Разделите осадок основной соли в две пробирки, а затем в одну из них добавьте 1 мл раствора серной кислоты, в другую – 1 мл раствора гидроксида натрия (щелочи).
Результаты и наблюдения
· Цвета осадков:
гидроксида меди (II) – ________________________________________________ ;
основной соли меди – ________________________________________________ .
· Осадок основной соли ____________________________________ в кислоте и
(растворяется или не растворяется)
___________________________________ в щелочи.
(растворяется или не растворяется)
· При взаимодействии со щелочью цвет осадка меняется на _______________ .
Обработка результатов
· Молекулярное и ионное уравнения реакции образования гидроксида меди (II) (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________________________________________________________
· Молекулярное и ионное уравнения реакции образования гидроксосульфата меди (II) (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________________________________________________________
· Молекулярное и ионное уравнения реакции взаимодействия гидроксосульфата меди (II) с серной кислотой (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________________________________________________________
· Молекулярное и ионное уравнения реакции взаимодействия гидроксосульфата меди (II) с гидроксидом натрия (нерастворимые вещества отметить ↓):
____________________________________________________________________________________________________________________________________________________________________________________________________________
Выводы
· Один из способов получения основных солей – взаимодействие
____________________________________________________________________
· Основные соли можно перевести в средние действием ___________________
· Основные соли взаимодействуют со щелочами, при этом образуются
____________________________________________________________________
· Основные соли ____________________________________________________
(растворимы или нерастворимы в воде)
Лабораторная работа 5
Условия образования и растворения осадков. Произведение растворимости
Сравнительная растворимость в воде сульфата и карбоната кальция
Цель опыта
· Сравнить растворимость сульфата и карбоната кальция.
Ход опыта
· Налейте в пробирку 1–2 мл раствора хлорида кальция.
· Добавьте 2–3 мл раствора сульфата натрия.
· Через 5–10 мин перенесите прозрачную часть раствора в другую пробирку.
· Убедитесь в полноте осаждения сульфата кальция, для этого к полученному раствору добавьте одну каплю раствора сульфата натрия – осадок не должен образовываться.
· В прозрачный раствор добавьте несколько капель карбоната натрия до образования осадка.
Результаты и наблюдения
· При взаимодействии хлорида кальция и сульфата натрия _________________
|
|
____________________________________________________________________
· При действии карбонатом натрия на полученный раствор ________________
____________________________________________________________________
ПР CaSO4 = 6,1 · 10 -5 ПР CaCO3 = 5 · 10 -9
Обработка результатов
· Молекулярное и ионное уравнения реакции получения сульфата кальция:
____________________________________________________________________________________________________________________________________________________________
· Отделенный от осадка раствор сульфата кальция является
____________________________________. Добавление к нему карбоната натрия
(ненасыщенным, насыщенным, пересыщенным)
приводит к образованию ______________________________ раствора карбоната
(ненасыщенного, насыщенного, пересыщенного)
кальция и образованию осадка.
· Молекулярное и ионное уравнения реакции получения карбоната кальция:
____________________________________________________________________________________________________________________________________________________________
· Значение константы равновесия (К) реакции:
CaSO4 + CO32- 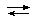 CaCO3 + SO42- (1)
CaCO3 + SO42- (1)
К= ——————————— = Ошибка! Ошибка связи. =
свидетельствует о том, что равновесие смещено в сторону ___________________________
(прямой, обратной)
реакции. Следовательно, в присутствии карбонат-ионов сульфат кальция
______________________ в карбонат кальция.
(переходит, не переходит)
Выводы
· Данные опыта свидетельствуют, что растворимость сульфата кальция
____________________ растворимости карбоната кальция.
(больше, меньше)
· Реакции обмена идут в направлении образования _______________________
__________(более, менее)
растворимых продуктов.
Лабораторная работа № 6
"Гидролиз солей"
|
|
|

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!