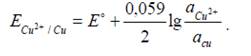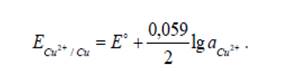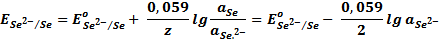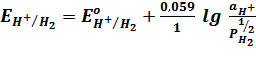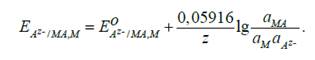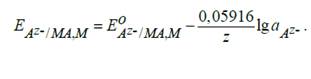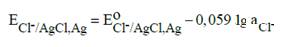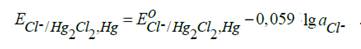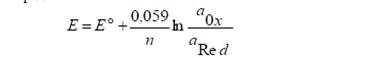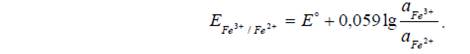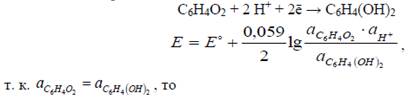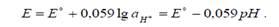По типу электродного процесса электроды делятся на электроды I рода, электроды II рода и окислительно-восстановительные.
Электроды I рода представляют собой металл или металлоид, погруженный в раствор своей соли.
Например, Cu в CuSO4. Схема записи: Cu2+ /Cuº.
На этом электроде идет реакция Cu2+ + 2ē → Cuº, которая определяет потенциал электрода. Потенциалопределяющие ионы – ионы Cu2+. Для медного электрода:
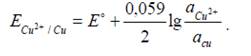
Если металл присутствует в чистом виде, а не в виде сплава или амальгамы, то аCu = 1 и z = 2. Тогда
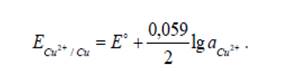
Неметаллические электроды – электроды, состоящие из неметалла, погруженного в раствор, содержащий анионы этого неметалла.
Схематическая запись: Se 2–/Se 0
Электродная реакция : Se + 2e = Se 2–
Уравнение Нернста:
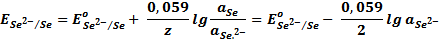
Газовые электроды– электроды, состоящие из инертного металла (обычно Pt), находящегося в одновременном контакте с газом и с раствором, содержащем ионы этого газа.
Схематическая запись: H+/ H2 (Pt)
Электродная реакция: Н+ + 1е = ½ Н2
Уравнение Нернста: 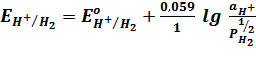
Электроды II рода:
Электроды второго рода состоят из металла, покрытого слоем его труднорастворимой соли, погруженного в раствор, содержащий анионы этой соли.
Окисленной формой является труднорастворимая соль, а восстановленной металл и анион соли. Электроды второго рода обратимы по аниону, т.е. их потенциал является функцией активности аниона.
Схему и потенциалопределяющую реакцию записывают следующим образом:
Аz- | MA, M
МА+ze=М+ Аz-
Потенциал электрода второго рода можно представить выражением:
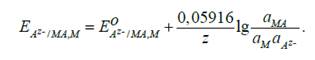
Поскольку в чистых твердых фазах активность веществ МА и М принимают равной единице, то конечное уравнение имеет вид:
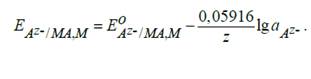
Электроды второго рода широко применяются в электрохимических измерениях в качестве электродов сравнения, так как их потенциал устойчив во времени и хорошо воспроизводится.
Примерами электродов второго рода могут служить хлорсеребряный и каломельный электроды.
Хлорсеребряный электрод: Сl ̅ / AgCl, Ag.
Представляет собой серебряную пластинку, покрытую слоем хлорида серебра и погруженную в раствор HCl.
Электродная реакция: AgCl + e ↔Ag + Cl–;
Уравнение Нернста: для твердый фаз а AgCl = 1, a Ag = 1
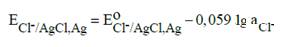
Стандартный потенциал электрода при 298 К составляет 0,2223 В.
Каломельный электрод состоит из ртути, покрытой пастой, приготовленной из растёртой каломели Hg2Cl2 с ртутью, и раствора хлорида калия: Cl–| Hg2Cl2, Hg.
Электродная реакция: Hg2Cl2 +2е=2Hg+2Cl–
Уравнение Нернста:
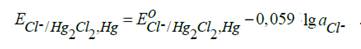
2) Металл, покрытый труднорастворимым гидроксидом или оксидом металла и опущенный в раствор растворимого гидроксида:
OH ̅ / Cd(OH)2, Cd или OH ̅ / HgO, Hg
Окислительно-восстановительные или редокс-электроды, состоят из инертного металла, например, платины, который не участвует в реакции, а является переносчиком электронов между окисленной и восстановленной формами вещества.
В общем виде схема электрода и уравнение потенциалопределяющей реакции записывается так:
Ox, Red│Pt; Ox+ze=Red
Потенциал их определяется:
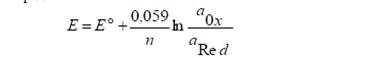
Окислительно-восстановительные электроды бывают двух типов:
-простые Ох/Red электроды - электроды, в которых электродная реакция состоит в изменении заряда ионов.
Например: Fe3+, Fe2+ / Pt. На этом электроде протекает реакция: Fe3+ + ē → Fe2+.
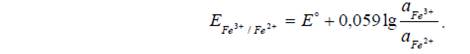
-сложные Ох/Red электроды. В потенциалопределяющих реакциях сложных систем участвуют ионы Н+ и молекулы воды.
Наример, хингидронный электрод.
Хингидрон представляет собой труднорастворимое соединение хинона и гидрохинона в соотношении 1:1, так называемая эквимолекулярная смесь. В растворе между хиноном и гидрохиноном протекает окислительно- восстановительная реакция:
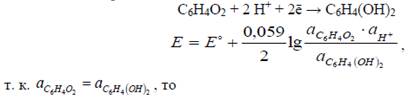
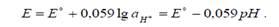
Из последнего уравнения видно, что потенциал окислительно-восстановительного электрода зависит от активности ионов Н+ в растворе. При условиях, обеспечивающих постоянство активностей других компонентов потенциалопределяющей реакции, такие окислительно-восстановительные электроды могут быть использованы как индикаторные при потенциометрическом определении рН растворов.