Опорный конспект лекции по теме:
Электрохимия. Электродвижущие силы и электродные потенциалы
Контрольные вопросы:
Возникновение электродного потенциала на границе раздела фаз. Двойной электрический слой, его строение. Равновесный электродный потенциал. Стандартный потенциал. Уравнение Нернста. Электрохимический ряд напряжений. Гальванический элемент. Электродвижущая сила гальванического элемента. Химические и концентрационные гальванические элементы. Классификация электродов: электроды первого и второго рода, окислительно-восстановительные электроды. Электроды сравнения. Индикаторные электроды, потенциометрическое определение рН растворов. Стеклянный электрод.
Основные понятия и определения
Проводником первого рода называется среда (материал), обеспечивающая электропроводность за счет движения электронов. К ним относятся металлы (Ме), их сплавы, металлоподобные гидриды, нитриды, графит и т.д.
Проводник второго рода – среда (материал) обеспечивающая электропроводность за счет движения ионов. Это электролиты, в растворах или расплавах которых в результате диссоциации содержатся ионы, обладающие подвижностью.
Электродом называется совокупность проводников первого и второго рода, находящихся в непосредственном контакте.
или Электродом называется токопроводящая система, состоящая из 2-х контактирующих фаз: Ме – электролит, или Ме, погруженный в раствор соли этого Ме.
Электрохимической цепью называется совокупность последовательно соединенных проводников, из которых хотя бы один является проводником второго рода, т.е. электролитом.
Возникновение двойного электрического слоя на границе электрод – электролит
Кристаллическая решетка Ме построена из катионов, занимающих места в узлах кристаллической решетки, и общих внешних валентных электронов, обуславливающих связь между катионами. Число положительных зарядов катионов металла кристаллической решетки скомпенсировано отрицательными электронами, и металл в целом не имеет заряда.
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) или раствором электролита на границе электрод – раствор возникает двойной электрический слой (ДЭС).
Например, медный электрод, погруженный в воду или в раствор сульфата меди.
При погружении медного электрода в воду часть катионов меди, находящихся в узлах кристаллической решетки, в результате взаимодействия молекулами воды будет переходить в раствор. Переход катионов в раствор нарушает электрическую нейтральность металла и раствора: металл приобретает отрицательный заряд из-за оставшихся электронов, а раствор – положительный за счет катионов, перешедших в него. Катионы, перешедшие в раствор, взаимодействуют с молекулами воды, окружаются ими (гидратируются) и далеко от поверхности металла в объем раствора не уходят, т. к. они и поверхность металла заряжены противоположно. Между металлом и раствором образуется двойной электрический слой (возникает скачок потенциала).
Процесс перехода катионов с поверхности металла в прилегающий слой раствора является окислением (нейтральные атомы металла становятся положительными ионами, оставляя электроны в решетке металла):
Zn о– 2e → Zn2+ раствор.
Со временем при достижении определенной концентрации катионов в растворе скорости обоих процессов выравниваются, и устанавливается динамическое электрохимическое равновесие, сопровождающееся непрерывным обменом катионами между металлом и раствором. Этому состоянию равновесия будет соответствовать равновесная концентрация ионов Со в растворе и определенный равновесный потенциал поверхности металла и прилегающего слоя раствора (равновесный скачок потенциалов).
При погружении медного электрода в раствор CuSO4, содержащий катионы меди в концентрации С возможны 3 случая:
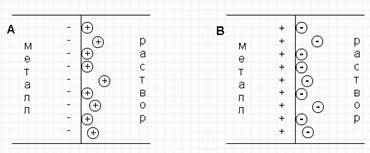
Схема ДЭС на границе электрод – раствор
1. С > Со – концентрация катионов меди в поверхностном слое меньше равновесной, начнется переход катионов из электрода в раствор; электрод заряжается отрицательно, в поверхностном слое катионов будет больше, чем анионов (рис. А)
2. С < Со – концентрация катионов меди в поверхностном слое больше равновесной, начнется переход катионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SO4 (рис. В)
3. С = Со - концентрация катионов меди в поверхностном слое равна равновесной, заряд на электроде не возникает, ДЭС не образуется.









