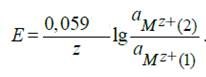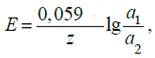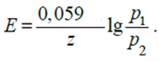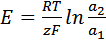Величина потенциала электрода зависит от природы материала электродов, от концентрации их ионов в растворе и от температуры. Поэтому для характеристики природы этого вещества и сравнения его с другими материалами измерение их потенциалов необходимо проводить в стандартных (сопоставимых) условиях – при одинаковых концентрациях потенциалобразующих ионов. В соответствии с этим стандартный электродный потенциал – это потенциал электрода при стандартных (нормальных) условиях, т. е. при концентрации ионов 1 г-экв/л; его обозначают символом Е0.
Зависимость равновесного потенциала (Е) электрода от концентрации потенциалопределяющих ионов выражается уравнением Нернста для отдельного электрода:
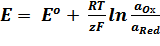 .
.
где Е – электродный потенциал, В
Ео – стандартный электродный потенциал – потенциал электрода при активности ионов равной 1.
R – универсальная газовая постоянная, равная 8,314 Дж/моль К
T – температура , К
z – число электронов, принимающих участие в электродной реакции;
F – постоянная Фарадея, равная 96500 Кл/моль
aOx и aRed – активности окисленной и восстановленной форм.
Для температуры 298 К (25оС) уравнение Нернста при переходе от натурального логарифма к десятичному принимает вид:
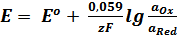 .
.
Если восстановленной формой является твердое состояние, то активность твердого вещества (aRed) принимается равной единице, уравнение Нернста упрощается:
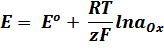
Зная стандартный электродный потенциал Ме, можно рассчитать по уравнению Нернста его электродный потенциал при любой концентрации ионов в растворе.
Пример:
При 298 К и активности ионов а = 0,005 потенциал электрода Cu2+ | Cu равен +0,2712 В. Вычислите стандартный потенциал медного электрода.
Решение: стандартный потенциал медного электрода рассчитывают, используя уравнение:
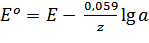
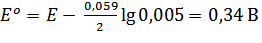
Электрохимические цепи
Различают два основных вида электрохимических цепей – химические и концентрационные.
В химических цепях источником электрического тока является протекающая в системе окислительно–восстановительная химическая реакция.
Многие химические реакции являются окислительно-восстановительными. Например, при погружении цинковой пластинки в раствор сульфата меди самопроизвольно протекает реакция
Zn + CuSO4 = ZnSO4 + Cu,
в результате, которой атомы цинка окисляются, а ионы меди восстанавливаются. При таком проведении процесса энергия химической реакции превращается в тепловую энергию, но если провести процессы окисления и восстановления раздельно и осуществить передачу электронов через внешнюю цепь, можно использовать энергию химической реакции для совершения работы. В этом случае электрохимическая цепь действует как источник тока.
Гальваническими элементами ГЭ называются электрохимические цепи, в которые дают возможность получать ток за счет самопроизвольно протекающих в обычных условиях химических реакций.
Элемент (или устройство), в котором энергия химической реакции преобразуется в электрическую называется гальваническим элементом.
ГЭ состоит как минимум из 2-х электродов; на одном из которых всегда идет процесс окисления (отрицательный электрод, анод), а на другом – процесс восстановления (положительный электрод, катод).
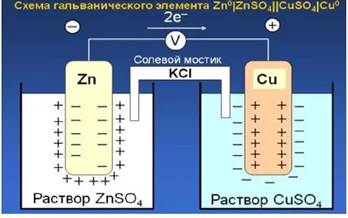
Одним из наиболее простых гальванических элементов является элемент Даниэля-Якоби, состоящий из двух электродов – цинкового и медного, погруженных в соответствующие растворы сульфатов цинка и меди, и соединенных солевым агар-агаровым мостиком.
Для устранения диффузионного потенциала растворы соединяют электролитическим мостиком, который представляет собой изогнутую стеклянную трубку наполненную насыщенным раствором электролита (например КС l), у которого подвижности К+ и А- приблизительно равны. Агар-агар используют для того, чтобы удержать электролит в трубке.
Цинковый электрод по отношению к медному заряжается отрицательно. При замыкании внешней цепи цинк растворяется, происходит реакция окисления:
Znº – 2ē → Zn2+.
а на медном электроде - восстановления:
Cu2+ + 2ē → Cuº.
Движение потока электронов по проводнику – это и есть электрический ток.
Общий процесс является суммой процессов, протекающих на отдельных электродах:
Znº + Cu2+ → Zn2+ + Cuº.
Для ГЭ принята следующая форма записи электрохимической цепи:
– Zn | ZnSO4 | | CuSO4 | Cu +
· Cлева записывается электрод имеющий более отрицательный потенциал (анод),
· справа – электрод, имеющий более положительное значение потенциала (катод).
· по краям цепей записываются Ме (материал электрода). Вертикальная линия обозначает границу раздела фаз Ме – раствор. Растворы обоих электродов отделяются двумя сплошными линиями, обозначающими отсутствие диффузионного потенциала (Δφдиф = 0).
Электродные полуреакции принято записывать как реакции восстановления. Поэтому общая реакция в ГЭ записывается как разность между реакциями на правом и левом электродах: слева записываются вещества в окисленной форме и электроны, справа – вещества в восстановленной форме.
Правый электрод: Cu2+ + 2ē → Cuº.
Левый электрод: Zn2+. + 2ē → Znº
Общая реакция: Znº + Cu2+ → Zn2+ + Cuº.
Важной характеристикой ГЭ является его электродвижущая сила (ЭДС). Электродвижущая сила элемента равна разности потенциалов на концах правильно разомкнутой равновесной цепи. ЭДС обозначают E, которую рассчитывают по формуле:
Е = Е+ – Е– ,
где Е+ и Е– - потенциал положительного и отрицательного электродов соответственно.
Стандартная ЭДС:
Ео = Ео+ – Ео– ,
где Ео+ и Ео– - стандартный потенциал положительного и отрицательного электродов соответственно
Электрохимическая цепь называется правильно разомкнутой, если она начинается и заканчивается одним и тем же металлом. В системе СИ ЭДС измеряется в вольтах.
ЭДС всегда положительна, поскольку она соответствует определенному самопроизвольно протекающему процессу, дающему положительную работу. ЭДС цепи отражает все процессы, происходящие на границе раздела фаз в равновесной цепи.
Для гальванического элемента Даниэля – Якоби ЭДС равна:
E = Е Cu 2+| Cu – Е Zn 2+| Zn
Согласно уравнению Нернста
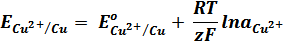
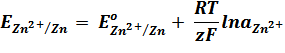
Вычитая второе уравнение из первого, получим выражение для ЭДС медно-цинкового гальванического элемента:
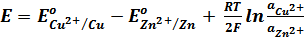 , z=2
, z=2
Для любого другого элемента, в основе работы которого лежит химическая реакция, ЭДС может быть вычислена по уравнению:
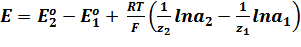 ,
,
Eo1 и Eo2 – стандартные потенциалы электродов;
z1 z2 – зарядовые числа ионов;
a1 a2 – активности ионов в растворе.
Пример
Записать схему цепи, составленной из цинкового и хлорсеребряного электродов. Определить стандартную ЭДС цепи.
Выпишем из справочника электродные полуреакции (потенциалопределяющие) и стандартные потенциалы электродов:
| Справочные данные
| Zn2+. + 2ē → Znº
| EoZn2+/Zn = –0,763 B
|
| AgCl + e = Agº + Cl–
| EoСl ̅ / AgCl, Ag = 0,222 B
|
Стандартная ЭДС рассчитывается по Ео = Ео+ – Ео– .
Положительным в цепи будет тот электрод, который имеет больший условный потенциал. Положительным будет хлорсеребряный электрод, отрицательным – цинковый.
Ео = EoСl ̅ / AgCl, Ag – EoZn2+/Zn = 0,222 – (–0,763) = 0,985 В.
Схема цепи Zn | Zn2+ | | Сl ̅ | AgCl, Ag
Реакции в гальваническом элементе:
| Катод
| Сl ̅ | AgCl, Ag
| AgCl + e = Agº + Cl–
|
| Анод
| Zn2+ | Zn
| Zn2+. + 2ē → Znº
|
| Суммарная реакция
| 2AgCl + Zn = 2Ag +2 Cl– + Zn2+
|
Концентрационные цепи состоят из одинаковых электродов, но отличаются концентрацией веществ, участвующих в окислительно-восстановительных процессах. При этом электрическая энергия возникает за счет выравнивания концентраций веществ в элементе. Концентрационные цепи могут быть без переноса ионов и с переносом ионов.
Концентрационными цепями без переноса ионов называются гальванические элементы:
а) с одинаковыми электродами и двумя одинаковыми по природе, но разными по концентрации растворами электролитов, причем между растворами отсутствует непосредственное соприкосновение:
М | MА || МА | M
а1 а2
б) с электродами из двух сплавов (амальгам), одинаковых по природе, но разных по концентрации (с одним раствором электролита):
(Hg)М | Mz+ | М(Hg)
а1 а2
в) с газовыми электродами, одинаковыми по природе, но с разным давлением газа на электродах (с одним раствором электролита)
Pt, H2 | H+ | H2, Pt
p1 p2
Электрическая работа концентрационной цепи равна работе выравнивания активностей потенциалопределяющих ионов в растворах у электродов. В соответствии с этим ЭДС цепи будет
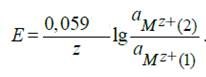
Аналогичные уравнения справедливы для расчета ЭДС концентрационных цепей с амальгамными и газовыми электродами. Для амальгамных цепей
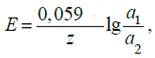
для цепей с газовыми электродами
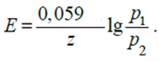
Электроду с более высоким значением активности металла в амальгаме или парциального давления водорода соответствует более отрицательный потенциал, поэтому для этих систем а1> а2 и р1> р2.
Концентрационными цепями с переносом ионов называются элементы с одинаковыми электродами и двумя одинаковыми по природе, но разными по концентрации растворами электролитов, причем между растворами имеется непосредственная граница соприкосновения.
Примером концентрационного элемента с переносом может быть цепь, состоящая из двух медных электродов, отличающихся концентрацией растворов CuSO4:
Cu|CuSO4 ⸽ CuSO4|Cu
a1 a2
Поскольку для электродов первого рода, обратимых относительно катиона, потенциал тем больше, чем выше активность ионов в растворе, положительным в приведенной цепи будет электрод с большей активностью а1 < а2
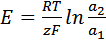
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Элемент будет работать до тех пор, пока активности растворов не станут одинаковым.
Недостатки концентрационных гальванических элементов: разрушаемый анод и малая ЭДС.
Концентрационные элементы используются в тех случаях, где необходима малая ЭДС. Концентрационные цепи широко используются для определения рН, коэффициентов активности ионов, растворимости трудно растворимых электролитов.





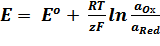 .
.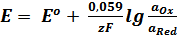 .
.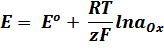
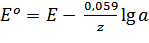
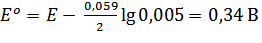

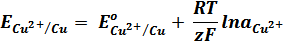
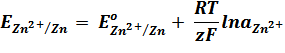
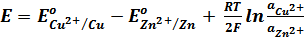 , z=2
, z=2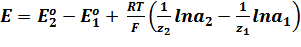 ,
,