Изменения жиров при варке
Содержащийся в продуктах жир в процессе варки плавится
и переходит в жидкость. Количество поступающего в варочную
среду жира зависит от его содержания и характера отложения
в продукте, продолжительности варки, величины кусков.
Основная масса извлеченного жира (90—95) % собирается на
поверхности бульона, и лишь небольшая часть (3,5 – 10) % распре-
деляется по всему объему бульона в виде мельчайших жировых
капелек (эмульгирует). Что придает бульону мутность.
Количество жира, эмульгированного при варке, увеличивается
с возрастанием интенсивности кипения и количества жидкости по отношению к продукту. При совместном воздействии этих
факторов количество эмульгированного жира может увеличиться
в несколько раз. Так, при изменении соотношения междуколиче-
ством воды и костей с (3: 1) до (8: 1) при слабом кипении количество
эмульгированного жира возрастает почти вдвое, а при сильном
кипении — более чем в 5 раз.
О частичном гидролитическом расщеплении жира при варке свидетельствует возрастание его кислотного числа. При темпера-
туре варки (около 1000С) вода и жир практически взаимно нерас-
творимы, поэтому гидролиз протекает на поверхности раздела
жировой и водной фаз. При эмульгировании увеличивается по-
верхность соприкосновения жира с водой, что способствует его
гидролизу. Наличие в варочной среде поваренной соли и продук-
тов, содержащих кислоты, усиливает гидролиз жира. Одна-
ко полного расщепления жиров при варке не происходит, и поэто-
му в варочной среде наряду со свободными жирными кислотами
и глицерином всегда присутствуют моно- и диглицериды.
Образующиеся в результате гидролиза высокомолекулярные
жирные кислоты придают бульону неприятный салистый привкус.
Чем больше эмульгирует и гидролизуется жира, тем ниже каче-
ство бульона.
Изменения жиров при жарке
Из всех способов жарки наиболее распространенными являются
два: с небольшим количеством жира и в большом количестве жира
(во фритюре). Жарка во фритюре может быть непрерывной (отно-
шение жира и продукта (20:1)) и периодической (отношение жира
и продукта от (4:1) до (6:1)).
Несмотря на значительную аэрацию и действие высоких
температур (140 — 200) 0С, глубоких окислительных изменений в
жире не наблюдается из-за небольшой продолжительности нагре-
вания.
При жарке с небольшим количеством жира, нагреваемого в ви-
де тонкого слоя, возможен его перегрев. Даже при кратковремен-
ном перегреве (температура свыше 2000 С) может произойти тер-
мическое разложение жира с выделением дыма (пиролиз). Темпе-
ратура, при которой начинается выделение дыма из жира,
называется температурой или точкой дымообразования. Различ-
ные жиры при одинаковых условиях нагревания имеют разную
температуру дымообразования (0С): свиной жир — 221, хлопковое
масло — 223, пищевой саломас — 230. -
На температуру дымообразования, помимо вида жира, влияют
содержание в нем свободных жирных кислот, отношение нагре-
ваемой поверхности жира к его объему и материал посуды, в ко-
торой производится нагрев. Присутствие в жире даже небольших
количеств свободных жирных кислот заметно снижает темпера-
туру дымообразования. Так, при повышении содержания свобод-
ных жирных кислот в свином жире (от 0,02 до 0,81)% температура
его дымообразования снижается (с 221 до 150)0С. При нагревании
одного и того же количества жира одного вида на двух сковородах
диаметром (15 и 20) см температура дымообразования оказалась
соответственно (185 и 169)0С.
Некоторые металлы переменной валентности (железо, медь
и др.) способны катализировать пиролиз жира, снижая таким
образом температуру дымообразования.
На крупных пищевых предприятиях применяются аппараты
непрерывной фритюрной жарки, тепловая обработка продуктов в
которых производится в большом количестве жира (отношение
жира к продукту до 20: 1). В таких аппаратах жарят рыбные полу-
фабрикаты, картофельные чипсы и крекеры. Увеличение коли-
чества жира позволяет ускорить процесс жарки, поддерживать
более низкие температуры фритюра (150 — 160)0С, снижать ско-
рость его термического разложения и окисления, а следователь-
но, и расход.
При непрерывной жарке качество фритюрного жира зависит
от коэффициента сменяемости (К):
К = П/ М
где П — количество жира, поглощаемого и адсорбируемого обжариваемым продуктом за 24 ч, кг;
М — средняя масса жира
в жарочном аппарате, кг.
Чем выше коэффициент сменяемости жира, тем меньше он
подвергается окислительным изменениям. В результате постоян-
ной сменяемости нагреваемого жира степень окисления его быстро
достигает стабильного состояния и в дальнейшем мало изме-
няется.
Наиболее глубокие изменения происходят в жире при периоди-
ческойфритюрной жарке. При таком способе жарки жир может
длительно нагреваться без продукта (холостой нагрев) и периоди-
чески использоваться для жарки различных продуктов при сравни-
тельно низком коэффициенте сменяемости. Причем
циклы охлаждения и нагревания многократно повторяются. Ве-
роятность окисления жиров при таком циклическом нагреве даже
выше, чем при непрерывном.
Таблица 1 - Режимы фритюрной жарки некоторых полуфабрикатов
|
Полуфабрикаты
|
Температура, 0С
| Продолжи-тельность жарки, мин.
|
| Котлеты по-киевски
Рыба в тесте
Порционные куски рыбы
Картофель (брусочки)
Картофель (соломка)
Мясо, птица, кролик отварные
Пирожки, пончики, чебуреки
| 160-170
160-170
160-170
175-180
175-180
170-180
180-190
| 3-4
2-3
3-5
5-6
3-4
3-4
4-6
|
3.4.1 Физико-химические изменения жиров при жарке во фритюре
При термическом окислении жиров в процессе фритюрной жарки
происходит быстрое образование и распад перекисей, о чем свидетельствует скачкообразное изменение перекисного числа. Циклические перекиси могут распадаться с образованием двух соединений с укороченной цепью (альдегид и альдегидо-кислота), которые при дальнейшем окислении могут образовывать соответственно одноосновную и двухосновную кислоты:
О О +2О
НООС ¾R1¾ СН ¾СН¾R2 → НООС ¾R1¾ С + R2 ¾ С →
│ │ Н Н
О ¾О
+2О
→ НООС ¾R1 ¾ СООН + R2 ¾ СООН
Циклические перекиси могут превращаться и в другие более стабильные продукты вторичного окисления:
-О +Н2О
R1 ¾ СН ¾СН¾R2 →R1¾СН ¾СН¾R2 →
│ │
О ¾ОО
циклическая перекись эпоксид
+Н2О +О
→ R1 ¾СН ¾СН¾R2 →R1¾ С¾С¾R2
│ │ -Н2О │ │
ОН ОН О О
диоксикислотадикарбонильное
соединение
Вода, попадающая в жир из обжариваемого продукта, не только испаряется, унося с собой летучие продукты распада, но и способствуют гидролизу жира. В результате накопления свободных жирных кислот кислотное число жира непрерывно увеличивается, причем не только вследствие гидролиза, но и за счет образования низкомолекулярных кислот при расщеплении перекисей.
В то время как кислотное число фритюра по мере нагревания непрерывно возрастает, температура дымообразования почти линейно снижается. Это приводит к усилению выделения дыма по мере увеличения продолжительности нагревания. Вследствие увеличения содержания соединений с сопряженными двойными связями, образующимися при изомеризации, возрастает оптическая плотность жира при длине волны (232 – 234) нм.
Йодное число уменьшается как вследствие окислительных реакций по месту двойных связей, так и за счет накопления высокомолекулярных веществ, поскольку оксикислоты, дикарбонильные вещества и соединения с сопряженными двойными связями способны к реакциям полимеризации и поликонденсации. О накоплении полимеров свидетельствует увеличение вязкости.
При термическом окислении наряду с циклическими полимерами образуются циклические мономеры.
Один из основных факторов, влияющих на скорость химических изменений фритюрного жира, - температура, повышение которой ускоряет гидролиз, а также гидролитические и окислительные процессы. Так при 2000С гидролиз жира протекает в 2,5 раза быстрее, чем при 1800С. при температурах свыше 2000С помимо пиролиза заметно ускоряется нежелательные процессы полимеризации.
Другим фактором является контакт жира с кислородом воздуха, без доступа которого даже длительное нагревание при (180 – 190)0С не вызывает заметных окислительных изменений жира.
Увеличению контакта с воздухом способствуют нагревание жира
тонким слоем, жарка продуктов пористой структуры, сильное
вспенивание и перемешивание жира.
Большое значение имеет присутствие в жире катализаторов
или инициаторов окисления, увеличивающих скорость окислитель-
ных процессов. К ним относятся хлорофилл и металлы перемен-
ной валентности (Fе, Сu, Мn, Со и др.).
Скорость автоокисления жира можно заметно затормозить, вводя в него ничтожные количества антиоксидантов, механизм действия которых неодинаков. Некоторые
естественные (каротин, изомеры токоферола) и искусственные
(бутилоксианизол, бутилокситолуол, некоторые производные
фенола) антиоксиданты связывают свободные радикалы, переводя
их в неактивное состояние. Однако при высоких температурах
жарки большинство естественных и искусственных антиоксидан-
тов разрушается или испаряется.
Заметное влияние на скорость термического окисления жира
оказывает химический состав обжариваемых продуктов, что объяс-
няется, в частности, содержанием в некоторых из них значительного
количества антиоксидантов. Так, входящие в состав продуктов
белки способны проявлять антиокислительное действие, некоторые
вещества, образующиеся в результате реакции меланоидинообра-
зования, обладают редуцирующим действием и могут прерывать
цепь окислительных превращений. Более заметное окисление
фритюрных жиров при холостом нагреве по сравнению с окисле-
нием их при обжаривании продуктов можно объяснить антиокис-
лительным действием других компонентов, входящих в состав
обжариваемых продуктов в небольших количествах (витамин С,
некоторые аминокислоты, глютатион).
Кроме того, устойчивость жира к окислению зависит от сте-
пени его ненасыщенности. Ненасы-
щенные жиры окисляются быстрее насыщенных. Однако условия
жарки (температура, доступ воздуха и длительность нагревания)
играют более существенную роль в процессе термического окис-
ления.
В процессе жарки во фритюре изменяются вкус, цвет и запах жира
Пигменты, содержащиеся в жире (каротиноиды, хлорофилл,
госсипол и др.), легко разрушаются под действием нагрева,
вследствие чего в начале нагревания цвет жира несколько свет-леет, а по мере дальнейшего нагревания начинает темнеть до цвета
крепкого кофе.
Причин потемнения жира несколько. Одна из них — загрязне-
ние жира веществами пирогенетического распада, образующимися
при обугливании мелких частиц обжариваемых продуктов.
Другая причина потемнения жира — реакции меланоидино-
образования и карамелизации. Источником аминных
групп, участвующих в первой из них, могут служить обжариваемые
продукты, а при использовании для фритюра нерафинированных
масел — и входящие в них фосфатиды. Поэтому цвет рафиниро-
ванных масел, из которых удалены фосфатиды и другие посторон-
ние вещества, изменяется значительно медленнее.
Следующая причина появления темной окраски — накопление
темноокрашенных продуктов окисления самого жира.
Еще одна причина потемнения жиров — это при-
сутствие в некоторых из них хромогенов (слабоокрашенных или
бесцветных веществ). При окислении и действии других факторов
хромогены интенсивно окрашиваются.
Чистыенеокисленные триглицериды не имеют вкуса и запаха.
Однако в процессе фритюрной жарки образуются летучие веще-
ства (вещества с укороченной цепью), которых в гретых фритюр-
ных жирах обнаружено свыше 220 видов. Некоторые из них при-
дают определенный запах обжариваемым продуктам и самому
жиру. Например, карбонильные производные, содержащие 4, 6, 10
или 12 атомов углерода, придают фритюру приятный запах жаре-
ного, тогда как карбонильные компоненты, содержащие 3, 5 или
7 атомов углерода, отрицательно влияют на запах фритюра.
При длительном использовании для фритюрной жарки жир
приобретает темную окраску и одновременно жгуче-горький вкус.
Кроме того, у него появляется едкий запах горелого. Объясняется
это в основном присутствием в нем акролеина (СН = СН — СНО),
содержание которого в жире возрастает по мере снижения темпе-
ратурыдымообразования. Горький вкус и запах горелого обуслов-
лены в основном продуктами пирогенетического распада пищевых
продуктов. Меланоидины также влияют на вкус и запах нагретого
фритюрного жира.
Накопление в жире полярных поверхностно-активных соедине-
ний (например, оксикислот) и возрастающая вязкость вызывают образование интенсивной и стойкой пены при загрузке продукта в жир, что может привести к перебрасыванию жира через край посуды и его воспламенению. Таким образом, сильное вспенивание и уменьшение температуры дымообразования (ниже 1900С) делает жир непригодным для жарки.
Строение растительной ткани
Ткань (мякоть) овощей и плодов состоит из тонкостенных
клеток, разрастающихся примерно одинаково во всех направле-
ниях. Такую ткань называют паренхимной. Содержимое отдельных
клеток представляет собой полужидкую массу цитоплазму,
в которую погружены различные клеточные элементы (органел-
лы) — вакуоли, ядра, пластиды и др. (рис2).
Вакуоль расположена в центре клетки и является самым
крупным элементом,-
заполненным жидкостью, в которой растворены питательные
вещества— клеточным соком. Тонкий слой цитоплаз-
мы с другими органеллами занимает в клетке пристенное поло-
жение.
Все органеллы клетки отделены от цитоплазмы мембрана-
ми. Вакуоли окружены простой (элементарной) мембраной,
называемой тонопластом. Поверхность ядер, пластид
и других цитоплазматических структур покрыта двойной мембра-
ной, состоящей из двухрядов простых мембран с промежутком
между ними, заполненным жидкостью типа сыворотки.
| Вакуоль, наполненная
клеточным соком
Упругость
клеточной стенки
Тургорное
давление
|
| Хлоро-
пласты Ядро
Клетка, поме-щеннаяв кон-центрированный солевой раствор
|
| Клетка, поме-щенная в чистую воду
|
| Возрастание тургорного давления
Н2О
|
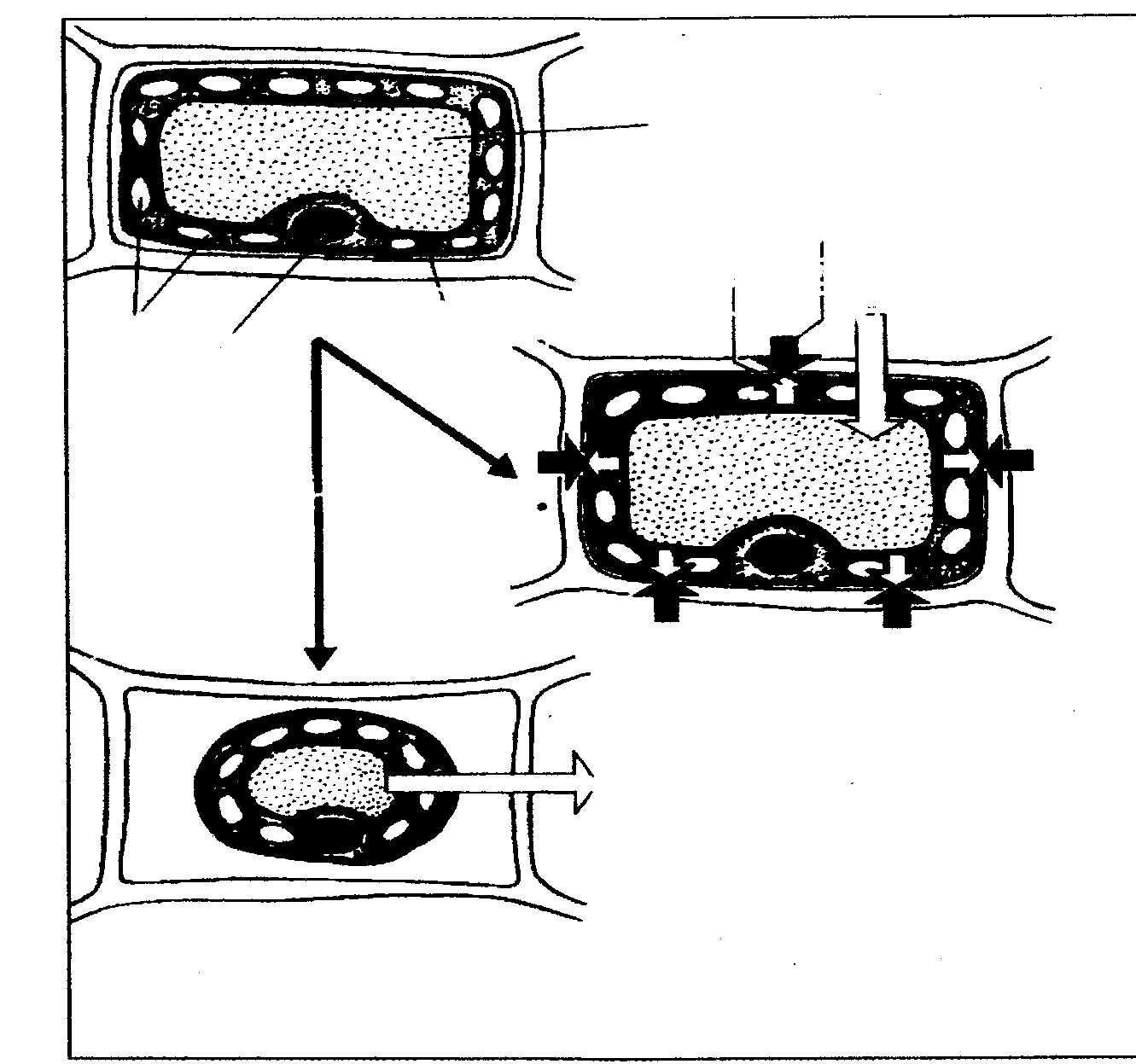
Рисунок 2 - Строение растительной клетки
Цитоплазма на границе с клеточной оболочкой покрыта, как
и вакуоль, простой мембраной, называемой плазмалеммой.
Внешнюю границу плазмалеммыможно увидеть при рассмотрении
под микроскопом препаратов растительной ткани, обработанных
концентрированным раствором поваренной соли. Вследствие раз-
ницы между осмотическим давлениемвнутри клетки и вне её
происходит переход воды из клетки в окружающую среду, вызы-
вающий плазмолиз — отделение цитоплазмы от клеточной
оболочки.
Мембраны регулируют клеточную проницаемость, избирательно
задерживая либо пропуская молекулы и ионы тех или иных
веществ в клетку иза ее пределы. Мембраны препятствуют также
смешиванию содержимого двух соседних органелл. Отдельные
вещества переходят из одних органелл в другие лишь в строго
определенных количествах, необходимых для протекания физио-
логических процессов в тканях.
Каждая клетка покрыта оболочкой, представляющей собой пер-
вичную клеточную стенку. О
на характеризуется полной проницаемостью. Оболочки каждых
двух соседних клеток скрепляются с помощью
срединных пластинок, образуя остов паренхимной ткани. Поэтому
часто клеточными стенками называют не только оболочки клеток,
но и оболочки клеток вместе со срединными пластинками.
Контакт между содержимым клеток осуществляется через
плазмодесмы, которые представляют собой тонкие протоплазма-
тические тяжи, проходящие через оболочки.
Поверхность отдельных экземпляров овощей и плодов покрыта
покровной тканью — эпидермисом (плоды, наземные овощи)
или перидермой (картофель, свекла, репа).
Свежие овощи и плоды отличаются значительным содержани
ем воды (от 75 до 95) %, поэтому всеструктурные элементы их
паренхимной ткани в той или иной степени гидратированы. Спо-
собность тканей овощей и плодов сохранять форму и определен-
ную структуру при относительно высоком содержании воды объяс-
няется присутствием в них белков и углеводов, способных удержи-
вать значительное количество влаги. Это обеспечивает достаточно
высокое тургорное давление в тканях. Тургорное давление может
снижаться, например, при увядании или подсыхании овощей и
плодов или возрастать, что наблюдается при погружении их в воду.
Изменения белков пищевых продуктов
Белки — важнейшая составная часть пищи человека и животных. Белки представляют собой высокомолекулярные природные полимеры, молекулы которых построены из остатков аминокислот.
Белки образуются при связывании аминогруппы с карбоксильной группой соседней аминокислоты (так называемая пептидная связь).
В природе обнаружено около 200 аминокислот, однако в построении белков участвуют лишь 20, их называют протеиногенными. Восемь протеиногенных аминокислот являются незаменимыми, они синтезируются только растениями и не синтезируются в нашем организме. Это валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан. Иногда в их число включают условно незаменимые гистидин и аргинин, которые не синтезируются в детском организме. Аминокислотный состав белков определяет биологическую ценность пищи.
По строению молекул белки подразделяются на фибриллярные, или нитевидные (например, белки мышечной ткани животных), и глобулярные, или шаровидные (это большинство белков растений и других объектов). На свойства белков, проявляющиеся при переработке пищевого сырья, оказывает влияние их растворимость в различных растворителях. По этому признаку белки подразделяются на водорастворимые — альбумины, растворимые в растворах соли — глобулины, спиртов — проламины, щелочей — глютелины. Наибольшей биологической ценностью обладают альбумины и глобулины, они составляют главную часть экстрактивных веществ мясных бульонов. Водонерастворимые белки пшеницы (глиадин и глютенин) играют значительную роль при замесе теста из пшеничной муки.
Определенное значение имеют фосфопротеиды — белки, содержащие фосфорную кислоту. К ним относятся казеин — главный белок молока, вителлин — белок яичного желтка, ихтулин — белок, содержащийся в икре рыб.
Часть белков выполняет каталитические функции. Белковые катализаторы называются ферментами. Подавляющее большинство процессов в пищевом сырье и продуктах при их хранении и переработке происходит при участии ферментов. Ферменты являются строго специфическими соединениями и катализируют определенную реакцию между конкретными соединениями.
Ферменты по их функциям классифицируют следующим образом:
1. Оксидоредуктазы — окислительно-восстановительные ферменты;
2. Трансферазы — ферменты, катализирующие перенос атомных группировок (например, остатков фосфорной кислоты, моносахаров, аминокислот) от одного соединения к другому;
3. Гидролазы — ферменты, катализирующие расщепление органических соединений при участии воды;
4. Лиазы — ферменты, катализирующие отщепление каких-либо групп от соединений;
5. Изомеразы — ферменты, катализирующие превращения органических соединений в их изомеры;
6. Лигазы (синтетазы) — ферменты, катализирующие соединение двух молекул с расщеплением пирофосфатной связи в нукле-озидтрифосфатах.
Из других важных свойств, которые белки проявляют при переработке пищевого сырья, необходимо назвать их способность связывать воду, или гидрофильность. При этом белки набухают, что сопровождается их частичным растворением, увеличением массы и объема.
Молекулы воды обладают полярностью, и их можно представить в виде диполей с зарядами на концах, равными по значению, но противоположенными по знаку. При контакте с белком диполи воды адсорбируются на поверхности белковой молекулы, ориентируясь вокруг полярных групп белка. Таким образом, основная часть воды, более или менее прочно связываемая в пищевых продуктах белками, является адсорбционной. Различают два вида адсорбции: ионную и молекулярную. Объясняется это постоянным наличием на поверхности белковой молекулы двух видов полярных групп: свободных и связанных.
Свободные полярные группы (аминогруппы диаминокислот, карбоксильные группы дикарбоновых кислот и др.) диссоциируют в растворе, определяя величину суммарного заряда белковой молекулы. Адсорбирование воды ионизированными свободными полярными группами белка называется ионной адсорбцией.
Связанные полярные группы (пептидные группы главных полипептидных цепей, гидроксильные, сульфгидрильные и др.) присоединяют молекулы воды за счет так называемой молекулярной адсорбции.
Величина молекулярной адсорбции воды постоянна для каждого вида белка, величина ионной адсорбции изменяется с изменением реакции среды. В изоэлектрической точке, когда степень диссоциации молекул белка минимальная и заряд белковой молекулы близок к нулю, способность белка связывать воду наименьшая. При сдвиге рН среды в ту или иную сторону от изоэлектрической точки усиливается диссоциация основных или кислотных групп белка, увеличивается заряд белковых молекул усиливается гидратация белка. В технологических процессах свойства белков используют для увеличения их водосвязывающей способности.
Адсорбционная вода удерживается белками вследствие образования между их молекулами и водой водородных связей.
В растворах небольшой концентрации молекулы белка полно-
стью гидратированы.
В концентрированных белковых растворах и обводненных бел-
ковых студнях при добавлении воды происходит дополнительная
гидратация белков.
Дополнительная гидратация белков в концентрированных рас-
творах наблюдается, например, при добавлении к яичной массе,
предназначенной для изготовления омлетов, воды или молока.
В студне молекулы белка с помощью межмолекулярных связей
разной природы образуют пространственную сетку, в ячейках
которой удерживается вполне определенное для данного белка
количество воды.
Способность белка образовывать студень обусловлена конфи-
гурацией его белковых молекул. Чем больше асимметрия моле-
кул белка (отношение длины к толщине или диаметру), тем
меньшая концентрация белка необходима для образования студня.
Вода, иммобилизованная в ячейках пространственной сетки студ-
ня, участвует в образовании его структуры, приближающейся
к структуре твердого тела (студии способны сохранять форму,
механическую прочность, упругость, пластичность). Белковые студии большинства продуктов обводнены
больше, чем концентрированные растворы. Например, в миофиб-
риллахмышечных волокон теплокровных животных содержится (
15 — 20)% белков, в саркоплазме — (25 — 30)%,
Гидратация белков имеет большое практическое значение при
производстве полуфабрикатов: при добавлении к измельченным
животным или растительным продуктам воды, поваренной соли и
других веществ и при перемешивании измельченных компонентов
гидратация белков состоит из протекающих одновременно про-
цессов растворений и набухания. При гидратации повышается
липкость массы, в результате чего она хорошо формуется в
изделия (полуфабрикаты), предназначенные для тепловой кули-
нарной обработки.
Дополнительная гидратация белков имеет место при добавле-
нии к измельченному на мясорубке мясу воды. В рубленые бифш-
тексы и фрикадели добавляют воды 10% массы мяса, в фарш для
пельменей — 20%.
Сухие белки муки, крупы, бобовых, содержащиеся в продуктах
в виде частиц высохшей цитоплазмы и алейроновых зерен, при
контакте с водой набухают, образуя сплошной более или менее
обводненный студень. Примером гидратации такого
типа является приготовление теста, в процессе которого белки
муки при контакте с водой набухают, образуя клейковину.
От степени гидратации белков зависит такой важнейший показатель качества готовой продукции, как сочность.
Денатурация белков — сложный процесс, при котором под влиянием температуры, механического воздействия, химических агентов происходит изменение вторичной,третичной и четвертичной структуры белковой макромолекулы, т. е. ее нативной пространственной конфигурации. Первичная структура (аминокислотная цепочка), а следовательно, и химический состав белка не изменяются.
Наибольшее практическое значение имеет
тепловая денатурация белков. При нагревании белков усиливается
тепловое движение атомов и полипептидных цепей в белковых
молекулах, в результате чего разрушаются так называемые сла-
бые поперечные связи между полипептидными цепями (напри-
мер, водородные), а также ослабляются гидрофобные и другие
взаимодействия между боковыми цепями. В результате этого из-
меняется конформация полипептидных цепей в белковой моле-
куле. У глобулярных белков развертываются белковые глобулы
с последующим свертыванием по новому типу; прочные (кова-
лентные) связи белковой молекулы (пептидные, дисульфидные)
при такой перестройке не нарушаются. Тепловую денатурацию
фибриллярного белка коллагена можно представить в виде плав-
ления, так как в результате разрушения большого числа попереч-
ных связей между полипептидными цепями фибриллярная струк-
тура его исчезает, а коллагеновые волокна превращаются в сплош-
ную стекловидную массу.
В молекулярной перестройке белков при денатурации актив-
ная роль принадлежит воде, которая участвует в образовании но-
вой конформационной структуры денатурированного белка. Пол-
ностью обезвоженные белки, выделенные в кристаллическом виде
очень устойчивы и не денатурируют даже при длительном нагре-
вании до температуры 1000С и выше. Денатурирующий эффект
внешних воздействий тем сильнее, чем выше гидратация белков
и ниже их концентрация в растворе.
Денатурация сопровождается изменениями важнейших свойств белка: потерей биологической активности, видовой специфичности, способности к гидратации (растворению и набуханию); улучшением атакуемостипротеолетическими ферментами (в том числе пищеварительными); повышением реакционной способности белков; агрегированием белковых молекул.
Агрегирование – это взаимодействие денатурированных молекул белка, в результате которого образуются межмолекулярные связи, как прочные, например, дисульфидные, так и многочисленные слабые.
Следствием агрегирования белковых молекул является образование более крупных частиц. Последствия дальнейшего агрегирования частиц белка различны в зависимости от концентрации белка в растворе. В мало концентрированных растворах образуются хлопья белка, выпадающие в осадок или всплывающие на поверхность жидкости (часто с образованием пены).
Примерами агрегирования такого типа являются выпадение в осадок хлопьев денатурированного лактоальбумина (при кипячении молока), образование хлопьев и пены белков на поверхности мясных и рыбных бульонов. Концентрация белков в этих растворах не превы-
шает 1%.
При денатурации белков в более концентрированных белковых
растворах в результате их агрегирования образуется сплошной
студень, удерживающий всю содержащуюся в системе воду. Такой
тип агрегирования белков наблюдается при тепловой обработке
мяса, рыбы, яиц и различных смесей на их основе.
Белки в состоянии более или менее обводненных студней
при тепловой денатурации уплотняются, т. е. происходит их дегид-
ратация с отделением жидкости в окружающую среду.
Реологические
характеристики таких уплотненных студней зависят оттемпера-
туры, рН среды и продолжительности нагревания.
Денатурация белков в студнях, сопровождающаяся их уплот-
нением и отделением воды, происходит при тепловой обработке
мяса, рыбы, варке бобовых, выпечке изделий из теста.
При значениях рН среды, близких к изоэлектрической точке
белка, денатурация происходит при более низкой температуре и
сопровождается максимальной дегидратацией белка. Смещение
рН среды в ту или иную сторону от изоэлектрической точки
белка способствует повышению его термостабильности. Так, вы-
деленный из мышечной ткани рыб глобулин Х, который имеет
изоэлектрическую точку при рН 6,0, в слабокислой среде (рН 6,5)
денатурирует при 500 С, в нейтральной (рН 7,0) при 800 С.
Реакция среды влияет и на степень дегидратации белков в
студнях при тепловой обработке продуктов. Направленное измене-
ние реакции среды широко используется в технологии для улучше-
ния качества блюд. Так, при припускании птицы, рыбы, тушении
мяса, мариновании мяса и рыбы перед жаркой добавляют кислоту,
вино или другие кислые приправы для создания кислой среды со
значениями рН, лежащими значительно ниже изоэлектрической
точки белков продукта. В этих условиях дегидратация белков в студнях снижается и готовый продукт получается более сочным.
В кислой среде набухает коллаген мяса и рыбы, снижается
его температура денатурации, ускоряется переход в глютин, в ре-
зультате чего готовый продукт получается более нежным.
Пенообразование — способность белков образовывать высококонцентрированные системы жидкость-газ (пены). Это свойство белков широко используются при получении кондитерских изделий (бисквиты, пастила, зефир, суфле).
Деструкция. Молекула белков под влиянием ряда факторов может разрушаться или вступать во взаимодействие с другими веществами с образованием новых продуктов.
Для доведения продукта до
полной готовности денатурированные белки нагревают при темпе-
ратурах, близких к 1000С, более или менее продолжительное вре-
мя. В этих условиях наблюдаются дальнейшие изменения белков,
связанные с разрушением их макромолекул. На первом этапе
изменений от белковых молекул могут отщепляться такие летучие
продукты, как аммиак, сероводород, фосфористый водород, угле-
кислый газ и др. Накапливаясь в продукте и окружающей среде,
эти вещества участвуют в образовании вкуса и аромата готовой
пищи. При длительном гидротермическом воздействии происходит
деполимеризация белковой молекулы с образованием водораство-
римых азотистых веществ. Примером деструкции денатурирован-
ного белка является переход коллагена в глютин.
Деструкция белков имеет место при производстве некоторых
видов теста. В этом случае разрушение внутримолекулярных свя-
зей в белках происходит при участии протеолитических фермен-
тов, содержащихся в муке и вырабатываемых дрожжевыми клет-
ками. Протеолиз белков клейковины положительно влияет на ее
эластичность и способствует получению выпечных изделий высо-
кого качества. Однако этот процесс может иметь и отрицательные
последствия, если активность протеаз муки слишком высокая
(мука из недозревшего зерна и пр.).
В ряде случаев деструкция белков с помощью протеолитиче-
ских ферментов является целенаправленным приемом, способст-
вующим интенсификации технологического процесса, улучшению
качества готовой продукции, получению новых продуктов пита-
ния. Примером может служить применение препаратов протеоли-
тических ферментов (порошкообразных, жидких, пастообразных) для размягчения жесткого мяса, ослабления клейковины теста,
получения белковых гидролизатов.
Для взрослого человека достаточно (1 —1,5) г белка в сутки на 1 кг массы тела, т. е. примерно (85 — 100) г. Для детей потребность в белке значительно выше: до 1 года — более 4 г белка на 1 кг массы тела, для 2—3-летних — 4 г, для 3 —5-летних — 3,8 г, для 5—7-летних — 3,5 г. Повышенная потребность в белке у детей объясняется тем, что в растущем организме преобладают синтетические процессы и белок пищи необходим не только для поддержания азотного равновесия, но и обеспечения роста и формирования тела. Недостаток в пище белка приводит к задержке и полному прекращению роста организма, вялости, похуданию, тяжелым отекам, поносам, воспалению кожных покровов, малокровию, понижению сопротивляемости организма к инфекционным заболеваниям и т. д.
Наиболее близки к идеальному белку животные белки. Большинство растительных белков имеют недостаточное содержание одной или более незаменимых аминокислот. Например, в белке пшеницы недостаточно лизина. Кроме того, растительные белки усваиваются в среднем на 75%, тогда как животные — на 90 % и более. Доля животных белков должна составлять около 55 % от общего количества белков в рационе. Опыты показали, что один животный или один растительный белок обладают меньшей биологической ценностью, чем смесь их в оптимальном соотношении.
Поэтому лучше сочетать мясо с гарниром (гречихой или картофелем), хлеб с молоком и т.д.
Проблема повышения биологической ценности продуктов питания издавна является предметом серьезных научных исследований. В аминокислотном балансе человека за счет преобладания в рационе продуктов растительного происхождения намечается дефицит трех аминокислот: лизина, треонина и метионина. Повышение биологической ценности продуктов питания может быть осуществлено путем добавления химических препаратов (например, концентратов или чистых препаратов лизина) и натуральных продуктов, богатых белком вообще и лизином, в частности. Применение натуральных продуктов представляет несомненные преимущества перед обогащением продуктов химическими препаратами, поскольку во всех натуральных продуктах белки, витамины и минеральные вещества находятся в естественных соотношениях и в виде природных соединений. Среди различных натуральных продуктов особого внимания ввиду высокого содержания лизина заслуживают молочные (цельное молоко, сухое обезжиренное и цельное), творог, молочные сыворотки (творожная, подсырная) в нативном, а также концентрированном и высушенном виде.







