

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Интересное:
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
(для малого числа наблюдений)
| n | Доверительная вероятность | ||
| 0,9 | 0,95 | 0,99 | |
| 2 | 6,3 | 12,71 | 63,66 |
| 3 | 2,9 | 4,30 | 9,93 |
| 4 | 2,4 | 3,18 | 5,84 |
| 5 | 2,1 | 2,78 | 4,60 |
Лабораторное оборудование. Мерная посуда, установки для титрования, песчаные бани, фотоколориметры и другое лабораторное оборудование, обеспечивающее возможность выполнения всех операций, связанных с проведением химико-аналитических работ, и необходимую точность получаемых результатов.
Содержание задания. Краткая характеристика анализируемого сплава по способу его получения и ориентировочному составу; требования к точности и воспроизводимости выполняемых анализов; рекомендации по используемым реактивам, оборудованию и методам анализа.
Порядок работы
1. Ознакомиться с методами анализа алюминия и его сплавов, используемыми реактивами и оборудованием. При необходимости приготовить реактивы требуемого состава и концентраций.
2. Выполнить химические анализы с заданным количеством параллельных определений. При необходимости внести изменения, обеспечивающие большую точность проводимых измерений.
3. Провести математическую обработку и представить результаты с учетом доверительного интервала. Сделать выводы о соответствии состава анализируемых продуктов требованиям технологии и стандартам.
УЧЕБНО-ИССЛЕДОВАТЕЛЬСКИЕ РАБОТЫ
Эти лабораторные работы предназначены для студентов, обучающихся в магистратуре и специализирующихся в области производства легких металлов. Их выполнение связано с дальнейшим развитием навыков постановки экспериментов, углубленным изучением теории и технологии производства легких металлов. При этом цель исследования, как правило, заключается в установлении зависимостей, позволяющих обосновать оптимальный технологический режим конкретного процесса. Значительное внимание уделяется самостоятельной методической проработке предлагаемых исследований на основе имеющихся примеров и опыта их выполнения, а сами исследования носят индивидуальный характер и могут стать существенной базой при подготовке дипломных и магистерских квалификационных работ.
|
|
Работа 9. ОПРЕДЕЛЕНИЕ ОПТИМАЛЬНОЙ ПЛОТНОСТИ ТОКА ПРИ ЭЛЕКТРОЛИТИЧЕСКОМ ПОЛУЧЕНИИ АЛЮМИНИЯ
[2, с.195-201; 6, с.53-59; 12, с.33-46]
Цель работы. Теоретическое обоснование оптимальной плотности тока и ее экспериментальное определение при электролизе криолит-глиноземного расплава.
Основные определения, теория и технология
Катодный процесс при электролизе криолит-глиноземного расплава включает в себя следующие последовательно идущие стадии:
· транспорт оксифторидных и фторидных комплексов, содержащих ионы алюминия, из глубины расплава к катоду;
· распад комплексов в двойном слое с образованием свободных ионов Al3+ и их совместный разряд с комплексными ионами.
|
С ростом плотности тока в прикатодном слое уменьшается концентрация ионов, содержащих Al3+, и увеличивается концентрация ионов Na+, что вызывает сдвиг потенциала в отрицательную сторону и совместный разряд ионов алюминия и натрия (см. рисунок). В зависимости от плотности тока выделяющийся натрий растворяется в алюминии или образует самостоятельную фазу при достижении предельной растворимости.
В промышленных ваннах электролит и металл находятся в непрерывном движении, что способствует снятию перенапряжения диффузии, и алюминиевый электрод является практически равновесным. Поэтому восстановление натрия в основном объясняется протеканием реакции
3NaF + Al = 3Na + AlF3.
При постоянной величине потерь металла, определяемой скоростью его растворения в электролите, и постоянстве поверхности раздела доля потерь и отклонение от закона Фарадея будут тем меньше, чем выше плотность тока и чем большее количество металла выделяется на катоде. По достижении предельной (диффузионно-ограниченной) плотности тока выход по току снижается за счет совместного разряда алюминия и натрия. С уменьшением плотности тока удельная величина потерь растет, пока не установится равенство количеств выделяемого и теряемого металла, что соответствует нулевому выходу по току алюминия.
|
|
Лабораторное оборудование. Оборудование, необходимое для исследования электролиза криолит-глиноземного расплава, в целом соответствует применяемому при электролизе магния (см. работу 4). Желательно использование электродов из графита, что делает их более устойчивыми к окислению. Дополнительно необходимо химико-аналитическое оборудование для определения содержания натрия в металлическом алюминии.
Содержание задания. Рекомендуемый диапазон исследуемых плотностей тока, данные о температурном режиме, межполюсном расстоянии, составе электролита и продолжительности электролиза.
Порядок работы
1. Рассчитать количество компонентов, необходимое для приготовления электролита заданного состава. Все фтористые и хлористые соли предварительно просушить, а затем расплавить в алундовом, графитошамотном или графитовом тигле.
2. Предварительно прогретые электроды ввести в электролит и подать напряжение, установив силу тока, соответствующую первой из заданных плотности тока, с учетом рабочей поверхности катода. По окончании электролиза расплав вылить в разогретую до 200 °С изложницу. После охлаждения отделить королек алюминия и взвесить на аналитических весах.
3. Повторить п.2 при других заданных плотностях тока.
4. Рассчитать выход алюминия по току и установить зависимость выхода по току от катодной плотности тока.
5. Выполнить анализ алюминия на содержание металлического натрия пламенно-фотометрическим или атомно-абсорбционным методом и получить зависимость его состава от плотности тока.
6. Обосновать значение плотности тока, рекомендуемое для производственных условий, и его соответствие экспериментальным данным.
| |
[1, с.190-219; 2, с.241-246; 6, с.202-210; 12, с.47-52]
|
|
Цель работы. Знакомство с теоретическими основами электролитического рафинирования технического алюминия и экспериментальное определение поляризации электродных процессов.
Основные определения, теория и технология
|
|
 Для получения алюминия высокой чистоты отечественной промышленностью принят метод трехслойного рафинирования, разработанный В.М.Гуськовым. Сущность метода заключается в анодном растворении алюминия из его сплава с другими металлами и выделении его в чистом виде на катоде. Пространственное разделение анодного и катодного процесса по высоте ванны осуществляется за счет утяжеления анодного сплава электроположительными металлами (его плотность 3,2-3,5 г/см3) и отделения очищенного алюминия с плотностью 2,3 г/см3 от анодного металла электролитом с плотностью около 2,7 г/см3 (рис.1). Обычный состав электролита следующий, %: криолит 27-35, фторид алюминия 8-10, хлорид бария 55-60, хлорид натрия 2-4. Температура плавления такого электролита 670-730 °С, а рабочая температура при электролизе 760-810 °С.
Для получения алюминия высокой чистоты отечественной промышленностью принят метод трехслойного рафинирования, разработанный В.М.Гуськовым. Сущность метода заключается в анодном растворении алюминия из его сплава с другими металлами и выделении его в чистом виде на катоде. Пространственное разделение анодного и катодного процесса по высоте ванны осуществляется за счет утяжеления анодного сплава электроположительными металлами (его плотность 3,2-3,5 г/см3) и отделения очищенного алюминия с плотностью 2,3 г/см3 от анодного металла электролитом с плотностью около 2,7 г/см3 (рис.1). Обычный состав электролита следующий, %: криолит 27-35, фторид алюминия 8-10, хлорид бария 55-60, хлорид натрия 2-4. Температура плавления такого электролита 670-730 °С, а рабочая температура при электролизе 760-810 °С.
Несмотря на обратимость анодного и катодного процессов (Al3+ + 3 e Û Al), поляризация электродов достигает 0,36-0,37 В при рабочей плотности тока 0,5-0,6 А/см2 в результате работы ЭДС гальванической цепи амальгамного типа и диффузионного перенапряжения катодного и анодного процессов.
Различие активностей алюминия в анодном сплаве и катодном металле приводит к возникновению цепи концентрационного типа: катод (алюминий, a 1 = 1) – электролит – анод (алюминий в сплаве с медью, a 2). ЭДС этой цепи может быть вычислена по уравнению
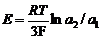 , (1)
, (1)
где a 1 и a 2 – соответственно активность алюминия в катодном металле и анодном сплаве.
Измерения ЭДС этой цепи дают интервал значений 0,040-0,045 В, которые значительно ниже общей поляризации, что связано с перенапряжением электродных процессов, имеющих преимущественно концентрационный характер.
Катодное перенапряжение вызвано замедленностью диффузии катионов, содержащих Al3 + , так как перенос тока осуществляется катионами Na+ и Ba2+. Перенапряжение на катоде
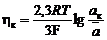 , (2)
, (2)
|
|
где a к и  – активность катионов алюминия у поверхности катода и в электролите соответственно.
– активность катионов алюминия у поверхности катода и в электролите соответственно.
Соответствующие концентрационные изменения в анолите, связанные с его обеднением катионами алюминия, приводят к анодному перенапряжению диффузии в электролите
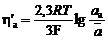 , (3)
, (3)
где a а – активность катионов алюминия в анолите.
Так как концентрация алюминия на поверхности анодного сплава меньше, чем в его объеме, то возникает дополнительное перенапряжение диффузии в анодном сплаве
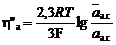 , (4)
, (4)
где  и
и 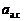 – соответственно активность алюминия в объеме анодного сплава и на его поверхности.
– соответственно активность алюминия в объеме анодного сплава и на его поверхности.
С учетом уравнений (1)-(4) рабочее напряжение на ванне при электролитическом рафинировании алюминия
U раб = – E + hк + 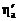 +
+ 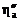 + I (R э + R ш),
+ I (R э + R ш),
где I – сила тока; R э и R ш – сопротивление электролита и ошиновки соответственно.
Измерение теоретического напряжения разложения по вольт-амперной кривой основано на приближенном соотношении
U раб = U т + I (R э + R ш + R пол), (5)
|
|
точность которого достаточна для практического определения. Здесь U т = – E – теоретическое напряжение разложения; R пол – поляризационное сопротивление электрохимической реакции катодного и анодного процессов.
Из уравнения (5) вытекает существование линейной зависимости между напряжением на электролитической ячейке и силой тока, что позволяет определить теоретическое напряжение, экстраполируя эту зависимость на I = 0 (рис.2).
Лабораторная установка. Приборы и оборудование для проведения электролиза расплавленных солей (см. работу 4), вольтметр и амперметр с изменяемыми пределам измерений для точного построения вольт-амперной кривой исследуемой электролитической ячейки.
Содержание задания. Рекомендации по температуре процесса, составе солевого расплава и анодного сплава, диапазону плотности тока.
Порядок работы
1. Приготовить анодный сплав с различным содержанием алюминия. Для этого в расплавленный алюминий при температуре 750-800 °С ввести электролитную медь до получения заданного состава сплава. Приготовленный сплав отливают в прогретую до температуры 150-200 °С стальную изложницу и после охлаждения используют для электролитического рафинирования.
2. Приготовить шихту из просушенных солей с молекулярным отношением NaF/AlF3 = 1,5. Проплавить смесь солей до получения необходимого объема заполнения электролитической ячейки. В электролит осторожно опустить предварительно прогретый анодный сплав.
3. В прикатодное пространство внести металлический алюминий и после расплавления погрузить в него графитовый катод.
4. Снять вольт-амперную кривую поляризации электродов при наименьших плотностях тока, достаточных для начала электролиза и выявления линейной части кривой (рис.2).
|
|
5. После завершения опыта вылить расплав в прогретую изложницу так, чтобы анодный сплав сохранить на дне тигля. Остатки электролита и сплава вылить во вторую изложницу. После отделения электролита от алюминия и анодного сплава материалы могут быть использованы вторично.
6. Повторить пп.4 и 5 при других составах анодного сплава согласно заданию.
7. Построить вольт-амперные кривые и дать их анализ. Определить ЭДС концентрационного элемента. По уравнению (1) рассчитать активность и коэффициент активности алюминия в анодном сплаве. Сделать вывод о долевом участии составляющих поляризации в подведенном напряжении для электролитического рафинирования алюминия.
Работа 11. РАСТВОРИМОСТЬ ЛЕГКИХ МЕТАЛЛОВ В ЭЛЕКТРОЛИТЕ
[2, с.192-201; 301-303; 6, с.46-50, 264-266; 12,с.87-94]
Цель работы. Определение вторичных потерь алюминия и магния за счет растворения в электролите.
Основные определения, теория и технология
Согласно современным представлениям, растворимость металлов в расплавленных солях имеет двоякую природу: растворение в результате металлотермической реакции и образование растворимых соединений низшей валентности. Независимо от механизма потерь, они снижают выход по току и другие показатели электролиза.
Зависимость изменения выхода по току алюминия от криолитового отношения (рис.1) показывает, что минимальные потери алюминия приходятся на расплав с к.о. = 2,7. Для щелочных электролитов потери алюминия определяются реакцией:
3NaF + Al = AlF3 + 3Na,
|
|
причем не исключается дальнейшее растворение натрия с образованием его субфторидов:
NaF + Na = Na2F.
Для кислых электролитов (т.е. при избытке AlF3) потери алюминия связаны с реакцией образования субфторида алюминия
AlF3 + 2Al = 3AlF.
Казалось бы, растворение алюминия, представляющее собой реакцию окисления алюминия, не должно происходить на катодно-поляризованной поверхности. Однако необходимо учесть, что в равновесии ток обмена на катоде составляет около 20 А/см2, в то же время как катодная плотность тока всего 0,4-0,5 А/см2. Следовательно, сдвиг потенциала от равновесного чрезвычайно мал, что делает развитие процессов окисления на алюминиевом катоде вполне возможным.
|
На рис.2 показана зависимость выхода по току магния от концентрации MgCl2 в электролите. Максимальный выход по току достигается при концентрации MgCl2 около 20 %. При концентрации MgCl2 выше 20 % выход по току постепенно понижается, что объясняется сдвигом равновесия реакции MgCl2 + Mg = 2MgCl вправо. В результате повышается концентрация одновалентных ионов магния и растет скорость их окисления анодным хлором и растворенными в электролите газами (O2, H2O). При снижении концентрации MgCl2 возникает диффузионная поляризация катода вследствие ограничения доставки ионов магния из объема расплава, что приводит к совместному разряду магния и щелочных металлов.
Таким образом, при нормальном режиме электролиза алюминия и магния значительные потери металла связаны с его растворением в результате образования ионов низшей валентности по реакции
mMen + + (n – m) Me Û nMem+, n > m, (1)
которой соответствует константа равновесия
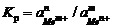 , (2)
, (2)
где  – активность ионов металла высшей и низшей валентности.
– активность ионов металла высшей и низшей валентности.
|
Растворение металла будет происходить до тех пор, пока не установится отношение активностей, отвечающее величине константы равновесия реакции (1). В реальных условиях это равновесие не достигается из-за окисления растворенного металла анодными газами кислородом воздуха на поверхности расплава и взаимодействия с примесями (H2O, 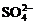 и др.).
и др.).
Поскольку химическое окисление растворенного металла происходит с большей скоростью, чем процесс растворения, то величина потерь, в основном, определяется его доставкой в область окисления или окислителя в зону реакции. Поэтому одной из важнейших задач проектирования электролизеров является обеспечение условий, при которых растворимость металла в электролите и перенос металла в зону окисления были бы минимальными. Для этого стремятся снизить температуру электролиза, подбирают электролиты с меньшей растворимостью металла, по возможности герметизируют рабочую зону, отделяют катодное пространство от анодного и т.д.
Лабораторное оборудование. Установка (рис.3) обеспечивает возможность длительной изотермической выдержки расплавленного металла в контакте с электролитом при отсутствии окислителя, благодаря подачи инертного газа и герметизации реторты.
Содержание задания. Рекомендации по используемым материалам, составам солевых систем, температуре и длительности изотермической выдержки.
Порядок работы
1. Приготовить необходимое количество электролита требуемого состава (см. работу 4). При температуре расплава, близкой к заданной, продуть объем реторты инертным газом и загрузить навеску металла или сплава. Затем герметизировать реторту и подать инертный газ для изотермической выдержки. По окончании опыта расплав вылить в изложницу и определить потери металла.
2. Повторить опыт в измененных условиях согласно заданию.
3. Рассчитать концентрацию ионов низшей валентности в расплаве с учетом растворения металла по реакциям образования субсоединений и вычислить концентрационную константу равновесия. Для расплавов с известной активностью ионов высшей валентности вычислить термодинамическую константу по уравнению (2), считая коэффициент активности ионов низшей валентности равным единице при их концентрации менее 0,05.
Рассчитать стандартное изменение энергии Гиббса и электродный потенциал исследуемого равновесия по уравнениям
 ;
; 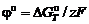 ,
,
где z – число электронов в элементарном электрохимическом акте, для стехиометрии которого вычислена величина 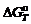 .
.
4. Представить графически и объяснить зависимость растворимости легких металлов от условий опыта. Обосновать выбор условий электролиза, обеспечивающих снижение вторичных потерь металла.
| |
[1, с.117-144; 6, с.31-39, 12, с.64-73; 18, с.95-99]
Цель работы. Исследование электропроводности солевых систем в производстве алюминия и магния в зависимости от их состава и температуры.
Основные определения, теория и технология
Электропроводность – важнейшее свойство электролита, зависящее от структуры расплава. Поскольку перенос тока обусловлен движением ионов, то электропроводность зависит от их природы и взаимодействия. Для практики электролиза важно иметь наиболее электропроводные среды, так как повышение электропроводности, при прочих равных условиях, приводит к увеличению производительности электролизеров либо за счет увеличения плотности тока при неизменном межполюсном расстоянии, либо за счет повышения выхода по току, вызванного увеличением межполюсного расстояния.
|
Наиболее сильно электропроводность зависит от природы электролита, что связано с различной способностью соединений к диссоциации (рис.1). Существенное значение при этом имеет образование комплексов, зависящее от соотношения моментов противоположно заряженных ионов.
Под моментом иона (катиона или аниона) подразумевается отношение его заряда к радиусу. При равных моментах аниона и катиона возникновение комплексов будет наименьшим, что приводит к диссоциации по схеме, характерной для галогенидов щелочных металлов с образованием простых ионов:
MeA Û Me + + A –,
где Me – щелочной металл; А – галогенид.
При большем моменте катиона комплексообразование будет идти по схеме
2 MeA Û Me ++  ,
,
и наоборот, при большем моменте аниона – по схеме
2 MeA Û Me 2 A + + A –.
При большом заряде катиона возможен еще один вариант электролитической диссоциации:
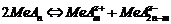 .
.
Для выхода заряженной частицы из окружения соседних ионов ей необходимо иметь энергию для разрыва связей, так называемую энергию активации, величина которой уменьшается с ростом температуры. Электропроводность подчиняется зависимости
æ = k exp(– U / RT), (1)
где æ – удельная электропроводность; k – константа; U – энергия активации.
Отклонения от экспоненциального закона связано с изменением объема расплава и разрушением комплексных частиц, что приводит к изменению энергии активации как основного переносчика тока, так и ионов, не принимавших ранее участие в переносе. В связи с этим для зависимости в координатах lgæ = f (T –1) наблюдаются существенные отклонения от линейного закона.
Таким образом, состав и природа электролита, а также его температура представляют собой важнейшие факторы интенсивного ведения электролиза расплавов.
Лабораторное оборудование. Установка для измерения электропроводности расплавов (рис.2) смонтирована на базе моста переменного тока звуковой частоты, введенного в практику Ф.Кольраушем (рис.3). Наличие емкостного компонента в проводимости электролитической ячейки приводит к сдвигу фаз между током и напряжением и делает невозможным уравновешивание моста на сопротивлениях. Связанные с этим затруднения особенно велики при измерении малых значений сопротивлений, характерных для расплавленных солей. Устранение емкостной поляризации как основного источника ошибок возможно за счет подбора необходимой частоты переменного тока, осуществляемого с помощью генератора.
|
|
|
Сущность метода измерений основана на том, что при определенном значении сопротивлений плечей моста разность потенциалов, создаваемая генератором переменного тока, становится равной нулю и фиксируется по включенному в диагональ моста индикатору (микроамперметру). При этом переменное сопротивление моста уравновешивается с сопротивлением измеряемой ячейки.
Задание на выполнение лабораторной работы включает указания по составу изучаемых солевых систем и температурному интервалу их исследования; рекомендации по методике проведения измерений и обработки экспериментальных данных.
Порядок работы
1. С помощью мостовой схемы выполнить измерения сопротивлений водных растворов солей с известной удельной электропроводностью и рассчитать постоянную сосуда (измерительной ячейки):
K = R 0æ0, (2)
где R0 – измеренное сопротивление; æ0 – удельная электропроводность эталонного раствора.
2. Приготовить смесь просушенных солей для получения электролита заданного состава и довести ее до плавления при медленном нагреве электрической печи. Плавление выполняется в сосуде (тигле), для которого ранее определена его постоянная.
3. Прогретые электроды погрузить в расплав, соблюдая идентичность условий п.1, и выполнить измерения сопротивления ячейки при различных температурах с учетом допустимого перегрева системы.
4. Изменить состав электролита согласно заданию и повторить пп.2, 3.
5. С учетом вычислений по формуле (2) рассчитать удельную электропроводность исследуемых электролитов в заданном интервале температур по формуле æэ = K / R э, где æэ – удельная электропроводность расплава; R э – измеренное сопротивление ячейки.
6. Для всех составов построить зависимости lgæэ = f (T) и lgæэ = fT –1.
7. По углу наклона линейных участков зависимостей в координатах lgæ – 1/ T определить энергию активации в уравнении (1) и ее изменение с температурой.
8. Объяснить полученные результаты и их значение для электролиза расплавленных сред.
| |
1. Алюминий. Методы химического анализа. М.: Госстандарт, 1982. 73 с.
2. Антипин Л.Н. Электрохимия расплавленных солей / Л.Н.Антипин, С.Ф.Важенин. М.: Металлургиздат, 1964. 355 с.
3. Беляев А.И. Металлургия легких металлов. М.: Металлургия, 1970. 367 с.
4. Беляев А.И. Электрометаллургия алюминия / А.И.Беляев, М.Б.Рапопорт, Л.А.Фирсанова. М.: Металлургия, 1953. 720 с.
5. Борисоглебский Ю.В. Металлургия алюминия: Учеб. пособие / Ю.В.Борисоглебский, Г.В.Галевский, Н.М.Кулагин и др. Новосибирск: Наука, 1999. 437 с.
6. Борисоглебский Ю.В. Теория и технология электрометаллургических процессов: Лаб. практикум (учеб. пособие для втузов) / Ю.В.Борисоглебский, М.М.Ветюков, В.Н.Москвитин, С.Н.Школьников. М.: Металлургия, 1994. 240 с.
7. Ветюков М.М. Электрометаллургия алюминия и магния / М.М.Ветюков, А.М.Цыплаков, С.Н.Школьников. М.: Металлургия, 1987. 320 с.
8. Годовская К.И. Технический анализ / К.И.Годовская, Л.В.Рябинина, Е.Ю.Новик, М.М.Гернер. М.: Высшая школа, 1967. 414 с.
9. Городничий Н.И. Литейное производство цветных металлов и сплавов. М.: Металлургия, 1989. 102 с.
10. Кубасов В.Л. Основы электрохимии / В.Л.Кубасов, С.А.Зарецкий. М.: Химия, 1985. 168 с.
11. Курдюмов А.В. Литейное производство цветных и редких металлов / А.В.Курдюмов, М.В.Пикунов, В.М.Чурсин. М.: Металлургия, 1982. 352 с.
12. Побежимов П.П. Металлургия коррозионно-стойких алюминиевых сплавов и отливок / П.П.Побежимов, Л.П.Нефедова, Е.В.Белов. М.: Металлургия, 1989. 150 с.
13. Наумчик А.Н. Применение новых огнеупорных материалов в алюминиевых электролизерах / А.Н.Наумчик, С.В.Александровский. Ленинградский горный ин-т. Л., 1985. 44 с.
14. Получение металлов электролизом расплавленных солей: Метод. указ. к лаб. раб. / Сост. В.В.Бурнакин. Красноярск: Красноярский ин-т., 1978. 101 с.
15. Рапопорт М.Б. Углеграфитовые межслойные соединения и их значение в металлургии алюминия / ЦНИИ «Цветметинформация». М., 1967. 67 с.
16. Сандлер Р.А. Электрометаллургия алюминия и магния / Р.А.Сандлер, А.Х.Ратнер. Ленинградский горный ин-т. Л., 1983. 94 с.
17. Справочник металлурга по цветным металлам. Производство алюминия / Под ред. Ю.В.Баймакова. М.: Металлургия, 1971. 560 с.
18. Стефанюк С.Л. Металлургия магния и других легких металлов. М.: Металлургия, 1985. 200 с.
19. Троицкий И.А. Металлургия алюминия / И.А.Троицкий, В.А.Железнов. М.: Металлургия, 1984. 400 с.
20. Филиппов С.И. Экспериментальные работы по теории металлургических процессов / С.И.Филиппов, П.П.Арсентьев. М.: Металлургиздат, 1964. 166 с.
содержание
Введение.................................................................................................................... 3
Учебные работы....................................................................................................... 6
Работа 1. Определение молекулярного состава криолита........................... 6
Работа 2. Балансовая оценка алюминиевого электролизера........................ 12
Работа 3. Получение магния металлотермическим способом..................... 26
Работа 4. Электролитическое получение магния из расплавленных хлоридов 33
Работа 5. Плавка алюминия и алюминиевых сплавов................................. 44
Работа 6. Устойчивость углеграфитовых материалов при электролизе расплавов 52
Работа 7. Анодное окисление углерода......................................................... 59
Работа 8. Химический анализ алюминия и его сплавов............................... 65
Учебно-исследовательские работы......................................................................... 72
Работа 9. Определение оптимальной плотности тока при электролитическом получении алюминия 72
Работа 10. Электролитическое рафинирование алюминия.......................... 75
Работа 11. Растворимость легких металлов в электролите......................... 79
Работа 12. Электропроводность расплавленных солей................................ 83
Рекомендательный библиографический список..................................................... 87
| |
|
|
|

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!