| t,
мин
| m,
г
| D m,
г
| V C,
г/(дм2×ч)
| T,
К
| Состав образца газовой атмосферы
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Изменить состав образца, температурные условия или состав газовой атмосферы и повторить измерения.
4. Рассчитать реакционную активность материала
 ,
,
где D m – изменение массы образца, г; t – время; S – расчетная поверхность образца, дм2.
По результатам вычисления реакционной активности углерода при различных температурах рассчитать константы уравнения
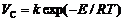 ,
,
где k – постоянная; E – кажущаяся энергия активации; R – универсальная газовая постоянная; T – температура образца при испытании, К.
Определить температурный коэффициент реакционной активности углерода
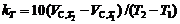 ,
,
где 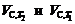 – вычисленная реакционная активность образца при температуре T 1 и T 2.
– вычисленная реакционная активность образца при температуре T 1 и T 2.
5. Сформулировать вывод о влиянии температуры, газовой атмосферы и состава углеграфитовых материалов на их реакционную активность и устойчивость в условиях электролиза.
Работа 8. ХИМИЧЕСКИЙ АНАЛИЗ АЛЮМИНИЯ
И ЕГО СПЛАВОВ
Цель работы. Знакомство с теоретическими основами и методами анализа технического алюминия и его сплавов на основе практического выполнения химико-аналитических работ.
Основные определения, теория и технология
Анализ алюминия и его сплавов обычно сводится к определению железа, кремния, меди, магния, марганца, реже калия, натрия, цинка, кальция, никеля. Присутствие примесей в алюминии зависит от технологии производства и состава используемых материалов. Соответственно возникает необходимость контроля качества товарной продукции и оценки его соответствия требованиям ГОСТа. В производстве алюминиевых сплавов введение легирующих добавок существенно изменяет их свойства и расширяет области применения алюминия. Так, марганец повышает устойчивость к коррозии; магний снижает плотность и увеличивает прочность; кремний увеличивает прочность и улучшает литейные свойства, но уменьшает пластичность; медь увеличивает прочность и т.д. Для сертификации товарной продукции является обязательным использование методов анализа в соответствии с требованиями ГОСТа. В лабораторной практике находят применение упрощенные методы анализа, удовлетворяющие по своим показателям (чувствительности, точности и воспроизводимости) решению поставленных задач.
Определение железа. Железо осаждают при щелочном растворении в виде гидрата закиси железа, затем растворяют в серной кислоте и подвергают окислительно-восстановительному титрованию по реакциям
Fe + 2Al + 2NaOH + 4H2O = 2NaAlO2 + Fe(OH)2 + 4H2;
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O;
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O.
Необходимые реактивы: 20-процентный раствор едкого натра, разбавленная в отношении 1:1 серная кислота и 0,01 М раствор марганцово-кислого калия.
Порядок анализа следующий:
1) навеску сплава массой около 1 г поместить в коническую колбу на 500 мл;
2) прилить 30 мл 20-процентного раствора NaOH, закрыть колбу воронкой и растворить на холоде;
3) после прекращения растворения прилить в колбу 40 мл H2SO4, дать постоять в холоде до полного растворения гидрата закиси железа;
4) прилить 100-120 мл воды, две капли фосфорной кислоты и титровать 0,1 М раствором KMnO4 до розовой окраски раствора. Если в сплаве много меди и получен темный раствор, то его перед титрованием следует быстро профильтровать через вату, закрыв колбу воронкой;
5) вычислить содержание железа в процентах по формуле
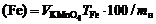 ,
,
где  – объем KMnO4, израсходованный на титрование, мл; T Fe – титр железа по 0,01 М раствору KMnO4, г/мл; m н – масса анализируемой навески, г.
– объем KMnO4, израсходованный на титрование, мл; T Fe – титр железа по 0,01 М раствору KMnO4, г/мл; m н – масса анализируемой навески, г.
Определение меди. Медь отделяют от алюминия в щелочном растворе, затем окисляют азотной кислотой и растворяют в аммиачном растворе. Количество растворенной меди устанавливают иодометрическим титрованием в уксусно-кислой среде. Основные реакции следующие:
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2;
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O;
Cu(NO3)2 = CuO + 2NO2 +  O2;
O2;
CuO + 4NH4OH = [Cu(NH3)4](OH)2 + 3H2O;
[Cu(NH3)4](OH)2 + 6CH3COOH = Cu(CH3COO)2 + CH3COONH4 + 2H2O;
2Cu(CH3COO)2 + 4KJ = 2CuJ + J2 + 4CH3COOK;
J2 + 2Na2S2O3 = 2NaJ + Na2S4O6.
Необходимые реактивы: 20-процентный раствор едкого натра, 15-процентный раствор сульфида натрия, азотная кислота, разбавленная в отношении 1:1, и ее 2-процентный раствор; аммиак, разбавленный в отношении 1:2; 15-процентные растворы уксусной кислоты и йодистого калия; 1 н раствор тиосульфата натрия.
Порядок анализа следующий:
1) около 1 г сплава (с точностью до 0,0002 г) растворить в 20-25 мм 20-процентного раствора NaOH, затем прибавить 100 мл горячей воды, 2 мл 15-процентного раствора Na2S и для уплотнения осадка нагревать в течение 10 мин;
2) сдекантировать раствор и отфильтровать на воронке; оставшийся в стакане осадок промыть 2-3 раза, добавляя по 30 мл воды;
3) воронку с осадком установить над стаканом с осадком и для растворения осадков на фильтр подать 6-8 мл разбавленной в отношении 1:1 азотной кислоты, промывая фильтр 2-3 раза 2-процентным раствором HNO3;
4) стакан с раствором нагреть на песчаной бане до полного растворения осадка, затем упарить досуха;
5) к сухому остатку прибавить 20-25 мл разбавленного в отношении 1:2 раствора аммиака и умеренно нагреть для растворения солей меди;
6) отфильтровать раствор, собирая фильтрат в коническую колбу емкостью 250 мл;
7) осадок в стакане и фильтр еще раз обработать аммиаком, затем промыть 5-6 раз горячей водой, собирая промывные воды в ту же колбу;
8) нейтрализовать аммиачный раствор 15-процентной уксусной кислотой, добавляя избыток (2-3 мл);
9) провести йодометрическое титрование, прилив к анализируемому раствору 20 мл 15-процентного раствора KJ, перемешать, покрыть стеклом и дать отстояться 5 мин в темном месте;
10) выделившийся йод оттитровать 0,1 М раствором Na2S2O3, прибавляя в конце титрования 2 мл водного раствора крахмала;
11) вычислить содержание меди в процентах по формуле
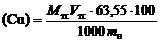 ,
,
где M тс – молярность раствора тиосульфата натрия, моль/л; V тс – объем тиосульфата натрия, мл; 63,55 – молекулярный вес меди, г/моль.
Определение кремния. Анализ основан на получении гетерополикислоты состава H4[Si(Mo3O10)4] желтого цвета и ее последующем восстановлении аскорбиновой кислотой. Окраска комплексного соединения при этом переходит из желтой в синюю. Фотометрирование окрашенного раствора производят на фотоколориметре при l = 630 нм в кюветах на 1 см светопоглощающего раствора.
Необходимые реактивы: 14 и 1-процентный раствор едкого натра, 3 М раствор соляной кислоты, 15-процентный раствор молибдата аммония, 4 М раствор серной кислоты (240 мл H2SO4 с плотностью 1,84 г/см3 разбавляют до 1 л водой), 1-процентный раствор аскорбиновой кислоты свежеприготовленный, стандартный раствор кремнекислоты.
Порядок анализа следующий:
1) около 0,1-0,15 г сплава (с точностью до 0,0002 г) поместить в никелевый или железный тигель, растворить в 10 мл 14-процентного раствора едкого натра при нагревании;
2) после растворения темного осадка, лежащего на дне, прилить к раствору 10 мл воды и нагревать в течение 10 мин;
3) раствор вместе с осадком гидроксида железа перелить в мерную колбу на 100 мл, разбавить водой до метки и хорошо перемешать;
4) профильтровать раствор через фильтр, смоченный 1-процентным раствором едкого натра, собирая фильтрат в чистую сухую колбу;
5) в зависимости от содержания кремнекислоты в приготовленном растворе в мерную колбу на 100 мл отобрать такую аликвотную часть, чтобы содержание в ней SiO2 не превышало 0,24 мг;
6) к раствору прилить из бюретки по каплям 3 М раствор HCl в количестве, необходимом для нейтрализации алюминатного раствора по индикаторной бумаге «конго-красный» (окраска бумаги меняется с красной на сиреневую);
7) добавить избыток 3 М раствора HCl (3 мл), при этом окраска бумажки становится синей;
8) разбавить раствор водой до объема 50 мл, прилить к раствору в мерной колбе 5 мл 5-процентного раствора молибдата аммония, перемешать и дать отстояться 10-15 мин для полного выявления окраски;
9) прибавить 4 М раствора серной кислоты и перемешать;
10) через 2-3 мин добавить 10 мл аскорбиновой кислоты, перемешать, довести объем раствора до метки и снова перемешать;
11) спустя 20-30 мин измерить оптическую плотность окрашенного раствора на фотоколориметре с красным фильтром (l = 630 нм);
12) зная оптическую плотность раствора, вычислить содержание кремния в исходной пробе (в процентах)
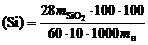 ,
,
где 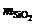 – масса кремнекислоты, найденная по градировочному графику или рассчитанная по уравнению
– масса кремнекислоты, найденная по градировочному графику или рассчитанная по уравнению  (в описанных условиях k = 0,34) для D = 0,15¸1,5 мг; 28 и 60 – молекулярный вес кремния и его оксида, г/моль.
(в описанных условиях k = 0,34) для D = 0,15¸1,5 мг; 28 и 60 – молекулярный вес кремния и его оксида, г/моль.
Для построения градуировочного графика (по пяти-шести точкам) в мерные колбы на 100 мл (соответственно пять или шесть) приливают из бюретки различные количества разбавленного раствора кремнекислоты (стандартного). В одну из колб раствор SiO2 не прибавляют, в ней готовят раствор холостого опыта. В каждую из колб прибавляют по 20 мл воды и по 2,5 мл 3 М раствора HCl. Разбавляют растворы водой до объема, равного 50 мл, и далее проводят анализ в описанном выше порядке. По его результатам строят градуировочный график D = f (m SiO2).
Математическая обработка результатов анализа. На основе данных параллельных определений вычислить стандартное отклонение среднего арифметического
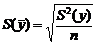 ,
,
где  – дисперсия результатов анализа,
– дисперсия результатов анализа,
 ;
;
 – среднее арифметическое значение результатов анализа из n параллельных определений; yi – результат определения в i -м анализе.
– среднее арифметическое значение результатов анализа из n параллельных определений; yi – результат определения в i -м анализе.
Ошибка среднего результата
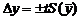 ,
,
где t – табличное значение критерия Стьюдента (коэффициента нормированных отклонений) при выбранном уровне значимости (доверительной вероятности) и числе параллельных анализов n (см. таблицу).
В этом случае определяемая величина 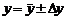 . Это означает, что с принятой вероятностью можно заключить, что искомый результат лежит в интервале от
. Это означает, что с принятой вероятностью можно заключить, что искомый результат лежит в интервале от 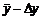 до
до 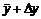 .
.



 ,
,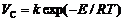 ,
,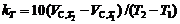 ,
,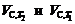 – вычисленная реакционная активность образца при температуре T 1 и T 2.
– вычисленная реакционная активность образца при температуре T 1 и T 2.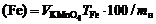 ,
, – объем KMnO4, израсходованный на титрование, мл; T Fe – титр железа по 0,01 М раствору KMnO4, г/мл; m н – масса анализируемой навески, г.
– объем KMnO4, израсходованный на титрование, мл; T Fe – титр железа по 0,01 М раствору KMnO4, г/мл; m н – масса анализируемой навески, г. O2;
O2;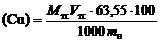 ,
,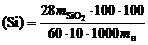 ,
,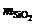 – масса кремнекислоты, найденная по градировочному графику или рассчитанная по уравнению
– масса кремнекислоты, найденная по градировочному графику или рассчитанная по уравнению  (в описанных условиях k = 0,34) для D = 0,15¸1,5 мг; 28 и 60 – молекулярный вес кремния и его оксида, г/моль.
(в описанных условиях k = 0,34) для D = 0,15¸1,5 мг; 28 и 60 – молекулярный вес кремния и его оксида, г/моль.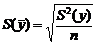 ,
, – дисперсия результатов анализа,
– дисперсия результатов анализа, ;
; – среднее арифметическое значение результатов анализа из n параллельных определений; yi – результат определения в i -м анализе.
– среднее арифметическое значение результатов анализа из n параллельных определений; yi – результат определения в i -м анализе.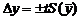 ,
,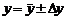 . Это означает, что с принятой вероятностью можно заключить, что искомый результат лежит в интервале от
. Это означает, что с принятой вероятностью можно заключить, что искомый результат лежит в интервале от 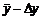 до
до 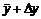 .
.

