| Металл (сплав)
| Электрохимический эквивалент,
г/(А×час)
|
| Цинк
| 1,22
|
| Железо
| 1,04
|
| Магний
| 0,45
|
| Алюминий
| 0,335
|
| Сплав МЛ-4
| 0,446
|
1.5. Поляризационные и диполяризационные процессы
При анализе работы электролитической системы (рис. 1.6) можно заметить, что сила тока со временем уменьшается. Для поддержания постоянной силы тока необходимо увеличивать напряжение внешнего источника тока.
Так как омическое падение напряжения в электролите для данной температуры постоянно, то, следовательно, увеличение сопротивления в цепи происходит за счет изменения электрохимических потенциалов электродов. Изменение или как, говорят, сдвиг потенциала от равновесного значения называют поляризацией электрода.
Наиболее распространенной причиной поляризации является изменение величины потенциала электрода при изменении концентрации ионов вблизи электрода. В частности, после замыкания электрической цепи в прилегающем к электроду А (аноду) слое электролита концентрация ионов металла увеличивается за счет дополнительного перехода ионов металла в электролит. Увеличившаяся концентрация ионов металла препятствует дальнейшему переходу ионов в электролит, что равноценно появлению дополнительного сопротивления на границе «анод – электролит», которое называют сопротивлением поляризации анода Ra. В прилегающем к электроду В (катоду) слое электролита после замыкания цепи концентрация ионов металла наоборот уменьшится за счет восстановления металла на электроде, и процесс подвода к поверхности катода ионов металла будет тормозиться образовавшимися у поверхности катода анионами электролита (в нашем случае SO 4 2-), что равноценно появлению дополнительного сопротивления на границе «катод–электролит», которое называют сопротивлением поляризации катода Rk.
В установившемся режиме ток, проходящий через электролит, определяется по формуле
 (1.7)
(1.7)
где U - напряжение источника постоянного тока, В; R - омическое сопротивление электролита, Ом; R k - поляризационное сопротивление катода, Ом; R а - поляризационное сопротивление анода, Ом.
Оценка величины поляризации очень важна для изучения коррозионных явлений. Наиболее простым способом такой оценки является метод поляризационных кривых. Сущность этого метода заключается в нахождении зависимости силы тока (или его плотности) от величины поляризации.
На рис. 1.7 представлены типичные поляризационные кривые. При отсутствии тока потенциал электрода в растворе электролита соответствует своему равновесному значению j р. При пропускании через электрод катодного тока (осаждение металла) потенциал будет отклоняться в отрицательную сторону и его значение будет j к = j р - D j к. Если же электрод соединить с плюсом источника тока (растворение металла), то его потенциал будет отклоняться в положительную сторону j а = j р - D j а.
Изменение j р ± D j в зависимости от величины тока и дает поляризационную зависимость.
Представим, что в раствор какого-либо электролита погружен металлический электрод. Как известно (см. выше), электродный потенциал металла при отсутствии побочных реакций будет определяться концентрацией ионов этого металла в растворе и температурой. Но в действительности на поверхности металла могут адсорбироваться ионы и молекулы других веществ, что приводит к протеканию соответствующих электрохимических реакций. Например, при адсорбции ионов водорода имеет место реакция 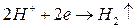 . Следовательно, если электродный потенциал металла будет отрицательным и меньше потенциала водородного электрода (см. табл. 1.3), то появляется возможность протекания реакции, связанной с расходованием электронов, оставшихся в металле после его ионизации для восстановления ионов или молекул электролита.
. Следовательно, если электродный потенциал металла будет отрицательным и меньше потенциала водородного электрода (см. табл. 1.3), то появляется возможность протекания реакции, связанной с расходованием электронов, оставшихся в металле после его ионизации для восстановления ионов или молекул электролита.
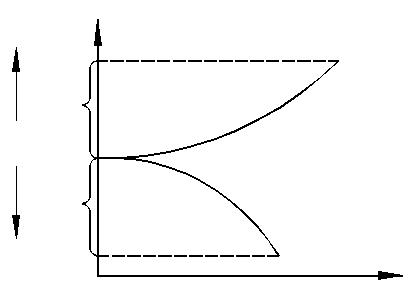
Рис. 1.7. Поляризационные кривые
Подобные процессы называются процессами деполяризации, а восстанавливаемые ионы или молекулы электролита - деполяризаторами.



 (1.7)
(1.7)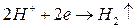 . Следовательно, если электродный потенциал металла будет отрицательным и меньше потенциала водородного электрода (см. табл. 1.3), то появляется возможность протекания реакции, связанной с расходованием электронов, оставшихся в металле после его ионизации для восстановления ионов или молекул электролита.
. Следовательно, если электродный потенциал металла будет отрицательным и меньше потенциала водородного электрода (см. табл. 1.3), то появляется возможность протекания реакции, связанной с расходованием электронов, оставшихся в металле после его ионизации для восстановления ионов или молекул электролита.


