Противокоррозионная защита
Магистральных трубопроводов и
Промысловых объектов

Министерство образования Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
«Тюменский государственный нефтегазовый университет»
Конев А.В., Маркова Л.М., Иванов В.А., Новоселов В.В.,
Торопов С.Ю., Коркин И.В., Исаев М.В.
Противокоррозионная защита
Магистральных трубопроводов и
Промысловых объектов
Учебное пособие
Тюмень 2003
УДК 620.197
Противокоррозионная защита магистральных трубопроводов и промысловых объектов:Учебно-практическое пособиепо вопросам теории и расчета. /Конев А.В., Маркова Л.М., Иванов В.А., Новоселов В.В. и др. – Тюмень: ТюмГНГУ, 2003. – 211с.
В учебно-практическом пособии приведены основные понятия о коррозионных процессах, происходящих при эксплуатации металлических сооружений и оборудования для транспортировки и хранения нефти, нефтепродуктов и газа в условиях взаимодействия с агрессивной окружающей средой.
Описан механизм химической и электрохимической коррозии стальных сооружений; указаны мероприятия по предупреждению коррозионных разрушений оборудования и сооружений; описаны применяющиеся изоляционные покрытия.
Особое внимание уделено диагностическим мероприятиям для оценки степени коррозионной опасности. Изложены основные принципы устройства и расчета электрохимической зашиты сооружений от почвенной коррозии, коррозии блуждающими токами и внутренней коррозии стальных наземных резервуаров, предназначенных для хранения нефти и нефтепродуктов.
В приложении представлены контрольные и лабораторные работы.
Учебно-практическое пособие может быть рекомендовано как для студентов вузов специальности «Проектирование и эксплуатация газонефтепроводов, газохранилищ и нефтебаз», так и для инженерно-технических работников нефтяной и газовой промышленности.
Илл. 62, табл. 30, библ. 152 назв.
Рецензенты:
Бахмат Г.В., к.т.н., профессор кафедры «Проектирование и эксплуатация
нефтегазопроводов и хранилищ» ТюмГНГУ
Таболжанов Б.Р., начальник отдела ВЛ и ЭХЗ ОАО «Сибнефтепровод»
ISBN ã Государственное образовательное
учреждение высшего
профессионального образования
«Тюменский государственный
нефтегазовый университет», 2003
Содержание
| Введение
| 5
|
| Глава 1. Механизм и закономерность процессов взаимодействия металлов с агрессивными средами
| 7
|
| 1.1. Физико-химические основы коррозии металлов
| 7
|
| 1.2. Энергетическая характеристика перехода ионов в растворах при взаимодействии металла с электролитами
| 22
|
| 1.3. Электрохимический (электродный) потенциал
| 25
|
| 1.4. Электролиз. Химическое действие электрического тока
| 27
|
| 1.5. Поляризационные и диполяризационные процессы
| 29
|
| 1.6. Взаимодействие стали и почвенного электролита
| 35
|
| 1.7. Способы защиты от коррозии
| 38
|
| Глава 2. Пассивная защита от коррозии
| 39
|
| 2.1. Битумные покрытия
| 41
|
| 2.2. Полимерные покрытия
| 52
|
| 2.3. Оберточные рулонные материалы
| 54
|
| 2.4. Покрытия из напиленного и экструдированного полиэтилена
| 58
|
| 2.5. Эпоксидные покрытия
| 65
|
| 2.6. Эмаль-этинолевое покрытие
| 66
|
| 2.7. Стеклоэмалевые покрытия
| 68
|
| 2.8. Номенклатура материалов, применяемых для изоляции трубопроводов
| 69
|
| 2.9. Ремонт покрытия
| 77
|
| Глава 3. Катодная защита подземных металлических сооружений
| 80
|
| 3.1. Принцип действия катодной защиты
| 80
|
| 3.2. Расчет катодной защиты
| 87
|
| Глава 4. Протекторная защита трубопроводов и резервуаров
| 94
|
| 4.1. Протекторная защита магистральных трубопроводов
| 95
|
| 4.2. Протекторная защита динара стальных резервуаров от почвенной коррозии
| 97
|
| 4.3. Расчет протекторной защиты с помощью групповых установок
| 99
|
| Глава V. Защита металлических сооружений от блуждающих токов
| 103
|
| 5.1 Источники появления блуждающих токов
| 103
|
| 5.2 Способы защиты от блуждающих токов
| 103
|
| 5.3. Электродренажная защита подземных трубопроводов
| 105
|
| Глава VI. Коррозионные измерения
| 114
|
| 6.1. Основные виды измерений
| 114
|
| 6.2. Определение агрессивности грунта
| 114
|
| 6.3. Определение блуждающих токов
| 120
|
| 6.4. Определение целостности изоляционного покрытия
| 125
|
| 6.5. Обследование эффективности катодной защиты
| 143
|
| 6.6. Интенсивный метод измерений
| 148
|
| 6.7. Метод отключения источника поляризации и экстраполяция на нулевое время отключения
| 157
|
| 6.8. Экстраполяционные методы
| 160
|
| 6.9. Метод компенсации
| 163
|
| 6.10. Определение эффективности работы средств ЭХЗ. Проверка возможного наличия электрического контакта труба-футляр
| 165
|
| 6.11. Измерение сопротивления растеканию заземлений по методу Ампера-Вольтметра
| 169
|
| Приложение I
| 171
|
| Приложение II
| 174
|
| Список литературы
| 198
|
Введение
Одной из основных проблем, стоящих перед человечеством, является экономия природных ресурсов, поиски их заменителей. Поэтому особенно остро ощущаются убытки, приносимые коррозией. Во всех промышленно - развитых странах они составляют 5 - 10% от национального дохода страны. Основные потери от коррозии - преждевременный выход из строя металлоконструкций, стоимость изготовления которых значительно больше стоимости использованного металла. Вторая крупнейшая статья расхода - проведение комплекса мероприятий по борьбе с коррозией. Это применение средств и методов химической защиты, нанесение различных покрытий, использование смазок и ингибиторов коррозии, дорогостоящих высоколегированных металлов.
Трубопроводы, резервуары, промысловые объекты и оборудование перекачивающих станций в процессе эксплуатации подвергаются процессу коррозии.
Коррозия металлических сооружений приводит к преждевременному износу агрегатов, установок, линейной части магистральных трубопроводов, сокращению межремонтных сроков оборудования. Кроме того, коррозия металла может оказаться причиной аварии на магистральном трубопроводе вследствие сквозной перфорации (свищей) стенок трубопроводов.
При проектировании и строительстве электрохимической защиты металлических сооружений от коррозии приходится решать комплекс задач, включающий определение коррозионной активности грунта и возможной скорости коррозии, оптимальной степени защиты, выбор средств защиты и в зависимости от них расчет протяженности защитной зоны, размещение средств защиты и их резервирование; при эксплуатации состояния электрохимзашиты, в зависимости от эксплуатации параметров системы, прогнозирование возможностей работы оборудования и его защиты, определение направлений повышения эффективности работы оборудования электрохимзащиты.
В настоящем курсе рассмотрены основные виды защитных покрытий, наносимых на трубопроводы в заводских условиях и на трассе. Так же рассмотрены такие нормативные виды активной защиты, как с использованием станций катодной защиты и протекторная. Для обеспечения защиты от блуждающих токов применяются дренажи. Для выявления дефектов изоляционного покрытия и определения эффективности использования как активной, так и пассивной защиты необходимо проведение диагностических работ. Основные виды дренажной защиты и диагностических работ представлены в данном курсе, задачей которого является введение основных понятий и параметров области защиты магистральных трубопроводов от коррозии. В курсе представлены основные расчеты, позволяющие проектировать систему активной защиты от коррозии.
Глава 1.
Механизм и закономерность процессов
взаимодействия металлов с агрессивными средами
1.1. Физико-химические основы коррозии металлов
Под коррозией (от позднелат. corrosio - разъедание) металла понимают процесс самопроизвольного окисления, приводящий к разрушению металла под воздействием окружающей среды.
Коррозионный процесс - гетерогенный (неоднородный), протекающий на границе раздела «металл - агрессивная среда», имеет сложный механизм. При этом процессе атомы металла окисляются, то есть теряют валентные электроны, переходят через границу раздела во внешнюю среду, взаимодействуют с ее компонентами и образуют продукты коррозии. В большинстве случаев коррозия металлов происходит неравномерно по поверхности, имеются участки, на которых возникают локальные повреждения. Некоторые продукты коррозии, образуя поверхностные пленки, сообщают металлу коррозионную стойкость. Иногда могут возникать рыхлые продукты коррозии, имеющие слабое сцепление с металлом. Разрушение таких пленок вызывает интенсивную коррозию обнажающегося металла, при которой происходит не только потеря массы металла, но и снижение его механической прочности.
Основной причиной коррозии металлов является их термодинамическая неустойчивость в обычных условиях. Металлы в естественных условиях (за исключением благородных) находятся в виде окислов, то есть в земной коре металлы входят в состав химических соединений (руд). Возможность коррозии и стремление металла к самопроизвольному окислению зависят от степени его термодинамической неустойчивости в конкретных условиях, то есть от величины изменения термодинамического (изобарно-изотермического) потенциала D G данного процесса. Эта величина - мера превращения потенциальной химической энергии в полезную работу данного химического процесса (например, в гальванических источниках тока - в электрическую работу). Знак D свидетельствует о том, что от значения величины G в конечном (окисленном) состоянии отнимается значение ее в начальном состоянии. Если при протекании химической или электрохимической реакции термодинамический потенциал возрастает
(D G > 0), то самопроизвольный процесс невозможен, а если убывает
(D G < 0), то самопроизвольный процесс возможен.
При неизменности термодинамического потенциала (D G = 0) система находится в равновесии. Это означает, что в процессе самопроизвольного окисления металла (коррозии) скорости реакции окисления и восстановления металла равны. Какое число атомов металла за единицу времени окислилось (потеряло валентные электроны и перешло в виде положительно заряженных катионов в электролит), такое же число ионов металла восстановилось из электролита в кристаллическую решетку металла, получив недостающие электроны от электрода (металла).
Существующие виды коррозии металлов представлены на рис. 1.1.
По механизму взаимодействия с агрессивной средой различают химическую и электрохимическую коррозию.
Химическая коррозия представляет собой процесс разрушения металла при взаимодействии с сухими газами (газовая коррозия) или жидкими неэлектролитами (коррозия в неэлектролитах) по законам химических реакций и не сопровождается возникновением электрического тока. Продукты коррозии в этом случае образуются непосредственно на всем участке контакта металла с агрессивной средой.








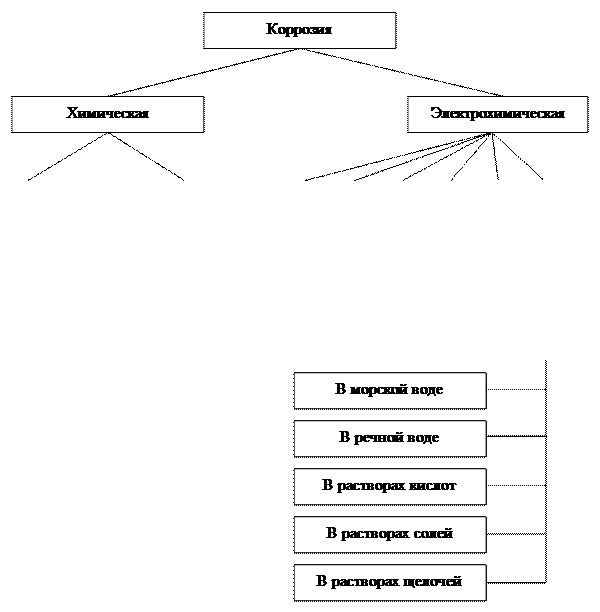
Рис. 1.1. Виды коррозии металлов
Кинетика химических реакций при окислении металлов выглядит следующим образом:
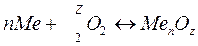 , (1.1)
, (1.1)
где n – число атомов в металле; 2 – валентность металла.
С таким механизмом протекают коррозионные процессы в газовой среде при высоких температурах и в неэлектролитах.
Трубопроводы и сооружения, предназначенные для добычи, транспорта и хранения углеводородного сырья подвержены в основном электрохимической коррозии.
Помимо деления на типы коррозии по механизму, коррозионные повреждения различают, также, по виду и расположению поражения.
Среди коррозионных повреждений различают одиннадцать основных групп, которые, в свою очередь, делятся на подгруппы (табл. 1.1).
Таблица 1.1
Типы коррозии
| Тип коррозии
| Характеристика формы
коррозионного поражения
| Схема типичного вида коррозионного поражения
|
| 1
| 2
| 3
|
| 1. Сплошная
(равномерная)
коррозия
| Формы коррозионного поражения 1а и 1б отличаются только неровностью поверхности. По изменению формы поверхности до и после коррозионного испытания выявляют наличие коррозии: она определяется изменением массы и размеров образцов до и после коррозионного испытания
|  1а 1а
|
|
| Форма 1в может быть переходной между сплошной и избирательной коррозией, например, 10в, 10г и 10е
|  1б 1б
|
|
| Тип коррозии может быть уточнен по изменениям ее формы в зависимости от времени воздействия коррозионной среды, а также по структуре металла
|  1в 1в
|
Продолжение табл. 1.1
| 1
| 2
| 3
|
| 2. Местная
(неравномерная)
коррозия
| По форме соответствует сплошной коррозии, но отличается тем, что коррозии подвержена часть поверхности или коррозия протекает с разной скоростью на его отдельных участках
| -
|
| 3. Коррозия
пятнами
| Мелкое коррозионное поражение неправильной формы; размер его площади в случае небольшого увеличения может превышать размер поля зрения
|  3
3
|
| 4. Коррозионная
язва
| Коррозионное поражение; глубина его приблизительно равна ширине
| 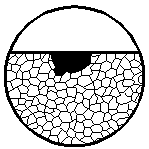 4
4
|
| 5. Питтинговая
коррозия
| Коррозионное поражение; глубина его значительно больше ширины
| 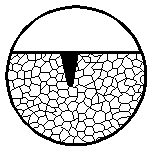 5
5
|
| 6. Подповерхностная коррозия
| Коррозионное поражение, характерное тем, что занимает на поверхности небольшую площадь и преимущественно сосредоточена под поверхностью металла
|  6а
6а
|
Продолжение табл. 1.1
| 1
| 2
| 3
|
|
| Форма коррозионного поражения, отдельные зоны которых находятся под поверхностью и обычно не имеют заметного прямого выхода на поверхность
|  6б
6б
|
|
| Форма коррозионного поражения, отдельные зоны которых находятся под поверхностью и обычно не имеют заметного прямого выхода на поверхность
|  6в
6в
|
| 7. Слоевая
коррозия
| Коррозионное поражение, внутренние слои которого включают зерна различного размера, различные фазы, включения, выделения и др.
|  7
7
|
| 8. Межкристаллитная коррозия
| Коррозионное поражение характерно наличием прокорродировавшей зоны вдоль границ зерен металла, причем может затрагивать границы всех зерен или только отдельных зерен
| 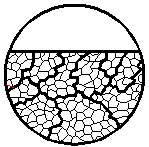 8
8
|
Продолжение табл. 1.1
| 1
| 2
| 3
|
| 9. Транскристаллитная коррозия
| Коррозионное поражение характерно наличием большого количества транскристаллитных трещин
|  9
9
|
| 10. Избирательная коррозия
| Коррозионное поражение, которому подвергнута определенная структурная фаза или компонент; если фаза образована эвтектикой, определяют, прокорродированна вся эвтектика или некоторая ее составляющая, например, цементит
|  10а
10а
|
|
| Коррозионное поражение, которому подвергнута определенная фаза металла без прямого контакта с прокорродировавшей поверхностью. В этом случае определяют, корродируют ли фазы по границам зерен или внутри зерен основной структуры. Далее определяют, не отличаются ли границы между корродирующими фазами от остальных границ (наличие фазы, трещин). Из этого заключают, проникает ли коррозионная среда по границам зерен или диффузией по всему объему зерен
|  10б
10б
|
|
| Коррозионное поражение, которому подвергнуты только отдельные зерна, физическое состояние которых изменилось, например, вследствие деформации
|  10в
10в
|
Продолжение табл. 1.1
| 1
| 2
| 3
|
|
| Коррозионное поражение, которому подвергнуты только деформируемые части зерен, при этом образующаяся зона коррозионного поражения уже, чем одно зерно и проходит через несколько зерен. Одновременно определяют, не повлияла ли деформация на изменение структуры металла, например, переход аустенита в мартенсит
| 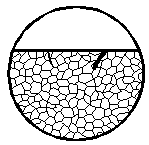 10г
10г
|
|
| Коррозионное поражение в виде зоны с рядами выделенных включений; при этом определяют возможное изменение структуры в данной зоне
|  10д
10д
|
|
| Коррозионное поражение в виде широкой зоны вдоль границы зерна. Данная форма может быть временной и ее нельзя относить к межкристаллитной коррозии; она характерна тем, что не проникает в глубину металла. Более точно ее можно определить по изменениям формы поражения коррозией в зависимости от времени коррозионного воздействия и по выделению структурных частиц в корродирующем сплаве
|  10е
10е
|
|
| Коррозионное поражение, в результате которого образуется новая фаза металлического вида, обладающая способностью понижать стойкость металла
|  10ж
10ж
|
Продолжение табл. 1.1
| 1
| 2
| 3
|
|
| Коррозионное поражение, в результате которого изменяется химический состав фазы при сохранении ее формы и места положения, например, графитизация пластин цементита в чугуне, обесцинкование латуни и др. В зоне этого изменения могут образовываться и другие продукты коррозии, например, окислы
|  10з
10з
|
| 11. Коррозия
в виде редких
трещин
| Коррозионное поражение, в результате которого образуется глубокая, немного ветвистая трещина, широкая вблизи поверхности с постепенным переходом в незначительную ширину; трещина заполнена продуктами коррозии
|  11а
11а
|
|
| Коррозионное поражение в виде глубокой трещины незначительной ширины, исходящей из коррозионной язвы на поверхности; трещина может иметь ветвистую форму
| 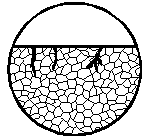 11б
11б
|
|
| Коррозионное поражение, в результате которого образуется межкристаллитная трещина незначительной ширины при отсутствии продуктов коррозии. По сравнению с межкристаллитной коррозией имеет вид единичных (редких) трещин
|  11в
11в
|
Продолжение табл. 1.1
| 1
| 2
| 3
|
|
| Коррозионное поражение, в результате которого образуется транскристаллитная трещина незначительной ширины со значительным разветвлением. По сравнению с транскристаллитной коррозией имеет вид единичных (редких) трещин. Некоторые трещины могут иметь тип частично транскристаллитного и частично межкристаллитного коррозионного поражения
| 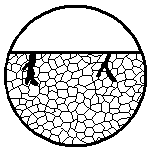 11г
11г
|
|
| Коррозионное поражение, в результате которого образуются трещины незначительной ширины, имеющие вид нитей, преимущественно параллельные поверхности и создающие зону определенной глубины. Их нельзя относить к аналогичным трещинам, образующимся вследствие деформации или плохой обработки образца
|  11д
11д
|
|
| Коррозионное поражение в виде мелких преимущественно коротких трещин внутри отдельных зерен. Трещины могут образоваться, например, вследствие действия молекулярного водорода, большого напряжения, коррозии определенной фазы
|  11е
11е
|
По расположению коррозионных повреждений различают шесть групп, представленные в табл. 1.2.
Все представленные в табл. 1.1 и табл. 1.2 виды коррозионных повреждений имеют электрохимический механизм.
Под электрохимической коррозией понимаются все процессы коррозии, на которые могут влиять электрохимические величины.
Таблица 1.2
Распределение коррозии
| Распределение коррозионного
поражения
| Характеристика
распределения
коррозионного
поражения
| Схема типового
распределения
коррозионного
поражения
|
| 1
| 2
| 3
|
| 1. Равномерно распределенное коррозионное поражение
| -
| 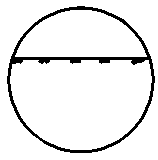 1 1
|
| 2. Неравномерно распределенное коррозионное поражение
| -
| 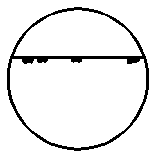 2 2
|
| 3. Коррозионное поражение в виде скоплений
| -
|  3а 3а
|
|
| -
|  3б 3б
|
Продолжение табл. 1.2
| 1
| 2
| 3
|
| 4. Коррозионное поражение на границе двух структур
| Корродируют обе структуры
|  4
4
|
|
| Корродирует только одна структура
| 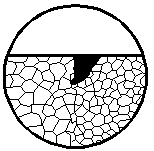 5а
5а
|
|
| Корродирует только одна структура
|  5б
5б
|
|
| Корродирует только узкая зона вдоль границы
|  6
6
|
Электрохимическая коррозия является гетерогенной электрохимической реакцией. Она подразделяется на коррозию в электролитах, почвенную, электрокоррозию, атмосферную, биокоррозию, контактную (рис. 1.1). Во всех случаях окисление металлов происходит за счет возникновения электрического тока, протекают анодные и катодные процессы на различных участках поверхности и продукты коррозии образуются на анодных участках.
При электрохимической коррозии одновременно протекают два процесса - окислительный (анодный), вызывающий растворение металла на одном участке, и восстановительный (катодный), связанный с выделением катиона из раствора, восстановлением кислорода и других окислителей на другом. В результате возникают микрогальванические элементы, и появляется электрический ток, обусловленный электронной проводимостью металла и ионной проводимостью электролитов, которые представляет собой водные растворы кислот, солей и щелочей или расплавы этих веществ.
Согласно современным представлениям переносчиками тока в электролитах являются заряженные частицы - ионы. Ионами называются молекулы или атомы вещества, утратившие электрическую нейтральность вследствие потери или приобретения дополнительных электронов. Заряд иона всегда равен или кратен элементарному заряду электрона. Число элементарных зарядов определяет валентность иона и обозначается соответствующим количеством плюсов или минусов (в зависимости от полярности заряда) над символом иона, например:
H +, Cu 2+, F е2+, ОН-, SO 4 2-.
Положительно заряженные ионы принято называть катионами, а отрицательно заряженные - анионами. Следовательно, под действием приложенного электрического поля (рис. 1.2) анионы и катионы начнут двигаться к соответствующим контактам внешней цепи, обеспечивая тем самым протекание тока в электролите.
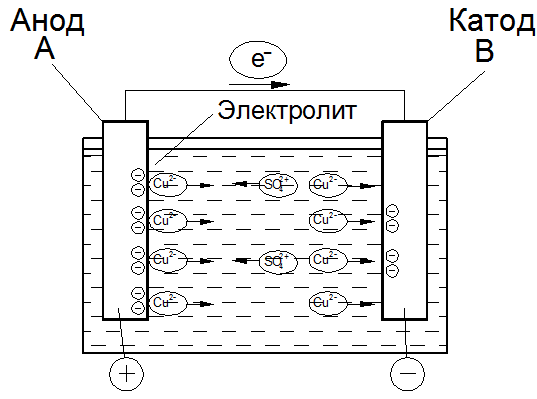
Рис. 1.2. Взаимодействие металла и электролита
Таким образом, в отличие от электронных проводников - проводников первого рода, переносчиками тока в которых электроны, электролиты являются проводниками второго рода, переносчиками тока в которых ионы.
Явление распада электрически нейтральных молекул растворенного вещества на ионы получило название электролитической диссоциации. Многочисленные опыты позволили установить, что электролитическая диссоциация происходит независимо от того, пропускается через раствор электрический ток или нет. Ниже приводятся примеры записей реакций диссоциации кислот, щелочей, солей и воды:
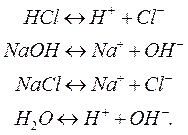 (1.2)
(1.2)
Противоположно направленная стрелка («) указывает на обратимость реакции, то есть возможность протекания реакции в обоих направлениях.
При составлении таких реакций всегда следует исходить из принципа электронейтральности, заключающегося в том, что сумма зарядов отрицательных ионов должна быть равна сумме зарядов положительных ионов. Этот закон применим как ко всему раствору, так и к отдельно взятой молекуле.
Из практики известно, что различные электролиты одинаковой концентрации по-разному проводят электрический ток. Современная теория объясняет это явление различной степенью диссоциации электролитов. Под степенью диссоциации понимают отношение числа диссоциированных молекул вещества к общему числу молекул вещества в растворе:

В самом деле, если все молекулы вещества в растворе диссоциированы, то такой раствор будет обладать высокой электропроводностью. И наоборот, если в растворе мало диссоциированных молекул, то электропроводность раствора будет невелика. Растворы, имеющие степень диссоциации 0,6... 1, называются сильными электролитами и обладают высокой электропроводимостью. Растворы, имеющие степень диссоциации 0,1... 0,6, называются средними электролитами и обладают средней электропроводимостью. Растворы, имеющие степень диссоциации менее 0,1, называются слабыми электролитами и обладают очень низкой электропроводимостью. Растворы, имеющие степень диссоциации a = 0 (неэлектролиты), электрический ток не проводят.
Анодные и катодные процессы локализуются на тех участках, где их протекание облегчено. Причины, вызывающие электрохимическую неоднородность поверхности, весьма многочисленны: макро- и микронеоднородности металла; фазовая и структурная неоднородность сплавов; неоднородность и несплошность поверхностных пленок; неоднородность деформаций и напряжений.
1.2. Энергетическая характеристика перехода ионов в растворах
при взаимодействии металла с электролитами
При взаимодействии металла с водой происходит его растворение или разрушение, так как атомы кислорода и водорода воды образуют полярные молекулы с двумя полюсами («+» и «-»), что приводит к возникновению силового электрического поля в воде. Молекулы воды внедряются в кристаллическую решетку металла, на его поверхности происходит гидратация, и переходя в воду с образованием ион-атома, несущего положительный заряд. При этом оставшиеся в металле электроны носят отрицательный заряд. Ион-атом окружается молекулами воды, происходит образование, у поверхности металла, двойного электрического слоя и возникает разность потенциалов между поверхностью металла и слоями раствора, прилегающими к нему.
Диссоциация молекул вещества под действием дипольных молекул воды называется гидратацией, а перешедшие в раствор ионы вещества, окруженные молекулами воды (рис. 1.3), называются гидрат-ионами.

Рис. 1.3. Гидратация растворенных в воде ионов поваренной соли (NаС l)
В момент погружения металла в электролит начинается реакция растворения (ионизации), связанная с гидратирующим действием молекул воды:
 (1.3)
(1.3)
где n - валентность атомов металла, е - отдаваемый электрон.
При ионизации нейтрального атома металла на поверхности металла (после ухода в раствор иона Меn+) остается n зарядов, е отрицательной полярности, а электролит соответственно приобретает n зарядов, е положительной полярности.
По мере ухода ионов в раствор отрицательный заряд поверхности металла будет возрастать. Приграничные слои раствора, насыщаясь ионами металла, начнут приобретать все более положительный заряд. При этом возникнет разность потенциалов между металлом и раствором, ведущая к возникновению реакции восстановления (кристаллизации) металла и препятствующая дальнейшему растворению металла:
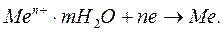 (1.4)
(1.4)
Наконец, может наступить момент, когда скорости растворения и восстановления металла сравняются - наступит состояние динамического равновесия, т.е. количество ионов металла в растворе и соответственно электронов в металле будет оставаться постоянным:
 (1.5)
(1.5)
Таким образом, граница раздела «металл - раствор» будет представлять собой своеобразный конденсатор (рис. 1.4), называемый двойным электрическим слоем.
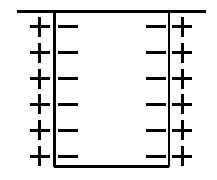
Рис. 1.4. Двойной электрический слой на границе «металл - электролит»:
«+» - положительно заряженные ионы металла,
«-» - отрицательно заряженные электроны
Образование двойного электрического слоя происходит почти мгновенно. Однако установление динамического равновесия не означает, что процессы растворения и восстановления металла прекратились. Состояние равновесия представляет собой такое состояние, когда скорости реакций ионизации и кристаллизации равны – то есть число атомов металла, превратившихся в ионы, в течение определенного промежутка времени равно числу ионов, кристаллизующихся на металле за такой же промежуток времени. В этом случае устанавливается равновесие между разностью потенциалов в слое и разностью между свободными энергиями ионов металла в металле и в растворе. Это состояние соответствует равновесному электродному потенциалу и зависит от свойств ионов и их концентрации в растворе.
1.3. Электрохимический (электродный) потенциал
Присутствие свободных зарядов на поверхности металла с одной стороны и заряженных ионов в растворе с другой стороны приводит к возникновению разности потенциалов на границе «металл - раствор». Такая разность потенциалов между металлом и электролитом называется электрохимическим или электродным потенциалом металла. Потенциалы являются отрицательными, если сами металлы заряжены отрицательно по отношению к раствору, и положительными, если металлы заряжены положительно.
Значение электродного потенциала зависит от концентрации и вида ионов в растворе, температуры и ряда других факторов. Поэтому для сравнительной оценки электролитической стойкости металлов пользуются стандартными электродными потенциалами. Стандартный или нормальный электродный потенциал - это разность потенциалов между металлом, погруженным в раствор его соли, содержащей 1 г-ион металла в 1 л, и электродом сравнения, измеренная в нормальных условиях. В качестве электрода сравнения, как правило, используют нормальный водородный электрод, потенциал которого принимается равным нулю.
Нормальный водородный электрод представляет собой платиновый электрод, покрытый тонко измельченной платиной, погруженный в раствор HCl, и омывается пузырьками газообразного водорода, продуваемого через раствор (рис. 1.5). Платиновый электрод адсорбирует на своей поверхности водород, образуя водородный мешочек. Электролит водородного электрода в расчете на 1000 г воды содержит 43,18 г соляной кислоты, а обтекающий его поток водорода имеет давление 1 кгс/см2. Потенциал нормального водородного электрода принимается равным нулю.

Рис. 1.5. Нормальный водородный электрод
Равновесные потенциалы различных электродов в растворах собственных солей, в которых концентрация равна единице, измеренные относительно нормального водородного электрода, называются нормальными потенциалами. Они образуют нормальный электрохимический ряд напряжений, по которому можно определить, какой из пары взятых металлов будет разрушаться (служить анодом) и степень опасности коррозийного процесса. Электрохимический ряд напряжений представлен в виде табл. 1.3.
Электрохимические потенциалы являются мерой, позволяющей оценить способность металла к переходу в раствор в виде ионов. Чем отрицательнее потенциал металла, тем менее прочно он удерживает свои ионы и тем более склонен к коррозии. Положительные значения потенциалов указывают на коррозионную стойкость металлов (благородность). Металлы, стоящие в таблице выше водорода, положительны по отношению к раствору и принимают из раствора положительные ионы.
Таблица 1.3













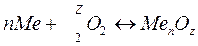 , (1.1)
, (1.1) 1а
1а
 1б
1б
 1в
1в
 3
3
 4
4
 5
5
 6а
6а
 6б
6б
 6в
6в
 7
7
 8
8
 9
9
 10а
10а
 10б
10б
 10в
10в
 10г
10г
 10д
10д
 10е
10е
 10ж
10ж
 10з
10з
 11а
11а
 11б
11б
 11в
11в
 11г
11г
 11д
11д
 11е
11е
 1
1
 2
2
 3а
3а
 3б
3б
 4
4
 5а
5а
 5б
5б
 6
6

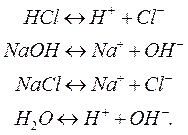 (1.2)
(1.2)

 (1.3)
(1.3)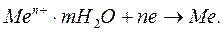 (1.4)
(1.4) (1.5)
(1.5)




