 (1.8)
(1.8)
Освобожденные электроны вновь могут участвовать в реакции выделения водорода и тогда процесс саморастворения металла (коррозии) становится непрерывным. Если по каким-либо причинам одна из реакций (ионизация металла или его деполяризация) затруднена, то процесс затухает.
Установившийся в результате процесса электродный потенциал металла можно определить следующим образом. Отметим на вертикальной оси потенциалов (рис. 1.8) значения равновесного потенциала металла  и потенциала адсорбированного на металле водорода
и потенциала адсорбированного на металле водорода 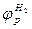 . Поляризация металла вследствие отбора электронов реакцией восстановления водорода в принципе не отличается от поляризации металла под действием внешнего тока. Поэтому на диаграмме можно нанести анодную поляризационную характеристику металла
. Поляризация металла вследствие отбора электронов реакцией восстановления водорода в принципе не отличается от поляризации металла под действием внешнего тока. Поэтому на диаграмме можно нанести анодную поляризационную характеристику металла 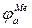 согласно рис. 1.8. Аналогично наносится и катодная поляризационная характеристика адсорбированного на металле водорода
согласно рис. 1.8. Аналогично наносится и катодная поляризационная характеристика адсорбированного на металле водорода  . Точка пересечения этих двух кривых и будет определять значение установившегося потенциала и скорость коррозии, так как в соответствии с законом Фарадея легко пересчитать величину тока коррозии на количество растворенного металла.
. Точка пересечения этих двух кривых и будет определять значение установившегося потенциала и скорость коррозии, так как в соответствии с законом Фарадея легко пересчитать величину тока коррозии на количество растворенного металла.
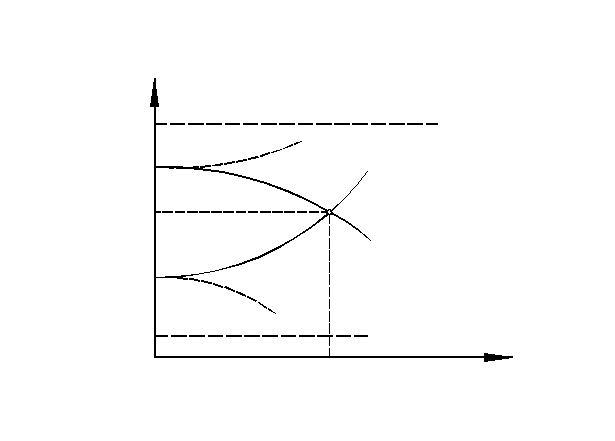
Рис. 1.8. Диаграмма коррозии металла с водородной поляризацией
Исходя из анализа рис. 1.8 можно сделать следующие выводы:
q коррозия возможна только в случае, если электродный потенциал металла более отрицателен, чем потенциал адсорбированного деполяризатора;
q чем выше поляризация одной из сопряженных реакций (ионизация металла или восстановление деполяризатора), тем меньше скорость коррозии, и наоборот, чем меньше поляризация, тем выше скорость коррозии. На рис. 1.9 представлен такой пример, когда поляризация водородной реакции возросла (точка А) и уменьшилась (точка В) - ток коррозии в точке А снизился, а в точке В - увеличился.
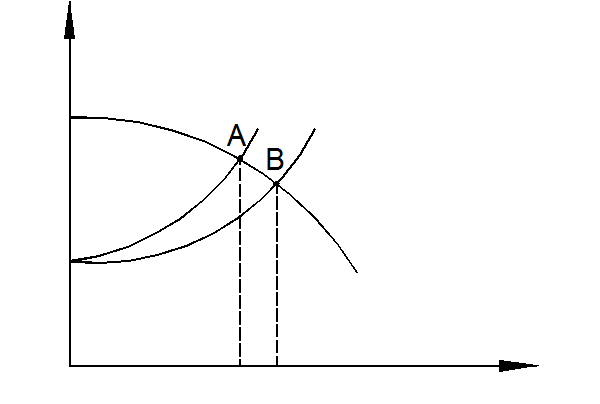
Рис. 1.9. Влияние величины поляризации на скорость коррозии
Деполяризация может быть обусловлена не только водородом. В частности, в нейтральных средах деполяризатором может служить растворенный в электролите кислород
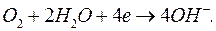 (1.9)
(1.9)
Степень кислотности (щелочности) раствора электролита характеризуется величиной водородного показателя рН. Водородный показатель рН - это отрицательный десятичный логарифм концентрации водородных ионов в растворе, т.е. рН = lg [Н+].
Вода, являясь растворителем в электролитах, обладает интересным свойством - произведение концентрации ионов водорода H + и ионов гидроксила ОН- в воде постоянно и равно [Н+] × [ O Н-] = 10-7 × 10-7 = 10-14. Это позволяет вычислить [Н+], если известна [ОН-], и наоборот. Так как все кислоты диссоциируют с образованием ионов водорода, а щелочи с образованием ионов гидроксила, то растворы с [Н+] от 100 до 10-7 (рН = 0... 7) принято считать кислыми, а с [ OH - ] от 100 до 10-7 (рН = 7... 14) - щелочными (рис. 1.10). Реакцию химически чистой воды (рН = 7) считают нейтральной.
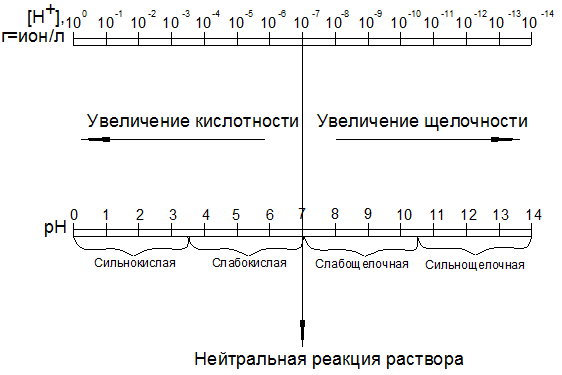
Рис. 1.10. Шкала кислотности (щелочности) растворов
1.6. Взаимодействие стали и почвенного электролита
Согласно теории электрохимической коррозии разрушение металла обусловлено работой множества короткозамкнутых гальванических элементов, образующихся вследствие неоднородности среды и металла. При работе коррозийного элемента уменьшается разность начальных потенциалов, что сопровождается уменьшением коррозионного тока. Этот процесс называется поляризацией. Различают анодную и катодную поляризацию. При анодной поляризации, в случае усиленного растворения металла, ионы металла медленнее переходят в раствор, чем электроны отводятся в катодную область, и у поверхности электрода накапливаются положительные ионы металла, потенциал анода смещается в сторону положительных значений. Катодная поляризация сопровождается смещением потенциала электрода в отрицательную сторону и вызывается в основном малой скоростью электрохимической реакции соединения деполяризаторов с электронами. Участки, на которых растворяется металл, называются анодными, на них ион-атомы железа переходят в раствор, а на катодных - ток выходит в грунт. Электрохимические процессы на аноде и катоде различны, но взаимосвязаны, и, как правило, самостоятельно не протекают. Такая связанная система называется коррозионным микроэлементом. На анодных участках осуществляется окисление с образованием ионов металла Fe 2+, а на катодных - под влиянием кислорода образуется гидроокись (в результате кислородной деполяризации)

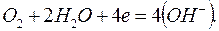 (1.10)
(1.10)
Ионы железа и гидроксила взаимодействуют и образуют нерастворимый осадок Fe (ОН)2, который разлагается на окись железа и воду:
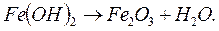 (1.11)
(1.11)
Высвобождающиеся при окислении электроны от анодного участка по металлу изделия протекают к катоду и участвуют в реакции восстановления (рис. 1.11).
В некоторых случаях возможны сложные процессы коррозии при одновременном воздействии двух или более факторов. К ним относятся коррозия под напряжением, щелевая, коррозионная эрозия, коррозионная кавитация. Скорость коррозионных процессов зависит от многих факторов, связанных как со свойствами, составом и строением металлического материала, так и со свойствами среды и внешними воздействиями. Для стальных трубопроводов, уложенных в грунт, скорость разрушения зависит во многом от коррозионности грунта, в частности, от типа грунта, состава и концентрации веществ, содержания влаги, проникновения воздуха в грунт, структуры грунта, температуры и удельного сопротивления грунта, наличия в грунте бактерий, активизирующих коррозионные процессы. Оценивается коррозионная активность грунта по величине его удельного электросопротивления (чем меньше r, тем выше степень коррозии). Важной характеристикой грунта является и водородный показатель рН среды (увеличение скорости коррозии при уменьшении рН).

Рис. 1.11. Гальванический коррозионный элемент.
Схема взаимодействия стали и почвенного электролита
На интенсивность коррозии оказывает влияние неоднородность металла, механические напряжения, температуры и т.д. Неоднородность металла приводит к появлению коррозионных микроэлементов (микропар) в местах соприкосновения грунтов или в месте изменения физических свойств грунта. Коррозия может произойти и при образовании микропары из-за наличия макровключений – окалины, царапины, вмятины, наклепа, поперечных и продольных сварных швов, макроструктурной неоднородности физико-химических свойств почв (например, при неоднородном поступлении кислорода к поверхности трубопровода, расположенном под полотном дороги). Существенное влияние на скорость коррозии оказывает жизнедеятельность анаэробных бактерий, особенно в почвах, содержащих большее количество сульфатных солей. В этом случае происходит образование серной кислоты и усиление коррозионных процессов.
Способы защиты от коррозии
Продлить срок службы трубопроводов и резервуаров можно, применяя следующие методы защиты:
- изоляция поверхности металлических изделий от агрессивности среды, то есть использование пассивной защиты путем нанесения на поверхность металла слоя химически инертного относительно металла и агрессивной среды вещества с высокими диэлектрическими свойствами;
- воздействие на металл с целью повышения его коррозионной устойчивости, которое может быть реализовано двумя способами - обработкой окислителями, вследствие чего на его поверхности образуется пленка из продуктов коррозии и нанесением на металлические конструкции из малостойкого металла тонкого слоя другого металла, который обладает меньшей скоростью коррозии в данной среде;
- воздействие на окружающую среду с целью снижения ее агрессивности, то есть введение ингибиторов (замедлителей) коррозии;
- использование электрохимической защиты (катодной, протекторной и дренажной).
Глава 2.



 (1.8)
(1.8) и потенциала адсорбированного на металле водорода
и потенциала адсорбированного на металле водорода 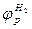 . Поляризация металла вследствие отбора электронов реакцией восстановления водорода в принципе не отличается от поляризации металла под действием внешнего тока. Поэтому на диаграмме можно нанести анодную поляризационную характеристику металла
. Поляризация металла вследствие отбора электронов реакцией восстановления водорода в принципе не отличается от поляризации металла под действием внешнего тока. Поэтому на диаграмме можно нанести анодную поляризационную характеристику металла 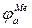 согласно рис. 1.8. Аналогично наносится и катодная поляризационная характеристика адсорбированного на металле водорода
согласно рис. 1.8. Аналогично наносится и катодная поляризационная характеристика адсорбированного на металле водорода  . Точка пересечения этих двух кривых и будет определять значение установившегося потенциала и скорость коррозии, так как в соответствии с законом Фарадея легко пересчитать величину тока коррозии на количество растворенного металла.
. Точка пересечения этих двух кривых и будет определять значение установившегося потенциала и скорость коррозии, так как в соответствии с законом Фарадея легко пересчитать величину тока коррозии на количество растворенного металла.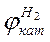
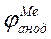
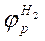

 Рис. 1.8. Диаграмма коррозии металла с водородной поляризацией
Рис. 1.8. Диаграмма коррозии металла с водородной поляризацией
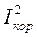
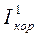
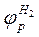
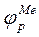

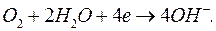 (1.9)
(1.9)

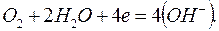 (1.10)
(1.10)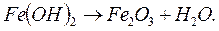 (1.11)
(1.11)



