По современным представлениям плазматическая мембрана является жидкокристаллическим образованием, толщиной около 10 нм. Она имеет трехслойную структуру. Внутри располагается два слоя фосфолипидов. Гидрофильные части располагаются к наружу и внутрь клетки. Бислой фосфолипидов покрыт периферическими белками. Периферические белки состоят из наружного и внутреннего слоев. Они имеют заряд, который обусловлен расположением карбонильной и аминогрупп. Наружный слой белков заряжен отрицательно (из-за СОО-), а внутренний – положительно (NH+). Между фосфолипидами встроен холестерин, а также некоторые пигменты, определяющие функции мембран. Например, в мембранах наружного сегмента палочек сетчатки находится родопсин. Кроме поверхностных белков в мембране располагаются интегральные белки. Этот тип белков образует ионные каналы, транспортные системы (белки-переносчики, ионные насосы – АТФазы) и др. На поверхности мембран располагаются различного рода рецепторы. Их, как правило, образуют гликолипиды или гликопротеины. Клеточные мембраны обладают разнообразными функциями. 1. На наружной поверхности плазматических клеток расположены антигенные детерминанты, образованные гликолипидами и гликопротеидами. Эти компоненты играют также основную роль при узнавании клеток, в процессах контактного торможения и переноса мембранных компонентов. 2. Плазматические мембраны содержат большое количество ферментов, причем, мембраны разного происхождения существенно различаются между собой в этом отношении. 3. Одной из функций мембран является секреция клеточных стенок (бактерии, дрожжи, растения). 4. Мембраны обладают связывающими и рецепторными свойствами. Поверхность плазматических мембран обладает способностью связывать ряд ионов, небольших молекул и полимерных соединений, гормонов (рис.2).

Рис.2 Строение клеточной мембраны. а – модель мембраны; б – электрическая эквивалентная схема мембраны и работа Na+/K+-AТФ-азы. (Рис. взят из кн.: Фунд. и клинич.физиол. Под ред. А.Камкина и А.Каменского,2004.).
Особое значение имеет транспортная функция мембран. Различают несколько видов транспорта веществ через мембрану.
Пассивный транспорт.
Пассивный транспорт – это транспорт веществ по градиенту, который сопровождается уменьшением свободной энергии системы.
Свободная энергия системы - это энергия, которая тратится на совершение работы. В данном случае - это энергия, которая будет затрачена на перенос вещества. Источником этой энергии является градиент (Г). Градиент – это разница в параметрах системы. Например, концентрационный градиент, электрохимический градиент, осмотический и т.д. Таким образом, градиент является векторной величиной, и вектор направлен от большего значения параметра к меньшему. Различают следующие виды пассивного транспорта.
Простая диффузия. Способом простой диффузии через клеточную мембрану, через ее билипидный слой, проникают незаряженные липофильные вещества, жиры, спирты, газы (кислород и углекислый газ). Растворимость в жирах для многих веществ зависит от окружающей их среды, например от pH. Многие молекулы в зависимости от pH существуют либо в протонированной (положительно заряженной), либо в непротонированной (незаряженной) форме. Протонированная молекула проходит через мембрану хуже, чем нейтральная (непротонированная). Это свойство используется в терапии, например, регуляция жирорастворимости лекарств используется при лечении передозировки барбитуратов для уменьшения фенобарбитала в крови. При нормальном рН крови (7,4) половина молекул фенобарбитала находится в протонированной форме, а половина – в непротонированной. В мочу через мембраны клеток почек легко переходит только непротонированная форма фенобарбитала. Введение бикарбоната натрия повышает рН крови, в результате чего в щелочной среде некоторые протонированные молекулы фенобарбитала теряют протон. Увеличение количества непротонированных, проходящих через мембрану молекул фенобарбитала, усиливает его выведение с мочой и снижает его содержание в организме. Основными свойствами простой диффузии являются: диффузия происходит по электрохимическому или химическому градиенту; скорость диффузии линейно зависит от градиента концентрации вещества; диффузия является ненасыщенным процессом, ее можно увеличивать неограниченно, энергия, необходимая для диффузии, находится в градиентах.
Облегченная диффузия. Данный вид диффузии обеспечивается наличием специализированных каналов или специализированных переносчиков. Облегченная диффузия также происходит по электрохимическому или химическому градиенту. Вещества связываются с белком-переносчиком, который в процессе переноса вещества испытывает обратимые конформационные изменения. Данный вид диффузии является ограниченным по скорости. Процесс является насыщенным, поскольку зависит от наличия в мембране определенного количества белков -переносчиков или белков каналов. Энергия, необходимая для переноса, определяется градиентом переносимых веществ.
Осмос. Осмос – это движение воды из области с низкой концентрацией растворенного вещества в область с высокой концентрацией растворенного вещества. Сила, которая обеспечивает движение воды, называется осмотическим давлением. Осмос обеспечивает регуляцию объема клеток, предотвращает их набухание и обезвоживание.
Активный транспорт.
Активный транспорт – это транспорт противоградиентный, который сопровождается увеличением свободной энергии системы.
При этом виде транспорта вещества перемещаются против их градиента. Для транспорта необходим транспортный белок. Вследствие этого, процесс является насыщенным и имеет ограничение по скорости. Для энергетического обеспечения процесса требуется гидролиз аденозинтрифосфата (АТФ). Существует два типа активного транспорта: первично активный транспорт и вторично активный транспорт.
Первично активный транспорт происходит за счет энергии, образующейся непосредственно при гидролизе АТФ или других высокоэнергетических фосфатов. Этим способом транспортируются электролиты.
Ионные насосы могут быть сгруппированы в три класса P,V и F на основании особенностей их молекулярной организации (рис.3). Все три класса АТФаз имеют одно или более мест связывания с АТФ на цитозольной поверхности мембраны.
Ионные насосы класса Р самые простые по структуре и состоят из четырех трансмембранных полипептидных субъединиц -2α и 2β. Большая α-субъединица фосфорилируется в течение процесса транспорта, сквозь нее перемещаются транспортируемые ионы.
Первый тип насосов класса Р – это несколько Са2+-АТФаз. Одна из Са2+-АТФаз расположена в плазматической мембране клетки и транспортирует ионы кальция из клетки во внеклеточную среду. Другие Са2+- АТФазы расположены в мембране внутриклеточных структур, например, саркоплазматическом ретикулуме мышечных клеток. Они транспортируют ионы кальция из цитоплазмы в саркоплазматический ретикулум. Некоторые Са2+- АТФазы находятся в мембране ряда внутриклеточных органелл, в которые они транспортируют ионы кальция. Благодаря работе Са2+- АТФаз концентрация ионов кальция в цитоплазме поддерживается на много меньшем уровне, чем во внеклеточной среде.
Вторым типом насосов класса Р является насос, сопрягающий транспорт ионов натрия и калия, который выкачивает три иона натрия из клетки, одновременно вводя два иона калия в клетку против его электрохимического градиента, что вносит свой вклад в образование мембранного потенциала покоя. Основой такого электрогенного Na+/K+-насоса является Na+/K+ -АТФаза, которая расположена исключительно в плазматической мембране клетки.
Третий тип насоса класса Р найден в некоторых секретирующих кислоту в клетках. Он транспортирует протоны (ионы Н+) из клетки, а ионы К+ в клетку.
Вторично активный транспорт происходит за счет энергии градиентов. Градиенты, в свою очередь, создаются первично активным транспортом. Вторично активным транспортом через мембрану проходят неэлектролиты (аминокислоты, моносахара, некоторые ионы). Различают две формы вторично активного транспорта: котранспорт и антипорт (или встречный транспорт). Котранспорт происходит, если два вещества перемещаются через клеточную мембрану однонаправлено с помощью одного и того же энергозависимого переносчика.
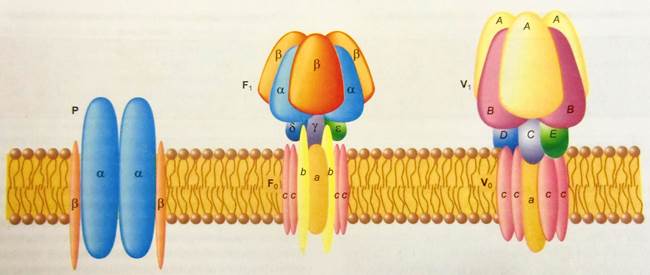
Рис.3.Три класса АТФ-зависимых ионных насосов. (Рис. взят из кн.: Фунд. и клинич. физиол. Под ред. А.Камкина и А.Каминского).
Примером котранспорта может служить перенос моносахаров и аминокислот в кишечнике. Этот механизм вторично активного транспорта использует градиент ионов натрия. Транспортный интегральный белок (натрий-, калий-АТФаза) поддерживает низкую концентрацию ионов натрия внутри клетки (14мЭкв/л), удаляя ионы натрия из клетки и, таким образом, поддерживая его высокую концентрацию вне клетки (140мЭкв/л). Концентрация ионов натрия вне клетки выше, следовательно, высока вероятность связывания внеклеточного ионов натрия с наружной поверхностью мембранного белка–переносчика, участвующего в процессе котранспорта. Последующее присоединение молекулы сахара или аминокислоты к наружной поверхности того же транспортного белка сопровождается конформационными изменениями, при которых наружная поверхность белка экспонируется внутрь клетки. В результате ионы натрия вместе с молекулой сахара или аминокислоты переносятся внутрь клетки. Примером антипорта может служить транспорт ионов водорода из клетки и кальция.
Натрий-водородный обменник использует электрохимический градиент ионов натрия, созданный натрий-калий- АТФазой, для переноса ионов водорода из клетки по механизму вторично активного транспорта. При этом процессе связываниевнеклеточного иона натрия и внутриклеточного иона водорода с противоположными сторонами белка-переносчика приводит к конформационным изменениям его структуры и положению его в мембране. Происходящий при этом перенос ионов натрия в клетку и ионов водорода из клетки служит буферным механизмом, который предотвращает подкисление клетки.
Натрий-кальциевый обменник использует в своей работе электрохимический градиент ионов натрия, созданный натрий-, калий-АТФазой. Он переносит из клетки по механизму вторично активного транспорта ионы кальция. Натрий-кальций обменник, как и другие транспортные белки, может переносить вещества через мембрану в любом направлении. Однако, концентрация ионов натрия на наружной поверхности клеточной мембраны в 10 раз выше. Следовательно, внеклеточные ионы натрия чаще связываются с наружной поверхностью транспортного белка. Одновременное связывание кальция с цитозольной поверхностью того же белка приводит к изменению расположения сторон белка в мембране, которое сопровождается обменом внеклеточного натрия на внутриклеточный кальций. Внеклеточный натрий на внутриклеточный кальций может обмениваться в соотношении 2:1 (электрически нейтральный обмен) или в соотношении 3:1 (электрогенный). В любом случае последующее уменьшение внутриклеточного кальция будет ингибировать кальций - зависимые процессы возбуждения (высвобождение нейромедиатора, мышечное сокращение). Применение гликозидов для повышения силы сердечных сокращений связано с работой натрий-кальций-обменника. Например, гликозиды наперстянки связываются с внешней поверхностью α-субъединицы натрий-, калий-АТФазы и ингибируют ее активность. Вследствие этого подавляется активное удаление натрия из клетки. Повышается его внутриклеточная концентрация. Накопление натрия на внутренней поверхности клеточной мембраны косвенно влияет на транспорт кальция. Так как, уменьшается электрохимический градиент и снижается активность натрий-кальций обменника. Последующее накопление кальция в цитоплазме клетки обеспечивает пополнение его запасов, необходимых для активации сократительных белков в клетках сердечной мышцы, увеличивая тем самым силу сердечных сокращений.
Для понимания механизмов генерации биопотенциалов необходимо рассмотреть транспорт ионов через мембрану. В соответствии с мембранно-ионной теорией электрогенеза роль мембран заключается в обеспечении избирательного транспорта ионов, так как, именно поток ионов через мембрану, диффузия ионов, и создает разность потенциалов между внутренним содержимом клетки и ее наружным окружением.
2.2.3.Транспорт ионов.
Транспорт ионов через мембрану без создания специализированных ионных каналов в мембране испытывал бы значительные трудности. Известно, что ион заряженная частица: ионы натрия, ионы калия, ионы кальция – положительно заряженные, а ионы хлора – отрицательно заряженные частицы. Структура мембраны такова, что ее наружная сторона заряжена отрицательно (СОО-), а внутренняя – положительно (NH+). Поэтому и положительно заряженные, и отрицательно заряженные ионы не смогли бы проникнуть внутрь или выйти наружу. Кроме того, ионы натрия, калия, кальция являются гидратированными. Они связывают воду, образуя гидратные оболочки, что также затрудняет переход иона через билипидный слой мембраны. Поэтому, в процессе эволюции создаются специализированные транспортные системы для ионов – ионные каналы.
Ионный канал – это специализированные белки клеточной мембраны, которые образуют гидрофильный проход, по которому заряженные ионы могут пересекать клеточную мембрану по электрохимическому градиенту. Этот вид транспорта иногда рассматривают как форму облегченной диффузии.
2.2.3.1.Структура ионного канала. Ионные каналы состоят из белков сложной структуры (белков –каналоформеров). Белки ионного канала имеют определенную конформацию, образующую трансмембранную пору, и «вшиты» в липидный слой мембраны. Канальный белковый комплекс может состоять либо из одной белковой молекулы, либо из нескольких белковых субъединиц, одинаковых или разных по строению (рис.4). Эти субъединицы могут кодироваться разными генами, синтезироваться на рибосомах по отдельности и затем собираться в виде целостного канала
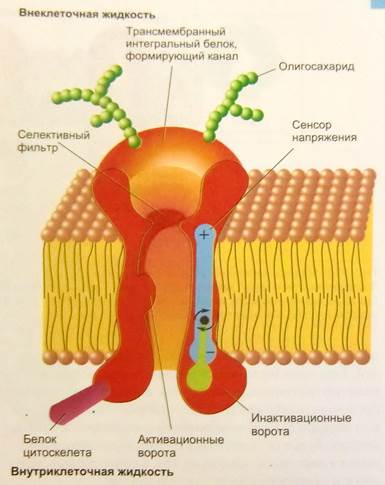
Рис.4 Гипотетическая модель ионного канала (рис. взят из кн.: Фундамент. и клинич. физиол.М.,2004. Под ред. А.Камкина и А.Каменского
. В другом случае канал может представлять собой единый полипептид, который в виде петель прошивает мембрану несколько раз. На начало ХХ1 века известно более 400 белков –каналоформеров, для биосинтеза которых используется 1-2% генов(рис.4, рис.5).
Домены – это отдельные компактно оформленные части канального белка или субъединиц. Сегменты – это части белка – каналоформера, свернутые спирально и прошивающие мембрану. Концевые домены белка - каналоформера (N- и C - -терминальные домены) могут торчать из мембраны как наружу, так и внутрь клетки.
Практически все ионные каналы имеют в составе своих субъединиц регуляторные домены, способные связываться с различными управляющими веществами (регуляторными молекулами) и за счет этого менять состояние или свойства канала. В потенциал-активируемых ионных каналах один из трансмембранных сегментов содержит специальный набор аминокислот с положительными зарядами и работает как сенсор электрического потенциала мембраны. При изменении потенциала такой сенсор меняет состояние канала с открытого на закрытое или наоборот. Таким образом, ионные каналы могут управляться определенными воздействиями из вне, это важное их свойство.
Ионные каналы в своем составе могут иметь также вспомогательные субъединицы, выполняющие модуляторные, структурные или стабилизирующие функции. Один класс таких субъединиц - внутриклеточные, расположены полностью в цитоплазме, а второй - мембранные, т.к. они имеют трансмембранные домены, прошивающие мембрану.
Свойства ионных каналов.
Селективность – это избирательная повышенная проницаемость ионного канала для определенных ионов. Для других ионов проницаемость понижена. Такая избирательность определяется селективным фильтром – самым узким местом канальной поры. Фильтр, кроме узких размеров, может иметь также локальный электрический заряд. Например, катион-селективные каналы обычно имеют в области своего селективного фильтра отрицательно заряженные остатки аминокислот в составе белковой молекулы, которые притягивают положительные ионы и отталкивают отрицательные ионы, не пропуская их через пору.
Управляемая проницаемость - это способность ионных каналов открываться или закрываться при определенных управляющих воздействиях на канал. По своему свойству ионные каналы можно классифицировать в зависимости от способов их открытия: например, потенциал-активируемые, лиганд-активируемые и т.д.
Инактивация - это способность ионного канала через некоторое время после своего открытия автоматически понижать свою проницаемость даже в том случае, когда открывший их активирующий фактор продолжает действовать. Быстрая инактивация – это особый процесс со своим особым механизмом, отличающийся от медленного закрытия канала. Закрытие канала происходит за счет механизмов, противоположных процессам, обеспечивающим его открытие, т. за счет изменения конформации канального белка. У потенциал-активируемых (потенциал-управляемых) каналов быстрая инактивация происходит с помощью специальной молекулярной «пробки-затычки», напоминающей пробку на цепочке, которую обычно используют в ваннах. Эта пробка представляет собой аминокислотную (полипептидную) петлю с утолщением на конце в виде трех аминокислот, которым и затыкается внутреннее устье канала со стороны цитоплазмы. Именно поэтому потенциал-зависимые ионные каналы для натрия, обеспечивающие развитие потенциала действия, могут пропускать в клетку ионы натрия только в течение нескольких миллисекунд, а затем они автоматически закрываются своими молекулярными пробками, несмотря на то, что открывающая их деполяризация продолжает действовать. Другим механизмом инактивации ионных каналов может служить модификация дополнительными субъединицами внутриклеточного устья канала.
Блокировка – это способность ионного канала под действием веществ-блокаторов фиксировать какое-то одно свое состояние и не реагировать на обычные управляющие воздействия. В таком состоянии канал просто перестает давать ответы на управляющие воздействия. Блокировку вызывают вещества-блокаторы, которые могут называться антогонистами, блокаторами или литиками. Антогонисты – это вещества, препятствующие активирующему действию других веществ на канал. Такие вещества способны хорошо связываться с рецепторным участком ионного канала, но не способны изменить состояние канала, вызвать его ответную реакцию. Блокада рецептора вызывает блокаду ионного канала. Антогонисты не обязательно вызывают полную блокаду рецептора и его ионного канала. Они могут действовать более слабо и лишь ингибировать (угнетать) работу канала, но не прекращать ее полностью. Агонисты-антогонисты – это вещества, которые обладают слабым стимулирующим влиянием на рецептор, но при этом блокируют действие естественных эндогенных управляющих веществ. Блокаторы – это вещества, препятствующие работе ионного канала, например, взаимодействию медиатора с молекулярным рецептором к нему и, следовательно, нарушающие управление каналом, блокирующие его. Литики – это те же блокаторы в отношении ионного канала, но этот термин более старый. Он используется как синоним для блокатора: холинолитик, адренолитик и т.д..
Пластичность – это способность ионного канала изменять свои свойства, свои характеристики. Наиболее распространенный механизм, обеспечивающий пластичность – это фосфорилирование аминокислот канальных белков с внутренней стороны мембраны ферментами – протеинкиназами. К канальным белкам присоединяются фосфорные остатки от АТФ или ГТФ – и канал меняет свои свойства. Например, фиксируется в постоянно закрытом состоянии или, наоборот, в открытом.

Рис.5 Потенциал-управляемый Na+-канал (рис. взят из кн.: Фундамент. и клинич. физиол.М.,2004. Под ред. А.Камкина и А.Каменского).
2.2.3.3. Типы каналов.
Быстрый натриевый канал. Японские исследователи Р.Нума и др. показали, что мембранный белок быстрого натриевого канала представляет собой гликопротеид с молекулярной массой 250-300кД, состоящей из нескольких субъединиц (α-субъединица, р-субъединица). Эти субъединицы образуют на внутренней поверхности гидрофильную трубчатую структуру. Диаметр этого канала колеблется в пределах 0,4 -0,6 нм. Через такую пору могут проходить ионы натрия, связанные с молекулами воды. Белки ионного натриевого канала выделены из различных отделов головного мозга, клеток нейробластов, аксонов кальмара и др. Изменения конформационного состояния структурных компонентов ионного канала тесно связано с процессами фосфорилирования «α» и «р»- пептидных субъединиц. Обнаружено, что натриевые каналы мозга млекопитающих содержат одну α-субъединицу, которая ассоциирована с двумя полипептидами p1 и p2. Установлено, что α- субъединица является трансмембранным белком, имеющим участки связывания для фосфорилирования цАМФ-зависимой протеинкиназой. Оказалась, что этого α- пептида вполне достаточно, чтобы оформить канал. Для выполнения функции канала необходимы p1 и p2 субъединицы, которые размещены в основном на внешней поверхности мембраны и ковалентно связаны с α- субъединицей через сульфидную связь. Эти субъединицы сильно гликолизированы. В состав p1 и p2 –пептидных субъединиц входит сиаловая кислота, которая придает ионному белковому комплексу сильный отрицательный заряд, который и позволяет полноценно функционировать каналу. Процесс открывания Na+- канала под влиянием изменения мембранного потенциала (активация натриевых каналов) один из наиболее ярких примеров конформационных перестроек белков под влиянием электрического поля. Открывание каждого канала совершается по принципу – «все или ничего». Этот процесс может быть остановлен инактивацией, которая также связана с переходом белков канала в другое конформационное состояние. Полный цикл активации и инактивации охватывает десятки тысяч натриевых каналов. Быстрый натриевый канал блокируется тетродотоксином.
Калиевые каналы. Потенциал-зависимые калиевые каналы так же, как и натриевые, распространены повсеместно в наружных мембранах нервных клеток и играют столь же важную роль в передаче скоростных сигналов. В отличие от ионов натрия, которые вызывают локальную деполяризацию мембраны и генерирование потенциала действия, проведение ионов по калиевым каналам приводит к гиперполяризации нейрона и появлению тормозных потенциалов. Система быстрых калиевых каналов играет большую роль в стабилизицации ритмической деятельности нейрона, которая и является способом кодирования и передачи клеткой химических сигналов. Характерной чертой участия калиевых каналов в ритмической активности является резкое замедление нарастания деполяризации мембраны, вызванной предшествующим входом ионов Na+.. Калиевые каналы являются более избирательными для ионов. Они не пропускают практически ионы натрия. Полагают, что селективный фильтр калиевого канала имеет размеры порядка 0,26-0,3 нм. Ионы большего размера не проходят через канал по стерическим причинам, ионы меньшего размера в связи с тем, что они не могут успешно взаимодействовать с кислородосодержащими анионами, которые находятся в боковых цепях гидрофильных аминокислот, которые выстилают внутреннюю белковую пору. Калиевые каналы подразделяются на три подтипа в зависимости от скорости проведения ионов: быстрые, средние и медленные. Первые два подтипа каналов являются зависимыми от ионов Са2+ и блокируются токсином скорпиона. Третий вид калиевого канала блокируется одним из токсинов яда кобры и пчелы – апамином. Структура калиевых каналов в принципе сходна с структурой натриевого быстрого канала. Молекулярные массы для целого олигомерного комплекса от 165 до 400 Кд в зависимости от типа клетки. Обнаружено, что у разных организмов сочетания полипептидных компонентов, составляющих макромолекулу ионофора, существенно различаются. В отличие от белков других каналов белки калиевых каналов практически не гликолизированы.
Кальциевые каналы. Транспорт ионов кальция через кальциевые каналы жизненно важен для разнообразных клеточных функций в нервной ткани, кардиомиоцитах, клеток гладких мышц и др. Специфичность кальциевого канала не очень высокая. Они способны пропускать из внешней среды ионы натрия и ионы других щелочных металлов, если концентрация ионов кальция в наружной среде находится ниже микромолекулярного уровня. Кальциевые каналы пропускают также ионы других двухвалентных металлов, например, магния, марганца. Однако, эти катионы легко связываются внешней химической группировкой канала и становятся при определенных концентрациях эффективными блокаторами кальциевого канала. Полагают, что эта группировка является карбоксильной группой, которая находится в устье канала. Общая схема молекулярной организации кальциевых каналов сходна с организацией натриевых каналов. Различие заключается в том, что главная α-субъединица окружена большим числом субъединиц, которые являются модуляторами активности канала. Известно, что транспорт кальция по каналу существенно зависит от внутриклеточной концентрации кальция и функционирования системы циклических нуклеотидов.
2.2.4.Мембранный потенциал покоя (потенциал покоя). По современным представлениям, согласно мембранно-ионной теории, все электрические потенциалы являются диффузионными потенциалами. Диффузия ионов определяется селективными свойствами мембраны, ее каналами. Отсюда, знак потенциала, амплитуда, скорость нарастания фазы деполяризации, длительность потенциала, будет зависеть от скорости диффузии иона, его знака и направленностью его диффузии (в клетку или из клетки).
Гипотеза о роли клеточных мембран в генезе биоэлектрических потенциалов впервые была высказана Оствальдом (1890). Затем его идея была развита Бернштейном. Согласно гипотезе Бернштейна(1902,1912) мембрана нервных и мышечных волокон в покое избирательно проницаема только для ионов калия, концентрация которых в протоплазме значительно превосходит их концентрацию во внешней среде (соответственно 140 мЭкв/л и 4 мЭкв/л). Поэтому потенциал покоя может рассматриваться как калиевый диффузионный потенциал, согласно уравнению Нернста:
V=RT/FZ ln Co/Ci,
Где V равновесный потенциал в вольтах, R - газовая постоянная (2кал/М/K), Т - абсолютная температура, F – постоянная Фарадея (2,3х10в 4 степени/B/M ), Z - валентность иона, ln - натуральный логарифм, Со и С i – концентрации положительно заряженных ионов снаружи и внутри клетки.
В дальнейшем, используя теорию постоянного поля Гольдмана, Ходжкин, Катц и др. вывели уравнение мембранного потенциала с учетом диффузии ионов калия, ионов натрия и ионов хлора.
E =RT/F lnPK [K+]o + PNa[Na+]o + PCl[Cl-]i/PK [K+]i +PNa[Na+]i +PCl[Cl-]i
Штейнбах, Шпигельман (1943), Ходжкин, Катц(1949) нашли, что у покоящегося гигантского нервного волокна кальмара, находящегося в растворе искусственной морской воды, существуют следующие отношения констант проницаемости:
PK: PNa: PCl =1:0,04:0,45
Данные соотношения сохранялись при уменьшении или увеличении концентрации ионов калия во внешней среде в диапазоне от 1 до 15 мМ. При увеличении концентрации от 15мМ до 150мМ всегда развивалась сильная деполяризация мембраны. Данный факт показал, что соотношения между проницаемостью ионов калия, проницаемостью ионов натрия и проницаемостью ионов хлора находятся в определенной зависимости от уровня мембранного потенциала, который в свою очередь зависит от концентрации этих ионов в среде.










