Газовые законы
Рассматривать изменение переменной от двух других не очень удобно. У нас есть подходящий математический инструмент для описания одной переменной от другой – функция. В рассмотренных в начале урока примерах мы фиксировали один из трех параметров газа (например, температуру) и рассматривали зависимость двух других. Подробно рассмотрим все три случая.
Начнем с фиксированной температуры и рассмотрим связь давления и объема в этом случае. Процессы, в которых мы считаем неизменным один из параметров состояния газа, назвали изопроцессами, от древнегреческого ἴσος, что означает «одинаковый, равный». А процесс, в котором сохраняется температура (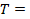 const), называется изотермическим (несложно запомнить: термос – то, что сохраняет температуру).
const), называется изотермическим (несложно запомнить: термос – то, что сохраняет температуру).
Умножим обе части уравнения Клапейрона на температуру:
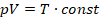
Если умножить постоянную температуру на константу, то получим тоже константу, только другую:
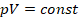
Нам даже не нужно знать ее значение, главное, что произведение p на V каким было в начале процесса, таким и осталось в конце:

Из уравнения видно: при уменьшении объема (сжатии) при постоянной температуре увеличивается давление, и наоборот (на математике мы говорили, что такая зависимость называется обратной пропорциональностью).
Мы получили это уравнение, воспользовавшись математической моделью, но еще в XVII веке эту закономерность экспериментально выявили англичанин Бойль и француз Мариотт, поэтому ее назвали в их честь законом Бойля – Мариотта:
Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
Для этого процесса модель точнее описывает реальный процесс: в закрытом жестком сосуде объем действительно можно считать постоянным с хорошей точностью. Пример – металлический баллон. Если газ в нем нагреть, давление увеличится, но при большой жесткости баллона он практически не деформируется (по крайне мере настолько, чтобы внести заметную погрешность в расчеты).
О формулировках
В физике используют формулировки «газ выполнил работу» или «над газом выполнили работу». Это сокращение, которое не нужно понимать буквально. Работу выполняет сила, по определению: 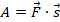 . Какая сила выполняет работу при перемещении поршня?
. Какая сила выполняет работу при перемещении поршня?
На поршень действует сила давления 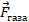 . По третьему закону Ньютона, можно выделить такую же по модулю и противоположную по направлению силу, которая действует условно на газ,
. По третьему закону Ньютона, можно выделить такую же по модулю и противоположную по направлению силу, которая действует условно на газ, 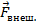 . Почему условно? Потому что если газ считать совокупностью атомов, то нет точки приложения для этой силы, есть много единичных столкновений с атомами. Но так можно сказать о любом теле, состоящем из атомов, а силы мы все же в разных моделях выделяем. Эта сила равна сумме внешних сил, действующих на поршень: силы тяжести, силы, создаваемой атмосферным давлением.
. Почему условно? Потому что если газ считать совокупностью атомов, то нет точки приложения для этой силы, есть много единичных столкновений с атомами. Но так можно сказать о любом теле, состоящем из атомов, а силы мы все же в разных моделях выделяем. Эта сила равна сумме внешних сил, действующих на поршень: силы тяжести, силы, создаваемой атмосферным давлением.
Так вот, пусть газ расширяется. Работа силы 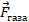 равна
равна 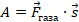 , она положительна. Эту работу мы и называем работой, которую совершает газ, чтобы не называть ее «работа силы действия на поршень, создаваемой давлением газа». А работа внешних сил равна
, она положительна. Эту работу мы и называем работой, которую совершает газ, чтобы не называть ее «работа силы действия на поршень, создаваемой давлением газа». А работа внешних сил равна 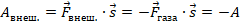 . Эту работу мы называем работой, которая совершается над газом. Они равны по модулю и противоположны по знаку,
. Эту работу мы называем работой, которая совершается над газом. Они равны по модулю и противоположны по знаку, 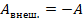 .
.
Проще всего с изохорным процессом. Объем газа не изменяется, перемещения нет, значит, работа равна нулю, 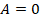 .
.
Вычислим работу газа при изобарном процессе. Пусть газ находится в цилиндре под поршнем. Давление на поршень, по определению, равно силе, деленной на площадь. Распишем силу через давление:
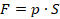
Перемещение поршня обозначим 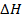 , чтобы не путать с площадью
, чтобы не путать с площадью 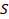 . Положительным считаем
. Положительным считаем 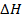 , когда газ расширяется, тогда сила и перемещение сонаправлены. Запишем работу:
, когда газ расширяется, тогда сила и перемещение сонаправлены. Запишем работу:
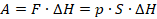
А изменение высоты 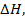 умноженное на площадь
умноженное на площадь 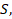 – это изменение объема газа, тогда:
– это изменение объема газа, тогда:
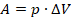
Соответственно, если газ будет изобарно сжиматься, то 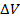 (а это
(а это 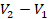 ) будет отрицательным, или если мы записываем модуль
) будет отрицательным, или если мы записываем модуль 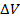 , то поставим знак минус. В любом случае получим отрицательную работу (см. рис. 5).
, то поставим знак минус. В любом случае получим отрицательную работу (см. рис. 5).
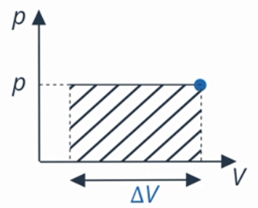
Рис. 5. График зависимости 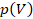 при изобарном процессе
при изобарном процессе
Значение давления 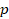 постоянно. Видно, что
постоянно. Видно, что 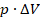 – это площадь прямоугольника. Это удобно: мы можем оценить работу, совершаемую газом, по площади фигуры под графиком процесса в координатах
– это площадь прямоугольника. Это удобно: мы можем оценить работу, совершаемую газом, по площади фигуры под графиком процесса в координатах 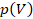 . А знак этой работы определяется направлением процесса: увеличивается объем (тогда точка движется по графику вправо) или уменьшается (тогда влево).
. А знак этой работы определяется направлением процесса: увеличивается объем (тогда точка движется по графику вправо) или уменьшается (тогда влево).
Рассмотрим работу газа при изотермическом процессе. Здесь изменяется и давление, и объем, такая задача решается немного сложнее. Оценим работу газа по графику. График изотермы – это гипербола 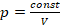 , и работа газа равна площади фигуры под графиком (см. рис. 6).
, и работа газа равна площади фигуры под графиком (см. рис. 6).
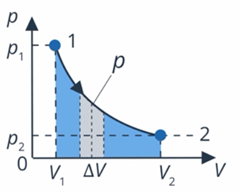
Рис. 6. График зависимости 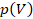 при изотермическом процессе
при изотермическом процессе
Следующее ответвление, в котором мы получим уравнение для работы газа при изотермическом процессе, обязательно к ознакомлению для учеников профильного уровня, для всех остальных – по желанию.
Первый закон термодинамики
Итак, мы научились вычислять внутреннюю энергию 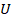 , рассчитали работу газа
, рассчитали работу газа 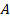 при разных процессах. А может еще передаваться теплота Q. Чтобы разобраться в этих переходах, осталось эти величины связать: как одно превращается в другое.
при разных процессах. А может еще передаваться теплота Q. Чтобы разобраться в этих переходах, осталось эти величины связать: как одно превращается в другое.
Как изменяются и превращаются друг в друга разные виды энергии, описывает закон сохранения энергии, это для нас не новость. Мы формулировали его для механических процессов как закон сохранения полной механической энергии. В ядерной физике мы рассматривали переход массы в энергию. Это все разные формы общего принципа, который можно упрощенно сформулировать так: энергия не возникает из ниоткуда и не исчезает бесследно. Запишем закон сохранения энергии для тепловых процессов.
Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно количеству теплоты, подведенному к системе извне, плюс работе внешних сил, действующих на нее:
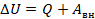
Другими словами, внутренняя энергия газа изменяется на количество теплоты, переданное газу, и на величину работы, совершенной над газом. В таком виде закон сохранения энергии назвали первым законом термодинамики (их мы рассмотрим два) – уравнение простое, но оно позволяет описать множество процессов, связанных с тепловыми явлениями.
Перепишем уравнение в другом виде. Мы чуть раньше в ответвлении разобрались с тем, что работа внешних сил над газом равна работе, совершенной над газом, которая взята со знаком минус:
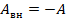
Тогда:
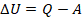
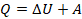
Читаем уравнение: количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение ею работы. В ответвлении применим нашу модель для решения задачи.
Задача 1
Задача 1. Определите количество теплоты, полученное одноатомным газом в ходе процесса, график которого изображен на рисунке 8.
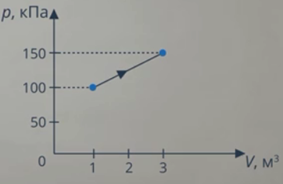
Рис. 8. Условие задачи
Анализ условия. В задаче описан процесс, в ходе которого газ получает теплоту, выполняет работу (так как на графике видно, что объем изменяется). И наверняка изменяется внутренняя энергия: на графике температура не видна, но процесс явно не изотермический. Такие превращения энергии мы описываем с помощью первого закона термодинамики. Работу газа мы умеем вычислять как площадь фигуры под графиком (см. рис. 9).
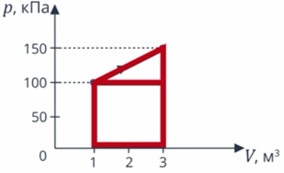
Рис. 9. Работа газа на графике
Уравнение для внутренней энергии одноатомного газа мы тоже знаем. Перейдем к физической части решения, запишем в виде уравнений то, что обсудили.
По первому закону термодинамики, количество теплоты, переданное газу, идет на изменение его внутренней энергии и совершение им работы:
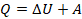
Вычислим работу газа как площадь фигуры под графиком. Можем выделить прямоугольник и треугольник, можем рассматривать полностью трапецию – как удобно. Рассмотрим трапецию: ее основания равны 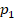 и
и 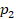 , а высота равна
, а высота равна 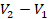 . Из уроков геометрии помним, что площадь трапеции равна (см. рис. 10):
. Из уроков геометрии помним, что площадь трапеции равна (см. рис. 10):
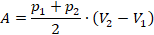
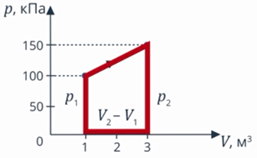
Рис. 10. Площадь трапеции
Внутренняя энергия одноатомного идеального газа определяется температурой:
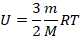
У нас нет температуры, можем переписать, применим уравнение Менделеева – Клапейрона:
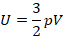
Тогда при переходе из состояния 1 в состояние 2 изменение внутренней энергии равно:
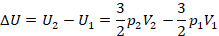
Математическая часть решения задачи осталась простая: подставляем 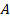 и
и 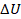 в первое уравнение и находим количество теплоты. Значения давлений и объемов находим на графике и переводим в СИ:
в первое уравнение и находим количество теплоты. Значения давлений и объемов находим на графике и переводим в СИ: 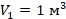 ,
, 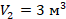 ,
, 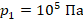 ,
, 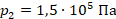 .
.
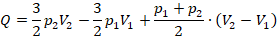
Вычислим:
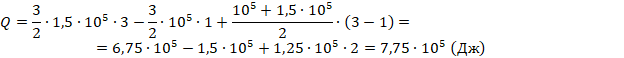
Получили ответ 775 кДж, задача решена.
Применим первый закон термодинамики к изопроцессам. При изобарном процессе давление постоянно, а температура и объем изменяются. Пусть газ нагревается и расширяется. Нагревается – значит, увеличивается внутренняя энергия. Расширяется – значит, выполняет работу. И 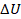 , и работу при изобарном процессе мы вычислять умеем, поэтому по формуле:
, и работу при изобарном процессе мы вычислять умеем, поэтому по формуле: 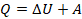 сможем рассчитать количество теплоты.
сможем рассчитать количество теплоты.
При изохорном процессе не выполняется работа, 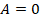 , потому что объем не меняется. Поэтому первый закон термодинамики примет вид:
, потому что объем не меняется. Поэтому первый закон термодинамики примет вид: 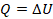 , то есть вся переданная газу теплота идет на изменение внутренней энергии.
, то есть вся переданная газу теплота идет на изменение внутренней энергии.
При изотермическом процессе не изменяется температура, а значит, не изменяется внутренняя энергия, 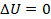 . Тогда уравнение примет вид:
. Тогда уравнение примет вид: 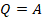 . Вся переданная газу теплота идет на выполнение газом работы.
. Вся переданная газу теплота идет на выполнение газом работы.
В следующем ответвлении мы рассмотрим еще один процесс, адиабатный, оно обязательно к ознакомлению для учеников профильного уровня, для всех остальных – по желанию.
Адиабатный процесс
Выделим еще одну модель, с помощью которой можно описать реальные процессы. Представим себе процесс, при котором газ не обменивается теплотой с окружающими телами, 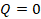 . Может такое быть? Например, когда процесс происходит быстро и вкладом теплообмена можно пренебречь,
. Может такое быть? Например, когда процесс происходит быстро и вкладом теплообмена можно пренебречь, 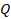 считаем почти равным нулю. Такой процесс назвали адиабатным. Тогда:
считаем почти равным нулю. Такой процесс назвали адиабатным. Тогда:
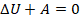
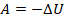
Это значит, что уменьшение внутренней энергии тела равно работе, выполненной этим телом. При этом изменяются все три макропараметра газа: уменьшается температура, увеличивается объем и уменьшается давление. В координатах 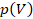 график адиабаты идет круче, чем график изотермы: так как тепло извне не подводится и не отводится, температура падает и, соответственно, растет быстрее (см. рис. 11).
график адиабаты идет круче, чем график изотермы: так как тепло извне не подводится и не отводится, температура падает и, соответственно, растет быстрее (см. рис. 11).
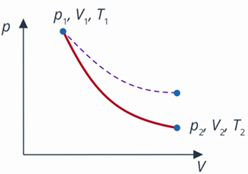
Рис. 11. График зависимости 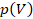 при адиабатном процессе
при адиабатном процессе
Когда мы открываем бутылку с газированным напитком, в которой воздух был под давлением, воздух быстро расширяется, выполняется работа (может даже отскочить крышка), за счет того что уменьшается внутренняя энергия газа – закон сохранения энергии выполняется. И газ охлаждается: мы видим даже конденсацию пара из-за этого охлаждения. И наоборот, если быстро сжать газ, то есть выполнить над ним работу, его внутренняя энергия (а значит, и температура) увеличится. Так при резком сжатии под поршнем воспламеняется топливо в дизельных двигателях (а не от искры, как в бензиновых).
Второй закон термодинамики
С количественными характеристиками тепловых процессов разобрались, ответили на вопрос «сколько?». Конечно, эта модель, как и любая другая, имеет ограничения, идеализация не совпадает с реальностью.
Обратим внимание вот на что. Под поршнем есть некоторое количество газа комнатной температуры. Представим, что он расширился, то есть выполнил работу 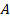 , и нагрел окружающий воздух в комнате (то есть полученное им количество теплоты отрицательно,
, и нагрел окружающий воздух в комнате (то есть полученное им количество теплоты отрицательно, 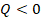 ). При этом он должен охладиться. Из уравнения
). При этом он должен охладиться. Из уравнения 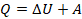 изменение внутренней энергии равно
изменение внутренней энергии равно 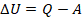 .
. 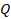 отрицательное, еще и минус
отрицательное, еще и минус 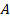 ,
, 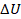 получается отрицательным. В уравнении все сходится, внутренняя энергия уменьшилась, а разность выделилась в виде теплоты и пошла на выполнение газом работы. Но опыт нам подсказывает, что такой процесс самопроизвольно не протекает. Да, вещества обладают внутренней энергией, но не всегда мы ею можем управлять. Мы не можем забрать часть энергии у холодной батареи, чтобы она стала еще холоднее, а руки нагрелись. Воздух, который вырвался из воздушного шарика, самопроизвольно в нем не соберется. Так что помимо количественных характеристик тепловых процессов важно еще направление этих процессов.
получается отрицательным. В уравнении все сходится, внутренняя энергия уменьшилась, а разность выделилась в виде теплоты и пошла на выполнение газом работы. Но опыт нам подсказывает, что такой процесс самопроизвольно не протекает. Да, вещества обладают внутренней энергией, но не всегда мы ею можем управлять. Мы не можем забрать часть энергии у холодной батареи, чтобы она стала еще холоднее, а руки нагрелись. Воздух, который вырвался из воздушного шарика, самопроизвольно в нем не соберется. Так что помимо количественных характеристик тепловых процессов важно еще направление этих процессов.
Опыт подсказывает нам, что теплота самопроизвольно не передается от холодных тел к теплым, но это можно сделать с помощью холодильника. Строго это утверждение сформулировано в виде второго закона термодинамики, он отображает необратимость процессов в природе – они самопроизвольно протекают только в одном направлении. Этот закон имеет множество формулировок, приведем несколько.
Невозможен процесс перехода теплоты от тела с более низкой температурой к телу с более высокой.
Невозможен процесс, результатом которого было бы совершение работы за счет теплоты, взятой от одного какого-то тела. Еще другими словами – невозможно существование вечного двигателя второго рода (вечный двигатель первого рода предполагает создание энергии из ничего, а второго рода – полное превращение тепловой энергии в механическую).
Эти и другие формулировки следуют одни из другой и описывают одно и то же с разных сторон. Еще несколько формулировок второго закона термодинамики мы приведем в следующем ответвлении, которое обязательно к ознакомлению для учеников профильного уровня, для всех остальных – по желанию.
Второй закон термодинамики
Мы применили второй закон термодинамики к тепловым процессам. Но мы же знаем, что для описания тепловых явлений можно использовать модель механики для большого количества частиц. Поэтому можно распространить второй закон термодинамики и на механические явления.
Для систем с большим количеством элементов, к которым можно применить инструменты статистики, ввели понятие энтропии. Если упрощенно, то это величина, характеризующая неупорядоченность, хаотичность. Например, если весь воздух из комнаты был бы сосредоточен в одном открытом сосуде, энтропия такой системы была бы низкой. Если в одной части комнаты собран весь азот, в другой кислород, а внутри флакона молекулы духОв – энтропия тоже низкая. Но если воздух распределен равномерно и смешан, энтропия такой системы выше.
Так вот, есть такая формулировка второго закона термодинамики: в замкнутых системах (без поступления энергии извне) энтропия не может уменьшаться. То есть неупорядоченность только увеличивается: хаотично движущиеся молекулы не могут сами прийти в порядок, распределившаяся теплота не может передаться назад к источнику, разбитая ваза не может собраться из осколков, разбежавшееся стадо без команды или дрессировки не соберется в стойле и так далее.
Тепловой двигатель
Второй закон термодинамики ограничивает нас в использовании энергии, и возникает задача. Есть энергия, которая содержится в любом веществе – внутренняя энергия. И было бы замечательно научиться как-то ее использовать, превращать в механическую, электрическую и т. д. – в какую нужно. Но как это сделать, если самопроизвольное превращение внутренней энергии в работу невозможно?
Мы эту задачу уже решили и придумали, на каком принципе должен работать тепловой двигатель (см. рис. 12). Вкратце напомним, о чем мы договорились. Чтобы газ выполнял работу, его нужно нагревать, а затем охлаждать, чтобы привести в исходное состояние.
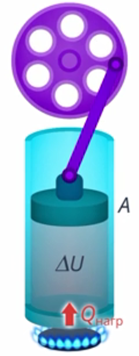

Рис. 12. Принцип работы теплового двигателя за цикл
В итоге тепловой двигатель работает в замкнутом цикле, и он, помимо рабочего тела, должен содержать нагреватель и холодильник. Тогда на разных этапах работы двигателя второй закон термодинамики выполняется: теплота переходит от нагревателя к рабочему телу и от рабочего тела к холодильнику. Превращения энергии мы описывали уравнением:
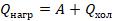
Часть теплоты 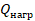 , полученной от нагревателя, идет на выполнение работы
, полученной от нагревателя, идет на выполнение работы 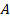 , а остальная (
, а остальная (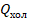 ) передается холодильнику. КПД теплового двигателя мы вычисляем по стандартной формуле: полезная работа, деленная на затраченную энергию, и для теплового двигателя эта формула принимает вид:
) передается холодильнику. КПД теплового двигателя мы вычисляем по стандартной формуле: полезная работа, деленная на затраченную энергию, и для теплового двигателя эта формула принимает вид:
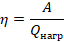
Работу выразим из предыдущего уравнения:
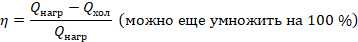
Можем сформулировать второй закон термодинамики еще одним способом. КПД теплового двигателя не может быть равен 100 %. Конечно, у любого механизма есть потери. Но здесь речь о том, что даже идеальный тепловой двигатель должен отдавать теплоту холодильнику, чтобы тот охлаждал рабочее тело, а значит, числитель всегда будет меньше знаменателя и КПД будет меньше 1. Так мы пришли к предыдущим формулировкам второго закона термодинамики.
Следующее ответвление, в котором мы рассмотрим модель теплового двигателя с максимально возможным КПД, обязательно к ознакомлению для учеников профильного уровня, для всех остальных – по желанию.
Цикл Карно
Попробуем построить по возможности наиболее эффективную тепловую машину. Что для этого нужно? Тепловая энергия должна максимально полно превращаться в механическую, без лишних потерь.
Теплота, подводимая к рабочему телу нагревателем, должна полностью идти на выполнение им работы, 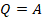 ,
,  . Такое условие выполняется при изотермическом расширении, это будет первый этап, отметим его на графике (см. рис. 13).
. Такое условие выполняется при изотермическом расширении, это будет первый этап, отметим его на графике (см. рис. 13). 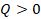 ,
, 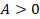 .
.
Сделаем вторым этапом адиабатическое расширение: прекратим подвод теплоты 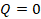 , и уже работа будет совершаться за счет охлаждения газа,
, и уже работа будет совершаться за счет охлаждения газа, 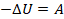 . Здесь
. Здесь 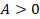 ,
, 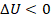 .
.
Теперь начнем возвращать машину в исходное состояние. На этапе 3 сожмем газ, совершив над ним работу, одновременно отводя тепло при помощи холодильника. Отводим все тепло, которое возникает из-за сжатия – так, чтобы внутренняя энергия газа не менялась. То есть процесс идет при постоянной температуре, по изотерме. 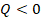 ,
, 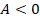 ,
, 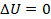 .
.
И наконец, на этапе 4 сожмем газ, совершив над ним работу, не отводя и не подводя тепло, то есть процесс адиабатический. 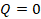 ,
, 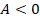 ,
, 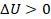 . Таким образом, получили цикл из двух изотерм и двух адиабат.
. Таким образом, получили цикл из двух изотерм и двух адиабат.
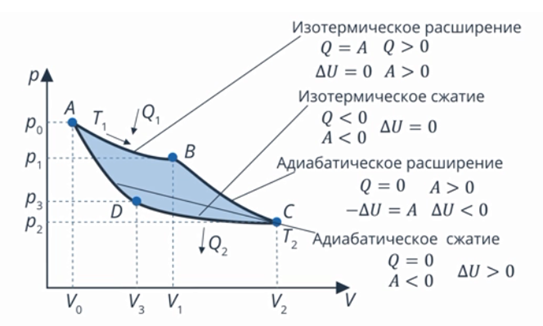
Рис. 13. Цикл Карно
Построенная тепловая машина была предложена французским инженером Сади Карно, и описанный цикл носит его имя. КПД этой машины максимально возможный для тепловой машины, работающей при данных температурах нагревателя и холодильника 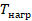 и
и 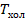 . Ее КПД равен:
. Ее КПД равен:
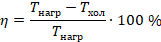
Реализовать такую машину в точности нельзя. Например, в реальности нельзя сжимать газ и отводить тепло так, чтобы газ все время оставался при одной температуре. Теоретически, если тепло передается между телами при равных температурах, оно может передаваться в обоих направлениях (нет более теплого и более холодного). Для такой модели придумали название квазиобратимый процесс: его не существует, но если бы он существовал, то мог бы быть обратимым. А в реальности могут протекать процессы, только с некоторой степенью точности похожие на описанные идеальные: температура почти не меняется или меняется очень медленно, теплообмен почти не происходит, почти все тепло переходит в работу.
Зачем нам эта модель? Чтобы оценить максимальный КПД, который теоретически возможен при данных температурах. Например, мы получили для двигателя на цикле Карно значение КПД 30 %. Это значит, что какой бы мы ни сделали двигатель с данными рабочими температурами, его КПД даже теоретически не может достичь и тем более превысить 30 %. На практике он будет меньше.
Связь трех параметров состояния идеального газа. Уравнение Менделеева – Клапейрона
Состояние газа однозначно задается тремя макроскопическими параметрами: давлением, объемом и температурой. Мы знаем, что горячий воздух поднимается вверх. С увеличением температуры он становится легче – уменьшается плотность, увеличивается расстояние между молекулами. То есть происходит расширение – увеличение объема. Можно сделать вывод, что объем и температура газа связаны. Если сдавить воздушный шарик, то внутри него увеличится давление. То есть объем газа также связан с давлением. Получается, что давление, объем и температура газа связаны между собой. Попробуем понять, как именно.
Мы работаем с моделью идеального газа, которая описывает реальный газ достаточно точно для решения многих задач. Мы уже получили для идеального газа основное уравнение МКТ, с помощью которого связали давление с микропараметрами – массой и средней скоростью одной молекулы:
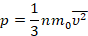
Это уравнение – решение задачи в модели механики. Мы приняли, что газ состоит из хаотично движущихся молекул – и вычислили, как они действуют на стенку, какое давление создают, когда с ней сталкиваются. Но мы не измеряем скорости и массы отдельных молекул. На макроуровне мы умеем измерять температуру, которую мы связали со средней кинетической энергией молекул, а значит, и с микропараметрами: массой и средней скоростью одной молекулы:
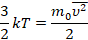
Подставив кинетическую энергию из одного уравнения в другое, получили:
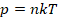
В таком виде применять уравнение для решения задач все еще не удобно. Для измерения давления газа существуют различные приборы (манометры, барометры), для измерения температуры – термометры. Но мы не можем напрямую измерять концентрацию – количество частиц в единице объема. Преобразуем уравнение до удобного вида. Концентрация – это, по определению,  :
:

А количество молекул удобнее представить через количество вещества. Мы помним, что в одном моле вещества 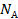 молекул. Значит,
молекул. Значит, 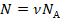 :
:
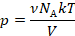
Договоримся: чтобы каждый раз не перемножать постоянные величины 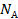 на
на 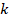 , сделаем это один раз, а произведение обозначим
, сделаем это один раз, а произведение обозначим 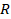 :
:
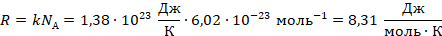
Это значение назвали универсальной газовой постоянной, почему – станет понятно чуть позже. Умножим обе части уравнения на объем и перепишем:
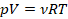
Получили уравнение, которое связывает три макропараметра идеального газа, которые легко измерить: объем, температуру и давление. И если взять какое-то определенное количество газа 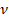 , эти три параметра однозначно зададут его состояние, неизвестных в уравнении не останется. Поэтому это уравнение назвали уравнением состояния идеального газа, или иначе уравнением Менделеева – Клапейрона. А на случай, если нам неудобно пользоваться количеством вещества в молях, можно его выразить через массу вещества:
, эти три параметра однозначно зададут его состояние, неизвестных в уравнении не останется. Поэтому это уравнение назвали уравнением состояния идеального газа, или иначе уравнением Менделеева – Клапейрона. А на случай, если нам неудобно пользоваться количеством вещества в молях, можно его выразить через массу вещества:
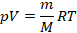
Именно в этом виде его чаще всего и записывают. Мы начали с движения молекул, придумали инструменты для его описания, а в итоге получили уравнение, которое связывает поддающиеся непосредственному измерению макропараметры.
Решим задачу.
Задача 1. Какое давление должен выдерживать газовый баллон объемом 50 л, чтобы при температуре 25 ˚Св нем можно было хранить 2 кг метана ( )?
)?
Анализ условия. В задаче сказано о метане – это газ, в баллоне не создается экстремальных условий, температура комнатная, так что будем описывать его с помощью модели идеального газа. Речь идет о связи трех макропараметров газа, поэтому будем применять уравнение состояния идеального газа.
Физическая часть решения. В условии задана масса газа, поэтому запишем уравнение состояния идеального газа в том виде, в котором есть масса:
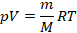
Все величины известны, осталось только найти молярную массу метана (ее можно найти, зная состав его молекулы, см. рис. 1), перевести значения величин в СИ и получить ответ. На выборе уравнения физика закончилась, осталось решить простое уравнение. Выразим давление:
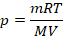

Рис. 1. Углерод и водород в таблице Менделеева
Молекула метана состоит из одного атома углерода с относительной атомной массой 12 (смотрим в таблице Менделеева) и четырех атомов водорода с относительной атомной массой 1. Тогда:
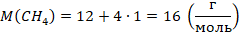
Будем использовать в СИ:
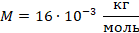
1 л – это 1  или в СИ
или в СИ 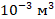 . Значит, объем баллона в СИ будет равен
. Значит, объем баллона в СИ будет равен  .
.
Температуру выразим в кельвинах:
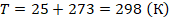
Вычислим давление:
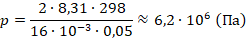
Получили ответ: давление около 6,2 МПа, что в 62 раза больше атмосферного. Задача решена.
Во многих задачах берется некоторое фиксированное количество газа и рассматривается изменение его состояния. Это значит, что в рамках таких задач количество вещества постоянно (как и масса, смотря в чем выразим). Можно все постоянные перенести в одну часть уравнения, а три изменяющихся параметра состояния – в другую:
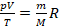 или
или 
Если взять 1 моль любого газа (одноатомного аргона, углекислого газа, водяного пара – лишь бы к нему была применима модель идеального газа), выражение 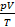 будет равно постоянной
будет равно постоянной 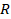 . Поэтому эта постоянная и названа универсальной. Но даже если мы возьмем произвольную, но – что важно – фиксированную массу газа, выражение
. Поэтому эта постоянная и названа универсальной. Но даже если мы возьмем произвольную, но – что важно – фиксированную массу газа, выражение 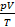 для этой массы газа будет постоянным:
для этой массы газа будет постоянным:
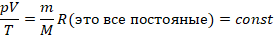
Или, по-другому, если газ переходит из одного состояния с параметрами 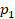 ,
, 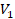 ,
, 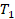 в состояние с параметрами
в состояние с параметрами 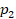 ,
,  ,
, 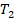 , то можем записать:
, то можем записать:
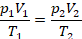
В таком виде или в виде  это уравнение называют уравнением Клапейрона, хотя это то же уравнение состояния, записанное немного иначе.
это уравнение называют уравнением Клапейрона, хотя это то же уравнение состояния, записанное немного иначе.
Газовые законы
Рассматривать изменение переменной от двух других не очень удобно. У нас есть подходящий математический инструмент для описания одной переменной от другой – функция. В рассмотренных в начале урока примерах мы фиксировали один из трех параметров газа (например, температуру) и рассматривали зависимость двух других. Подробно рассмотрим все три случая.
Начнем с фиксированной температуры и рассмотрим связь давления и объема в этом случае. Процессы, в которых мы считаем неизменным один из параметров состояния газа, назвали изопроцессами, от древнегреческого ἴσος, что означает «одинаковый, равный». А процесс, в котором сохраняется температура (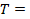 const), называется изотермическим (несложно запомнить: термос – то, что сохраняет температуру).
const), называется изотермическим (несложно запомнить: термос – то, что сохраняет температуру).
Умножим обе части уравнения Клапейрона на температуру:
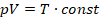
Если умножить постоянную температуру на константу, то получим тоже константу, только другую:
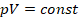
Нам даже не нужно знать ее значение, главное, что произведение p на V каким было в начале процесса, таким и осталось в конце:

Из уравнения видно: при уменьшении объема (сжатии) при постоянной температуре увеличивается давление, и наоборот (на математике мы говорили, что такая зависимость называется обратной пропорциональностью).
Мы получили это уравнение, воспользовавшись математической моделью, но еще в XVII веке эту закономерность экспериментально выявили англичанин Бойль и француз Мариотт, поэтому ее назвали в их честь законом Бойля – Мариотта:



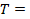 const), называется изотермическим (несложно запомнить: термос – то, что сохраняет температуру).
const), называется изотермическим (несложно запомнить: термос – то, что сохраняет температуру).
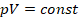

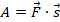 . Какая сила выполняет работу при перемещении поршня?
. Какая сила выполняет работу при перемещении поршня?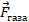 . По третьему закону Ньютона, можно выделить такую же по модулю и противоположную по направлению силу, которая действует условно на газ,
. По третьему закону Ньютона, можно выделить такую же по модулю и противоположную по направлению силу, которая действует условно на газ, 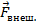 . Почему условно? Потому что если газ считать совокупностью атомов, то нет точки приложения для этой силы, есть много единичных столкновений с атомами. Но так можно сказать о любом теле, состоящем из атомов, а силы мы все же в разных моделях выделяем. Эта сила равна сумме внешних сил, действующих на поршень: силы тяжести, силы, создаваемой атмосферным давлением.
. Почему условно? Потому что если газ считать совокупностью атомов, то нет точки приложения для этой силы, есть много единичных столкновений с атомами. Но так можно сказать о любом теле, состоящем из атомов, а силы мы все же в разных моделях выделяем. Эта сила равна сумме внешних сил, действующих на поршень: силы тяжести, силы, создаваемой атмосферным давлением.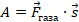 , она положительна. Эту работу мы и называем работой, которую совершает газ, чтобы не называть ее «работа силы действия на поршень, создаваемой давлением газа». А работа внешних сил равна
, она положительна. Эту работу мы и называем работой, которую совершает газ, чтобы не называть ее «работа силы действия на поршень, создаваемой давлением газа». А работа внешних сил равна 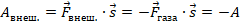 . Эту работу мы называем работой, которая совершается над газом. Они равны по модулю и противоположны по знаку,
. Эту работу мы называем работой, которая совершается над газом. Они равны по модулю и противоположны по знаку, 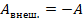 .
.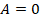 .
.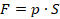
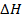 , чтобы не путать с площадью
, чтобы не путать с площадью 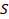 . Положительным считаем
. Положительным считаем 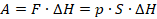
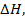 умноженное на площадь
умноженное на площадь 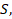 – это изменение объема газа, тогда:
– это изменение объема газа, тогда: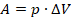
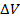 (а это
(а это 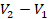 ) будет отрицательным, или если мы записываем модуль
) будет отрицательным, или если мы записываем модуль 
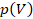 при изобарном процессе
при изобарном процессе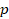 постоянно. Видно, что
постоянно. Видно, что 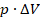 – это площадь прямоугольника. Это удобно: мы можем оценить работу, совершаемую газом, по площади фигуры под графиком процесса в координатах
– это площадь прямоугольника. Это удобно: мы можем оценить работу, совершаемую газом, по площади фигуры под графиком процесса в координатах 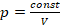 , и работа газа равна площади фигуры под графиком (см. рис. 6).
, и работа газа равна площади фигуры под графиком (см. рис. 6).
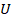 , рассчитали работу газа
, рассчитали работу газа  при разных процессах. А может еще передаваться теплота Q. Чтобы разобраться в этих переходах, осталось эти величины связать: как одно превращается в другое.
при разных процессах. А может еще передаваться теплота Q. Чтобы разобраться в этих переходах, осталось эти величины связать: как одно превращается в другое.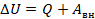
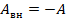
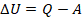
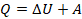


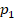 и
и 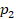 , а высота равна
, а высота равна 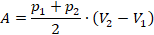

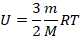
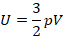
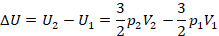
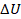 в первое уравнение и находим количество теплоты. Значения давлений и объемов находим на графике и переводим в СИ:
в первое уравнение и находим количество теплоты. Значения давлений и объемов находим на графике и переводим в СИ: 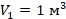 ,
, 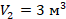 ,
, 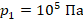 ,
, 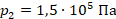 .
.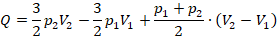
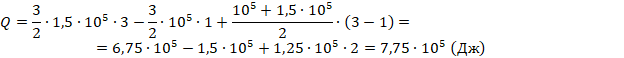
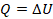 , то есть вся переданная газу теплота идет на изменение внутренней энергии.
, то есть вся переданная газу теплота идет на изменение внутренней энергии.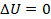 . Тогда уравнение примет вид:
. Тогда уравнение примет вид: 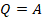 . Вся переданная газу теплота идет на выполнение газом работы.
. Вся переданная газу теплота идет на выполнение газом работы.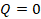 . Может такое быть? Например, когда процесс происходит быстро и вкладом теплообмена можно пренебречь,
. Может такое быть? Например, когда процесс происходит быстро и вкладом теплообмена можно пренебречь, 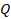 считаем почти равным нулю. Такой процесс назвали адиабатным. Тогда:
считаем почти равным нулю. Такой процесс назвали адиабатным. Тогда: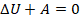
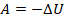

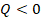 ). При этом он должен охладиться. Из уравнения
). При этом он должен охладиться. Из уравнения 

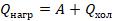
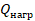 , полученной от нагревателя, идет на выполнение работы
, полученной от нагревателя, идет на выполнение работы 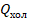 ) передается холодильнику. КПД теплового двигателя мы вычисляем по стандартной формуле: полезная работа, деленная на затраченную энергию, и для теплового двигателя эта формула принимает вид:
) передается холодильнику. КПД теплового двигателя мы вычисляем по стандартной формуле: полезная работа, деленная на затраченную энергию, и для теплового двигателя эта формула принимает вид: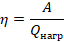
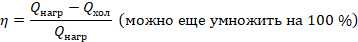
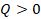 ,
, 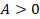 .
.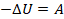 . Здесь
. Здесь 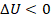 .
.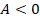 ,
, 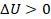 . Таким образом, получили цикл из двух изотерм и двух адиабат.
. Таким образом, получили цикл из двух изотерм и двух адиабат.
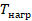 и
и 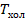 . Ее КПД равен:
. Ее КПД равен: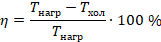
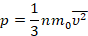
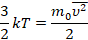
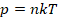
 :
:
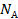 молекул. Значит,
молекул. Значит, 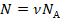 :
: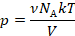
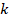 , сделаем это один раз, а произведение обозначим
, сделаем это один раз, а произведение обозначим 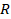 :
: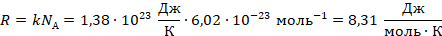
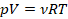
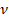 , эти три параметра однозначно зададут его состояние, неизвестных в уравнении не останется. Поэтому это уравнение назвали уравнением состояния идеального газа, или иначе уравнением Менделеева – Клапейрона. А на случай, если нам неудобно пользоваться количеством вещества в молях, можно его выразить через массу вещества:
, эти три параметра однозначно зададут его состояние, неизвестных в уравнении не останется. Поэтому это уравнение назвали уравнением состояния идеального газа, или иначе уравнением Менделеева – Клапейрона. А на случай, если нам неудобно пользоваться количеством вещества в молях, можно его выразить через массу вещества: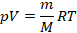
 )?
)?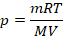

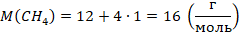
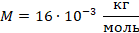
 или в СИ
или в СИ 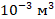 . Значит, объем баллона в СИ будет равен
. Значит, объем баллона в СИ будет равен  .
.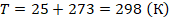
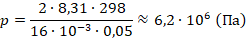
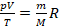 или
или 
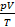 будет равно постоянной
будет равно постоянной 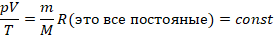
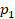 ,
, 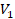 ,
, 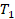 в состояние с параметрами
в состояние с параметрами 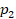 ,
,  ,
, 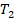 , то можем записать:
, то можем записать: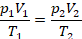
 это уравнение называют уравнением Клапейрона, хотя это то же уравнение состояния, записанное немного иначе.
это уравнение называют уравнением Клапейрона, хотя это то же уравнение состояния, записанное немного иначе.


