

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
Топ:
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Интересное:
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Вычислить работу газа можно по площади фигуры под графиком процесса в координатах 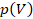 . Даже если график не прямой, как в случае с изотермой, его можно разбить на небольшие промежутки, на каждом из которых давление можно считать постоянным. Тогда можно вычислить работу на каждом участке как площадь прямоугольника и сложить.
. Даже если график не прямой, как в случае с изотермой, его можно разбить на небольшие промежутки, на каждом из которых давление можно считать постоянным. Тогда можно вычислить работу на каждом участке как площадь прямоугольника и сложить.
Мы так уже делали неоднократно: скорость при равноускоренном движении, работа изменяющейся силы упругости. Только график у нас обычно был прямой и сложных вычислений не было. Чтобы можно было работать с графиками любой формы, придумали математический инструмент – интегрирование (см. рис. 7). Он основан на том же процессе, который мы только что описали: разбиение на малые участки и сложение площадей, только специальные формулы позволяют делать это быстрее и точнее.
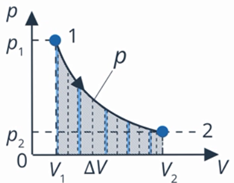
Рис. 7. Интегрирование на графике
Вы научитесь это делать позже на уроках математики в разделе «Интегралы», а сейчас для графика изотермы запишем готовый результат:
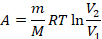
Первый закон термодинамики
Итак, мы научились вычислять внутреннюю энергию 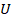 , рассчитали работу газа
, рассчитали работу газа 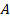 при разных процессах. А может еще передаваться теплота Q. Чтобы разобраться в этих переходах, осталось эти величины связать: как одно превращается в другое.
при разных процессах. А может еще передаваться теплота Q. Чтобы разобраться в этих переходах, осталось эти величины связать: как одно превращается в другое.
Как изменяются и превращаются друг в друга разные виды энергии, описывает закон сохранения энергии, это для нас не новость. Мы формулировали его для механических процессов как закон сохранения полной механической энергии. В ядерной физике мы рассматривали переход массы в энергию. Это все разные формы общего принципа, который можно упрощенно сформулировать так: энергия не возникает из ниоткуда и не исчезает бесследно. Запишем закон сохранения энергии для тепловых процессов.
|
|
Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно количеству теплоты, подведенному к системе извне, плюс работе внешних сил, действующих на нее:
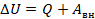
Другими словами, внутренняя энергия газа изменяется на количество теплоты, переданное газу, и на величину работы, совершенной над газом. В таком виде закон сохранения энергии назвали первым законом термодинамики (их мы рассмотрим два) – уравнение простое, но оно позволяет описать множество процессов, связанных с тепловыми явлениями.
Перепишем уравнение в другом виде. Мы чуть раньше в ответвлении разобрались с тем, что работа внешних сил над газом равна работе, совершенной над газом, которая взята со знаком минус:
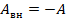
Тогда:
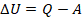
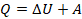
Читаем уравнение: количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение ею работы. В ответвлении применим нашу модель для решения задачи.
Задача 1
Задача 1. Определите количество теплоты, полученное одноатомным газом в ходе процесса, график которого изображен на рисунке 8.
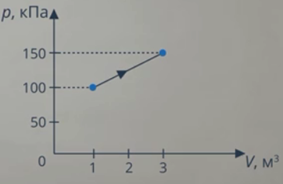
Рис. 8. Условие задачи
Анализ условия. В задаче описан процесс, в ходе которого газ получает теплоту, выполняет работу (так как на графике видно, что объем изменяется). И наверняка изменяется внутренняя энергия: на графике температура не видна, но процесс явно не изотермический. Такие превращения энергии мы описываем с помощью первого закона термодинамики. Работу газа мы умеем вычислять как площадь фигуры под графиком (см. рис. 9).
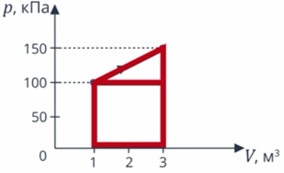
Рис. 9. Работа газа на графике
Уравнение для внутренней энергии одноатомного газа мы тоже знаем. Перейдем к физической части решения, запишем в виде уравнений то, что обсудили.
По первому закону термодинамики, количество теплоты, переданное газу, идет на изменение его внутренней энергии и совершение им работы:
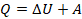
Вычислим работу газа как площадь фигуры под графиком. Можем выделить прямоугольник и треугольник, можем рассматривать полностью трапецию – как удобно. Рассмотрим трапецию: ее основания равны 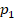 и
и 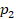 , а высота равна
, а высота равна 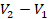 . Из уроков геометрии помним, что площадь трапеции равна (см. рис. 10):
. Из уроков геометрии помним, что площадь трапеции равна (см. рис. 10):
|
|
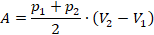
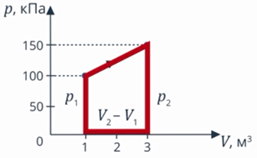
Рис. 10. Площадь трапеции
Внутренняя энергия одноатомного идеального газа определяется температурой:
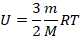
У нас нет температуры, можем переписать, применим уравнение Менделеева – Клапейрона:
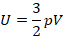
Тогда при переходе из состояния 1 в состояние 2 изменение внутренней энергии равно:
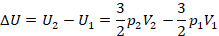
Математическая часть решения задачи осталась простая: подставляем 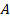 и
и 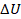 в первое уравнение и находим количество теплоты. Значения давлений и объемов находим на графике и переводим в СИ:
в первое уравнение и находим количество теплоты. Значения давлений и объемов находим на графике и переводим в СИ: 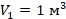 ,
, 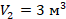 ,
, 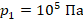 ,
, 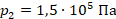 .
.
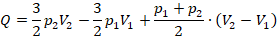
Вычислим:
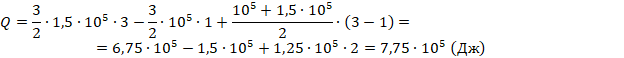
Получили ответ 775 кДж, задача решена.
Применим первый закон термодинамики к изопроцессам. При изобарном процессе давление постоянно, а температура и объем изменяются. Пусть газ нагревается и расширяется. Нагревается – значит, увеличивается внутренняя энергия. Расширяется – значит, выполняет работу. И 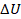 , и работу при изобарном процессе мы вычислять умеем, поэтому по формуле:
, и работу при изобарном процессе мы вычислять умеем, поэтому по формуле: 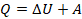 сможем рассчитать количество теплоты.
сможем рассчитать количество теплоты.
При изохорном процессе не выполняется работа, 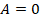 , потому что объем не меняется. Поэтому первый закон термодинамики примет вид:
, потому что объем не меняется. Поэтому первый закон термодинамики примет вид: 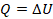 , то есть вся переданная газу теплота идет на изменение внутренней энергии.
, то есть вся переданная газу теплота идет на изменение внутренней энергии.
При изотермическом процессе не изменяется температура, а значит, не изменяется внутренняя энергия, 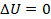 . Тогда уравнение примет вид:
. Тогда уравнение примет вид: 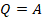 . Вся переданная газу теплота идет на выполнение газом работы.
. Вся переданная газу теплота идет на выполнение газом работы.
В следующем ответвлении мы рассмотрим еще один процесс, адиабатный, оно обязательно к ознакомлению для учеников профильного уровня, для всех остальных – по желанию.
Адиабатный процесс
Выделим еще одну модель, с помощью которой можно описать реальные процессы. Представим себе процесс, при котором газ не обменивается теплотой с окружающими телами, 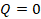 . Может такое быть? Например, когда процесс происходит быстро и вкладом теплообмена можно пренебречь,
. Может такое быть? Например, когда процесс происходит быстро и вкладом теплообмена можно пренебречь, 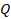 считаем почти равным нулю. Такой процесс назвали адиабатным. Тогда:
считаем почти равным нулю. Такой процесс назвали адиабатным. Тогда:
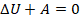
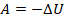
Это значит, что уменьшение внутренней энергии тела равно работе, выполненной этим телом. При этом изменяются все три макропараметра газа: уменьшается температура, увеличивается объем и уменьшается давление. В координатах  график адиабаты идет круче, чем график изотермы: так как тепло извне не подводится и не отводится, температура падает и, соответственно, растет быстрее (см. рис. 11).
график адиабаты идет круче, чем график изотермы: так как тепло извне не подводится и не отводится, температура падает и, соответственно, растет быстрее (см. рис. 11).
|
|
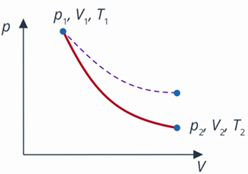
Рис. 11. График зависимости 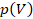 при адиабатном процессе
при адиабатном процессе
Когда мы открываем бутылку с газированным напитком, в которой воздух был под давлением, воздух быстро расширяется, выполняется работа (может даже отскочить крышка), за счет того что уменьшается внутренняя энергия газа – закон сохранения энергии выполняется. И газ охлаждается: мы видим даже конденсацию пара из-за этого охлаждения. И наоборот, если быстро сжать газ, то есть выполнить над ним работу, его внутренняя энергия (а значит, и температура) увеличится. Так при резком сжатии под поршнем воспламеняется топливо в дизельных двигателях (а не от искры, как в бензиновых).
Второй закон термодинамики
С количественными характеристиками тепловых процессов разобрались, ответили на вопрос «сколько?». Конечно, эта модель, как и любая другая, имеет ограничения, идеализация не совпадает с реальностью.
Обратим внимание вот на что. Под поршнем есть некоторое количество газа комнатной температуры. Представим, что он расширился, то есть выполнил работу 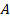 , и нагрел окружающий воздух в комнате (то есть полученное им количество теплоты отрицательно,
, и нагрел окружающий воздух в комнате (то есть полученное им количество теплоты отрицательно, 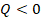 ). При этом он должен охладиться. Из уравнения
). При этом он должен охладиться. Из уравнения 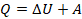 изменение внутренней энергии равно
изменение внутренней энергии равно 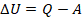 .
. 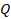 отрицательное, еще и минус
отрицательное, еще и минус 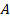 ,
, 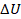 получается отрицательным. В уравнении все сходится, внутренняя энергия уменьшилась, а разность выделилась в виде теплоты и пошла на выполнение газом работы. Но опыт нам подсказывает, что такой процесс самопроизвольно не протекает. Да, вещества обладают внутренней энергией, но не всегда мы ею можем управлять. Мы не можем забрать часть энергии у холодной батареи, чтобы она стала еще холоднее, а руки нагрелись. Воздух, который вырвался из воздушного шарика, самопроизвольно в нем не соберется. Так что помимо количественных характеристик тепловых процессов важно еще направление этих процессов.
получается отрицательным. В уравнении все сходится, внутренняя энергия уменьшилась, а разность выделилась в виде теплоты и пошла на выполнение газом работы. Но опыт нам подсказывает, что такой процесс самопроизвольно не протекает. Да, вещества обладают внутренней энергией, но не всегда мы ею можем управлять. Мы не можем забрать часть энергии у холодной батареи, чтобы она стала еще холоднее, а руки нагрелись. Воздух, который вырвался из воздушного шарика, самопроизвольно в нем не соберется. Так что помимо количественных характеристик тепловых процессов важно еще направление этих процессов.
Опыт подсказывает нам, что теплота самопроизвольно не передается от холодных тел к теплым, но это можно сделать с помощью холодильника. Строго это утверждение сформулировано в виде второго закона термодинамики, он отображает необратимость процессов в природе – они самопроизвольно протекают только в одном направлении. Этот закон имеет множество формулировок, приведем несколько.
|
|
Невозможен процесс перехода теплоты от тела с более низкой температурой к телу с более высокой.
Невозможен процесс, результатом которого было бы совершение работы за счет теплоты, взятой от одного какого-то тела. Еще другими словами – невозможно существование вечного двигателя второго рода (вечный двигатель первого рода предполагает создание энергии из ничего, а второго рода – полное превращение тепловой энергии в механическую).
Эти и другие формулировки следуют одни из другой и описывают одно и то же с разных сторон. Еще несколько формулировок второго закона термодинамики мы приведем в следующем ответвлении, которое обязательно к ознакомлению для учеников профильного уровня, для всех остальных – по желанию.
Второй закон термодинамики
Мы применили второй закон термодинамики к тепловым процессам. Но мы же знаем, что для описания тепловых явлений можно использовать модель механики для большого количества частиц. Поэтому можно распространить второй закон термодинамики и на механические явления.
Для систем с большим количеством элементов, к которым можно применить инструменты статистики, ввели понятие энтропии. Если упрощенно, то это величина, характеризующая неупорядоченность, хаотичность. Например, если весь воздух из комнаты был бы сосредоточен в одном открытом сосуде, энтропия такой системы была бы низкой. Если в одной части комнаты собран весь азот, в другой кислород, а внутри флакона молекулы духОв – энтропия тоже низкая. Но если воздух распределен равномерно и смешан, энтропия такой системы выше.
Так вот, есть такая формулировка второго закона термодинамики: в замкнутых системах (без поступления энергии извне) энтропия не может уменьшаться. То есть неупорядоченность только увеличивается: хаотично движущиеся молекулы не могут сами прийти в порядок, распределившаяся теплота не может передаться назад к источнику, разбитая ваза не может собраться из осколков, разбежавшееся стадо без команды или дрессировки не соберется в стойле и так далее.
Тепловой двигатель
Второй закон термодинамики ограничивает нас в использовании энергии, и возникает задача. Есть энергия, которая содержится в любом веществе – внутренняя энергия. И было бы замечательно научиться как-то ее использовать, превращать в механическую, электрическую и т. д. – в какую нужно. Но как это сделать, если самопроизвольное превращение внутренней энергии в работу невозможно?
|
|
Мы эту задачу уже решили и придумали, на каком принципе должен работать тепловой двигатель (см. рис. 12). Вкратце напомним, о чем мы договорились. Чтобы газ выполнял работу, его нужно нагревать, а затем охлаждать, чтобы привести в исходное состояние.
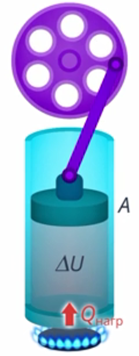

Рис. 12. Принцип работы теплового двигателя за цикл
В итоге тепловой двигатель работает в замкнутом цикле, и он, помимо рабочего тела, должен содержать нагреватель и холодильник. Тогда на разных этапах работы двигателя второй закон термодинамики выполняется: теплота переходит от нагревателя к рабочему телу и от рабочего тела к холодильнику. Превращения энергии мы описывали уравнением:
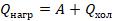
Часть теплоты 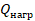 , полученной от нагревателя, идет на выполнение работы
, полученной от нагревателя, идет на выполнение работы 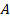 , а остальная (
, а остальная (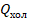 ) передается холодильнику. КПД теплового двигателя мы вычисляем по стандартной формуле: полезная работа, деленная на затраченную энергию, и для теплового двигателя эта формула принимает вид:
) передается холодильнику. КПД теплового двигателя мы вычисляем по стандартной формуле: полезная работа, деленная на затраченную энергию, и для теплового двигателя эта формула принимает вид:
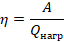
Работу выразим из предыдущего уравнения:
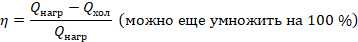
Можем сформулировать второй закон термодинамики еще одним способом. КПД теплового двигателя не может быть равен 100 %. Конечно, у любого механизма есть потери. Но здесь речь о том, что даже идеальный тепловой двигатель должен отдавать теплоту холодильнику, чтобы тот охлаждал рабочее тело, а значит, числитель всегда будет меньше знаменателя и КПД будет меньше 1. Так мы пришли к предыдущим формулировкам второго закона термодинамики.
Следующее ответвление, в котором мы рассмотрим модель теплового двигателя с максимально возможным КПД, обязательно к ознакомлению для учеников профильного уровня, для всех остальных – по желанию.
Цикл Карно
Попробуем построить по возможности наиболее эффективную тепловую машину. Что для этого нужно? Тепловая энергия должна максимально полно превращаться в механическую, без лишних потерь.
Теплота, подводимая к рабочему телу нагревателем, должна полностью идти на выполнение им работы, 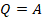 ,
, 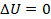 . Такое условие выполняется при изотермическом расширении, это будет первый этап, отметим его на графике (см. рис. 13).
. Такое условие выполняется при изотермическом расширении, это будет первый этап, отметим его на графике (см. рис. 13). 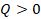 ,
, 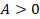 .
.
Сделаем вторым этапом адиабатическое расширение: прекратим подвод теплоты 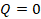 , и уже работа будет совершаться за счет охлаждения газа,
, и уже работа будет совершаться за счет охлаждения газа, 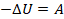 . Здесь
. Здесь 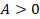 ,
, 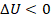 .
.
Теперь начнем возвращать машину в исходное состояние. На этапе 3 сожмем газ, совершив над ним работу, одновременно отводя тепло при помощи холодильника. Отводим все тепло, которое возникает из-за сжатия – так, чтобы внутренняя энергия газа не менялась. То есть процесс идет при постоянной температуре, по изотерме. 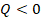 ,
, 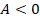 ,
, 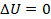 .
.
И наконец, на этапе 4 сожмем газ, совершив над ним работу, не отводя и не подводя тепло, то есть процесс адиабатический. 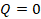 ,
, 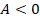 ,
, 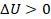 . Таким образом, получили цикл из двух изотерм и двух адиабат.
. Таким образом, получили цикл из двух изотерм и двух адиабат.
Рис. 13. Цикл Карно
Построенная тепловая машина была предложена французским инженером Сади Карно, и описанный цикл носит его имя. КПД этой машины максимально возможный для тепловой машины, работающей при данных температурах нагревателя и холодильника  и
и  . Ее КПД равен:
. Ее КПД равен:
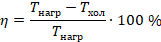
Реализовать такую машину в точности нельзя. Например, в реальности нельзя сжимать газ и отводить тепло так, чтобы газ все время оставался при одной температуре. Теоретически, если тепло передается между телами при равных температурах, оно может передаваться в обоих направлениях (нет более теплого и более холодного). Для такой модели придумали название квазиобратимый процесс: его не существует, но если бы он существовал, то мог бы быть обратимым. А в реальности могут протекать процессы, только с некоторой степенью точности похожие на описанные идеальные: температура почти не меняется или меняется очень медленно, теплообмен почти не происходит, почти все тепло переходит в работу.
Зачем нам эта модель? Чтобы оценить максимальный КПД, который теоретически возможен при данных температурах. Например, мы получили для двигателя на цикле Карно значение КПД 30 %. Это значит, что какой бы мы ни сделали двигатель с данными рабочими температурами, его КПД даже теоретически не может достичь и тем более превысить 30 %. На практике он будет меньше.
|
|
|

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!