

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
Топ:
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Интересное:
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Кроме пиротехнических ВВ, горение которых распространяется за чет движения раскаленных газов и явления теплопередачи, существу-от и детонирующие ВВ, горение которых распространяется за счет (вижения ударной волны. Максимальная скорость горения пиротех-«ических ВВ 1000 м/с, а детонация распространяется со скоростью от 500 м/с до 11000 м/с. Причем для взрыва детонирующих ВВ не требу-гся прочной оболочки вокруг заряда. По чувствительности такие ВВ поразделяются на первичные (инициирующие) и вторичные (бризантные) ВВ.
Бризантными ВВ могут быть как индивидуальные вещества, так и меси. Смеси бывают горючего с окислителем (уже рассмотренный на- (и вариант). Причем горючее или окислитель при разложении должны ыделять энергию (аммиачная селитра, бертолетова соль), либо хотя бы >дин компонент должен быть жидким (исключения из этого правила >едки). Бывает, что к недетонирующей смеси горючего и окислителя добавляют детонирующее ВВ (проводник детонации). Вся смесь приобретает взрывчатые свойства. Иногда к слишком чувствительному ВВ добавляют несколько процентов (до пяти) флегматизатора (воска, цезе-рина, парафина и т. д.), некоторые подобные добавки могут придать ВВ пластичные свойства. Смешивают (или сплавляют и индивидуальные ВВ с разными целями).
Названия смей окислителей с горючими образуют из названия окислителя. Пористые горючие вещества (древесная мука, хлопок, торф, сухой мох и особенно древесный уголь), пропитанные жидким кислородом, называют оксиликвитами. Смеси бертолетовой соли с горючими (например 90% бертолетовой соли и 10% парафина) называют хлоратитами (у французов шеддитами). Смеси на основе аммиачной селитры называют аммонитами.
|
|
Оксиликвиты практически не имеют военного значения из-за очень низкой живучести, то есть не способности сколько-нибудь долго сохранять взрывчатые свойства (не более получаса). Получаются засыпкой пористого горючего в мешочек из рогожи с последуюшей пропиткой жидким кислородом. Взрывается оксиликвит от стандартного детонатора (хотя, если оксиликвит поджечь он горит нестабильно, особенно в замкнутом объеме). Наиболее чувствительна смесь кислорода с порошком активированного угля.
В качестве взрывчатых смесей используют смеси крепкой азотной кислоты с алюминиевой стружкой или нитрометаном.
Интересны смеси в которых в качестве жидкого окислителя выступает перекись водорода (более 50% концентрации). Любая смесь перекиси водорода такой концентрации с органическими горючими взрывчата. Известны смеси перекиси водорода с толуолом и с глицерином.
Хлоратиты (шеддиты) сравнительно маломощные ВВ. В качестве горючего могут содержать далеко не все виды горючего, так как многие вещества могут служить катализаторами разложения бертолетовой соли (особенно фосфор, сера, оксиды некоторых металлов и некоторые органические вещества). В качестве горючего лучше использовать парафин, он служит и флегматизатором. Состав стандартного шеддита — 10% парафина, 90% бертолетовой соли. Бертолетову соль смешивают с алюминием, с угольной или графитовой пылью. Такие хлоратиты получаются более чувствительными, они очень быстро горят и являются также пиротехническими ВВ, хуже проводят детонацию. Все хлоратиты относятся к слабым и малоэффективным взрывчатым веществам, как взрывчатые вещества они не применяются ни в военном деле ни в горной промышленности (ограниченно применяются только для создания пиротехнических эффектов). С другой стороны, имея способность к детонации, они как ВВ гораздо эффективней любых пиротехнических смесей, способны наносить значительные разрушения окружающей среде. Кроме того хлоратиты, не относясь к нитросоединениям, практически не обнаруживаются средствами обнаружения ВВ. Даже если бы такие средства и поставили при контроле пассажиров, то не смогли бы нормально работать, так как они реагировали не только на петарды и бенгальские огни, но и на следы спичек. В смеси с алюминием — бертолетовой соли 69%, алюминия 31%; с углем — бертолетовой соли 77%, угля 23%.
|
|
Кроме бертолетовой соли (хлората калия) для производства взрывчатых веществ применяют перхлораты (в основном перхлорат аммония). Перхлораты получаются из хлоратов осторожным прокаливанием или электролизом. Перхлорат аммония является солью образованной кислотой — окислителем и основанием — горючим, в связи с этим перхлорат 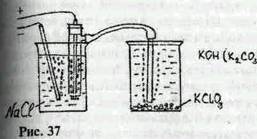 аммония является взрывчатым веществом. При изготовлении перхлората надо опасаться примесей хлората аммония — высокочувствительное и опасное взрывчатое вещество. Как и аммиачная селитра перхлорат аммония является слабым и низкочувствительным взрывчатым веществом при взрыве выделяющим кислород и использующимся только в смесях с горючими. Аммонперхлорит (шеддит): 82% перхлората аммония; 13% динитротолуола; 5% касторового масла — эта смесь превосходит по мощности желатиндинамит, но при взрыве образует вредные для здоровья продукты. Смесь: 90% перхлората аммония; 10% парафина — дает значительное фугасное действие, детонирует только от детонатора. Неплохая смесь получается из 74, 5% перхлората аммония; 17% парафина; 8, 5% алюминиевой пудры (смесь гигроскопична).
аммония является взрывчатым веществом. При изготовлении перхлората надо опасаться примесей хлората аммония — высокочувствительное и опасное взрывчатое вещество. Как и аммиачная селитра перхлорат аммония является слабым и низкочувствительным взрывчатым веществом при взрыве выделяющим кислород и использующимся только в смесях с горючими. Аммонперхлорит (шеддит): 82% перхлората аммония; 13% динитротолуола; 5% касторового масла — эта смесь превосходит по мощности желатиндинамит, но при взрыве образует вредные для здоровья продукты. Смесь: 90% перхлората аммония; 10% парафина — дает значительное фугасное действие, детонирует только от детонатора. Неплохая смесь получается из 74, 5% перхлората аммония; 17% парафина; 8, 5% алюминиевой пудры (смесь гигроскопична).
Все способы получения бертолетовой соли основаны на разложении гипхлоритов выше 60° С. В медицинских учреждениях в качестве дезинфицирующего средства (для мытья полов и туалетов) иногда применяют чистый гипхлорит калия. Чаще с целью дезинфекции применяют хлорную известь (или ее осветленный раствор, средство «Белизна»). Сами хлоратиты получают пропусканием хлора через раствор гидрооксида, карбоната щелочного металла или известкового молочка. Хлорат калия из хлоратов других металлов получают реакцией обмена с растворимыми солями калия (хлорида, сульфата и т. д.). На заводах получают бертолетову соль электролизом раствора хлорида калия (по идее это самый легко доступный способ и по реактивам и по оборудованию, но существует масса мелких технологических неприятностей: и плотность тока ограничена, и раствор, видимо, должен быть достаточно щелочной, и электрод, на котором выделяется хлор (зеленый газ), должен быть ниже электрода, на котором выделяется гидрооксид калия). Менее Цребователен к технологической культуре, но и менее производителен способ, описанный в журнале «Химия и жизнь. «Вам понадобятся два графитовых электрода (можно из отработанных батареек, один электрод может быть угольным «+», а второй — железным «—•» (примечание автора), химический стакан, соединительные провода, резиновые трубки и понижающий трансформатор с выпрямителем на 5 — 10 В (или батарейка на 4, 5 В (в принципе трансформатор не нужен, достаточно одного выпрямителя. Необходимо последовательно подключить ограничитель тока, к примеру лампочку, трансформатор полезен для увеличения силы тока — примечание автора). Соберите прибор, как показано на рисунке (внутрь пробирки с отводом без дна поместите катод и все это в стакан с насыщенным раствором поваренной соли). Во второй стакан налейте 30-40 мл. 50%-ного раствора КОН, нагретого до кипения. (Осторожно! Работайте в очках!) Замкните цепь. На катоде начнет выделяться хлор, который будет равномерно поступать в раствор гидрооксида калия. Так, во втором стакане уже через 5-6 минут появляются белые кристаллики бертолетовой соли. Если же у вас нет едкого калия, то можно заменить его раствором карбоната калия (50 гр. соли в 35 мл. воды). Но синтез займет больше времени, к тому же придется постоянно подогревать второй стакан, добавляя воду по мере ее выкипания. После того,-как реакция закончится (а об этом вы узнаете, проводя пробу на ион угольной кислоты с гидрооксидом бария калия), долейте во второй стакан воды до 100 мл, нагрейте раствор и профильтруйте. Фильтрат выпаривайте до появления первых кристалликов^затем охладите. Отфильтруйте бертолетову соль и промойте ее водой, чтобы очистить от примесей хлорида калия. Высушите хлорат калия на воздухе.»
|
|
Аммониты представляют собой смеси аммиачной селитры (окислителя) и горючего. В качестве горючего используют взрывчатые нитросо-единения с отрицательным кислородным балансом. Ни в коем случае не надо смешивать с аммиачной селитрой пикриновую кислоту! Ее химическое название тринитрофенол, она известна под названиями: мелинит, лиддит, шимоза соответственно на английском, французском и японском языках. Это прекрасное взрывчатое вещество (она является стандартным реактивом и ее часто можно легко достать), из-за образования чувствительных пикратов, по той же причине, пикриновая кислота не должна смешиваться с порошками металлов. Для увеличения энергии взрыва добавляют порошок алюминия, такие смеси называются аммоналами (двойная смесь аммиачной селитры с алюминием:
|
|
18,6% алюминия и 71,4% селитры). Если нитроглицерина или других жидких нитроэфиров больше 7% то взрывчатую смесь относят к динамитам. При содержании взрывчатых нитросоединений от 29% и ниже аммонит должен находиться в виде порошка, при содержании нитросоединений более 20% аммонит получают смешиванием порошка селитры с расплавленным ВВ, взрывчатка получается монолитной. От следования предохраняет парафин (но не более 5%), а также соли жирных кислот и железа (мыло растворяется в воде и приливается раствор какой-то растворимой солью железа, осадок отфильтровывают). ПАВ повышает детонационную способность (ПАВ-это мыльный или стиральный порошок). Эти добавки добавляют в количестве нескольких процентов. Примерами аммонитов могут служить смеси:
1. Аммонит № 6 — 21 % тринитротолуола, 79% аммиачной селитры;
2. Амматол 40/60 — 60% тринитротолуола, 40% аммиачной селитры;
3. Аммонит № 9 — тринитротолуол 5%, древесная мука 8%, аммиачная селитра 87%; динафталит № 1 — динитронафталин 12%, ^И|. аммиачная селитра 88%; аммонал водоустойчивый — тринитро-Нр толуол 15%, металлический алюминий 4, 5%; динаммон торф 12,1%.
Последний приведенный рецепт кроме селитры не содержит других взрывчатых соединений. Аммиачная селитра в смеси с горючими веществами образует взрывчатые смеси. При содержании воды более 5% и при слеживании подобные смеси теряют взрывчатые свойства. В качестве горючих используют порошкообразные вещества — алюминиевый или угольный порошок, древесную муку, торф, ПАВ, сахар, железные соли жирных кислот и т. д., а также жидкие — масло, дизельное топливо, парафин (не более 5%). В двойных смесях с аммиачной селитрой:
алюминий — 18,6%; уголь — 11%; сахар — 26%. Слабое место смесей на основе аммиачной селитры и невзрывчатых горючих веществ заключается в малой чувствительности к воздействию и большом минимальным диаметре устойчиво детонирующего заряда. Для устранения этих недостатков селитру тщательно сушат и размалывают, кроме того добавляют вещества-катализаторы: хлориды (поваренная соль), соединения хрома (хроматы и бихроматы), соединения марганца (кроме перманганата калия, с ним она самопроизвольно взрывается по истечении нескольких часов), соединения железа (соли жирных кислот) и некоторые другие. Интересная смесь получается из аммиачной селитры, алюминиевой пу-Дры и четыреххлористого углерода (эта смесь и по чувствительности и По мощности намного превосходит обычные ВВ на аммиачной селитре). Террористы очень любят бинарные смеси аммиачной селитры и саХара. В Интернете дан интересный состав: аммиачная селитра — 75%, уголь — 20%, алюминиевая пудра — 5%. После просушивания, измельчения и перемешивания компонентов к смеси 3-5%. Самое интересное,что в этом рецепте предлагается эту смесь спрессовать (с трудом верится что сработает, но попробуйте - если она и взорвется, то придется сделать крупное гнездо для детонатора и запрессовать туда порошковое ВВ) Еше необходимо напомнить - аммиачную селитру нельзя смешивать с пикриновой кислотой, бертолетовой солью, перманганатом калия, нитритом натрия!
|
|
_ ВЗРЫВЧАТЫЕ НИТРОСОЕДИНЕНИЯ
|
|
|

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!