· автотрофы – синтезируют все углеродсодержащие в-ва из СО2; К ним относят нитрифицирующие бактерии, железобактерии, серобактерии и др.
· гетеротрофы – в качестве источника углерода используют органические вещества из гексоз, а/к, многоатомных спиртов; (E. coli, возбудители туберкулеза, бруцеллеза и др.)
· сапрофиты – питаются орг-ми веществами отмерших организмов; (M. salivarum, M.orale, M. smegmatis)
· паразиты – живут за счет органических веществ живой клетки организма. (C. pneumoniae, R. prowazeki)
*Облигатные (абсолютные внутриклеточные) паразиты – м/о, способные размножаться только в живых клетках организма хозяина (хламидии, риккетсии и вирусы). Хламидии яв-ся “энергетическим” паразитами- имеют собственный метаболизм, но зависят от энергетического обмена клеток хозяина.
Облигатные анаэробы: Clostridium, Bacteroides
*Факультативные паразиты – м/о способные длительно переживать и размножаться в клетках хозяина и на искусственных питательных средах (пастереллы, листерии, иерсинии, S. aureus, K.pneumoniae и многие кишечные бактерии) вирусы – в курином эмбрионе
Факультативные анаэробы: Mycobacterii, Brucel, Bordetella pertusis, Pseudomonas aeruginosa
В зависимости от источников энергии и природы доноров микроорганизмы подразделяют на:
- фототрофы (фотосинтезирующие), способные использовать солнечную энергию для синтеза органических веществ (сапрофитные микроорганизмы)-Цианобактерии
- хемотрофы (хемосинтезирующие), получающие энергию за счет ОВР за счет химических связей. В зависимости от природы доноров электронов хемотрофы подразделяются на хемолитотрофы (хемоавтотрофы) и хемоорганотрофы (хемогетеротрофы) .Это железобактерии, серобактерии, нитрифицирующие бактерии.
23.Факторы роста. Ауксотрофы и прототрофы.
Некоторые бактерии (особенно прихотливые или мутанты с наследственными дефектами) могут расти только в среде, дополненной определёнными компонентами, которые сами микроорганизмы синтезировать не могут. Эти компоненты известны как ростовые факторы, а подобные бактерии называют ауксотрофами. Если ауксотрофия возникает в результате мутации, то «дикий», или основной тип, не нуждающийся в определённом факторе роста, называют прототрофным.
Основные ростовые факторы — витамины, пурины и пиримидины. Наиболее важны для бактерий водорастворимые витамины, принимающие участие в функционировании большого количества ферментов в качестве коэнзимов. Потребность бактерий в этих продуктах очень мала, то есть факторы роста не используются в качестве пластического или энергетического материала, но обеспечивают регуляцию метаболизма.
Классификация факторов стимулирующих рост бактерий Факторы, стимулирующие рост бактерий, разделяют на три категории.
•Вещества, присутствие которых обязательно для роста бактерий. Это может быть определённая аминокислота, например, гистидин, для штамма Salmonella thyphi murium his- (гистидин-отрицательный), ауксотрофного по гистидину, либо набор витаминов (лактофлавин, тиамин, биотин, фолиеван и пантотеновая кислота) и аминокислот, без которых нельзя вырастить молочнокислые бактерии.
•Факторы, отсутствие которых не вызывает полной остановки роста культуры. Обычно это определённые витамины, входящие в состав простетических групп ферментов и необходимые в очень малых количествах.
•Факторы, синтезируемые самими микроорганизмами и добавление которых в среду ускоряет рост, но это условие не обязательно (например, в синтетическую среду культивирования Escherichia coli можно добавить дрожжевой автолизат для интенсификации роста, но и на простой минеральной среде с глюкозой бактерия будет расти).
Пусковые факторы роста выделяют в особую категорию. Позднее клетки культуры синтезируют все необходимые для их роста продукты самостоятельно. В качестве примера можно привести необходимость следовых количеств гистидина для роста ревертантов Salmonella his- и их обратной мутации в his+ (гистидинположительный). Хотя прототрофы his+ не нуждаются в факторах роста, деление исходного ауксотрофа his-, необходимое для закрепления обратной мутации, может протекать только в присутствии гистидина.
24. Ферменты бактерий. Химическая природа. Экзо - и эндоферменты, их зачение в метаболизме клетки. Конститутивные и индуцибельные ферменты. Примеры. Классы ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и синтетазы (лигазы).
Ферменты – это биологические катализаторы (повышают скорость химических реакций). По химической природе они являются белками.
У бактерий обнаружены ферменты 6 классов:
– оксидоредуктазы— окислительно-восстановительные ферменты (дегидрогеназы, цитохромы, пероксидазы, каталазы) — катализируют окислительно-восстановительные реакции;
– трансферазы — осуществляют реакции переноса групп атомов с одной молекулы на другую (напр., трансаминазы переносят аминогруппы от аминокислот к кетокислотам, обеспечивая синтез аминокислот);
– гидролазы — осуществляют гидролитическое расщепление различных соединений (пептидогидролазы разрушают белки, эстеразы разрушают сложноэфирные связи, амилаза разрушает крахмал);
– лиазы — катализируют реакции отщепления от субстрата химической группы негидролитическим путем (без участия воды) с образованием двойных связей (например, декарбоксилазы отщепляют карбоксильные группы);
– изомеразы — катализируют реакции изомеризации и определяют пространственное расположение групп элементов;
– лигазы (синтетазы) — катализируют реакции связывания, сопровождающиеся расщеплением пирофосфатной связи в молекуле АТФ или аналогичного трифосфата.
По месту функционирования микробные ферменты делятся на:
– эндоферменты — ферменты прочно связанные с бактериальной клеткой; катализируют внутриклеточные реакции (синтетические процессы, дыхание);
– экзоферменты — выделяются во внешнюю среду. Осуществляют процессы расщепления высокомолекулярных субстратов до низкомолекулярных соединений, способных проникать внутрь клетки.
Соотношение у микроорганизмов сдвинуто в сторону экзоферментов, так как объем клетки маленький и экзоферменты играют исключительно важную роль в приспособлении микроорганизмов к неблагоприятным условиям. Способность к образованию экзоферментов во многом определяет инвазивность бактерий — способность проникать через слизистые, соединительнотканные и другие тканевые барьеры. Напр., гиалуронидаза расщепляет гиалуроновую кислоту, входящую в состав межклеточного вещества, что повышает проницаемость тканей (клостридии, стрептококки, стафилококки); нейраминидаза облегчает преодоление слоя слизи, проникновение внутрь клеток и распространение в межклеточном пространстве (холерный вибрион, дифтерийная палочка). К экзоферментам относятся энзимы, разлагающие антибиотики.
В соответствии с механизмами генетического контроля у бактерий выделяют различают ферменты:
– конститутивные — синтезируются постоянно, в том числе и при отсутствии субстрата в окружающей среде и работают всегда. К конститутивным ферментам относятся ферменты гликолиза.
– индуцибельные (адаптивные) — их синтез индуцируется наличием субстрата для данного фермента. Работают по мере необходимости: если внести во внешнюю среду субстрат, то через 2–3 секунды повышается активность ферментов, его утилизирующих. Также быстро и прекращается биосинтез индуцибельных ферментов при исчезновении субстрата. К индуцибельным ферментам относятся ферменты транспорта и катаболизма (напр., лактозопермеаза, b–галактозидаза, b–лактамазы).
25. Методы изучения ферментативной активности бактерий и использование ее для идентификации бактерий.
Наиболее часто определяют ферменты класса гидролаз и оксидоредуктаз, используя специальные методы и среды.
Для определения протеолитической активности микроорганизмы засевают в столбик желатина уколом. Через 3—5 дней посевы просматривают и отмечают характер разжижения желатина. При разложении белка некоторыми бактериями могут выделяться специфические продукты — индол, сероводород, аммиак. Для их определения служат специальные индикаторные бумажки, которые помещают между горлышком и ватной пробкой в пробирку с МПБ или (и) пептонной водой, засеянными изучаемыми микроорганизмами. Индол (продукт разложения триптофана) окрашивает в розовый цвет полоску бумаги, пропитанной насыщенным раствором щавелевой кислоты. Бумага, пропитанная раствором ацетата свинца, в присутствии сероводорода чернеет. Для определения аммиака используют красную лакмусовую бумажку.
Для многих микроорганизмов таксономическим признаком служит способность разлагать определенные углеводы с образованием кислот и газообразных продуктов. Для выявления этого используют среды Гисса, содержащие различные углеводы (глюкозу, сахарозу, мальтозу, лактозу и др.). Для обнаружения кислот в среду добавлен реактив Андреде, который изменяет свой цвет от бледно-желтого до красного в интервале рН 7,2—6,5, поэтому набор сред Гисса с ростом микроорганизмов называют «пестрым рядом».
Для обнаружения газообразования в жидкие среды опускают поплавки или используют полужидкие среды с 0,5% агара.
Для того чтобы определить интенсивное кислотообразование, характерное для брожения смешанного типа, в среду с 1% глюкозы и 0,5% пептона (среда Кларка) добавляют индикатор метиловый красный, который имеет желтый цвет при рН 4,5 и выше, и красный — при более низких значениях рН.
Гидролиз мочевины определяют по выделению аммиака (лакмусовая бумажка) и подщелачиванию среды.
Обнаружить каталазу можно по пузырькам кислорода, которые начинают выделяться сразу же после смешивания микробных клеток с 1 % раствором перекиси водорода.
Для определения цитохромоксидазы применяют реактивы: 1) 1% спиртовый раствор сс-нафтола-1; 2) 1% водный раствор N-диметил-р-фенилендиамина дигидрохлорида. О наличии цитохромоксидазы судят по синему окрашиванию, появляющемуся через 2—5 мин.
Для определения нитритов используют реактив Грисса: появление красного окрашивания свидетельствует о наличии нитритов.
26. Методы изучения протеолитической активности бактерий (реакции на индол, сероводород и др.)
Разложение микробами белка сопровождается образованием индола, сероводорода, аммиака.
Реакция на сероводород. Исследуемую культуру засевают в МПБ, под пробкой укрепляют полоску бумаги, пропитанной ацетатом свинца. Почернение бумаги после инкубации при 370 в течение 2-3 суток свидетельствует о наличии сероводорода. E.coli не образует сероводород в отличие от возбудителей брюшного тифа и паратифа В.
Проба на индол: Способ Эрлиха: в пробирку с культурой бактерий прибавляют 2-3 мл эфира, содержимое энергично перемешивают и добавляют несколько капель реактива Эрлиха (спиртовой раствор парадиметиламидобензальдегида с хлороводородной кислотой). В присутствии индола наблюдается розовое окрашивание; при осторожном наслаивании образуется розовое кольцо.
27. Принципы определения каталазной и плазмокоагулазной активности стафилококков.
Идентификация стафилококков по биохимическим признакам:
а) определение каталазной активности
На предметное стекло наносят каплю 1-3% раствора пероксида водорода и вносят в нее петлю с бактериальной культурой. Каталаза разлагает пероксид водорода на кислород и воду. Выделение пузырьков O2 свидетельствует о наличии у данного вида бактерий фермента каталазы. Каталазной активностью обладают стафилококки в отличие от стрептокков;
б) определение плазмокоагулазной активности. Плазмокоагулаза – фермент S.aureus сворачивающий фибрин за счет активации предшествующего в плазме крови протромбина, тем самым, защищая бактерии от клеточных и гуморальных факторов иммунитета.
В пробирку с цитратной плазмой вносят исследуемую культуру, помещают в термостат при (37 +/- 1) °С и через 1, 2, 3, 18 и 24 ч проверяют наличие свертывания плазмы. Реакция считается положительной независимо от степени свертывания плазмы. S.аureus обладает плазмокоагулазной активностью в отличие от других стафилококков.
28. Пигменты бактерий, классификация по растворимости в воде. Примеры, их значение.
Многие бактерии и грибы в процессе жизни выделяют красящие вещества- пигменты, придающие культурам разнообразный цвет и оттенки (белый, желтый, красный, розовый, золотистый, черный, зеленый, фиолетовый).
Образование пигмента для ряда микроорганизмов является стойким признаком вида, что используют при их идентификации.
Если пигмент растворим в воде, то питательная среда, в которой растут пигментирующие бактерии, также окрашивается в соответствующий цвет.
В зависимости от отношения к растворителям - воде, спирту, эфиру, различают:
1.пигменты, растворимые в воде (синий пигмент пиоцианин, выделяемый Pseudomonas aeruginosa (синегнойная палочка)
2.пигменты, растворимые в спирте (красный пигмент - продигиозан, выделяемый (Штамм bacterium prodigiosum (serratia marcescens)
3.пигменты, не растворимые ни в воде, ни в спирте (черный пигмент грибов).
Пигменты у микробов играют защитную роль против действия солнечного света. Кроме того, они участвуют в процессе дыхания.
Пигменты бактерий представлены различными веществами — каротиноидами, феназиновыми производными, пирролами, антоцианами и др. Пигменты бактерий — вторичные метаболиты, то есть они не являются веществами, обязательно присутствующими у всех бактерий. Способность к пигментообразованию выражена у видов Sarcina, Micrococcus, Staphylococcus, Corynebacterium, Mycobacterium, Nocardia и др. Этот признак генетически детерминирован, поэтому его используют в качестве дифференцирующего критерия.
• Пигменты защищают бактерии от действия видимого света и УФ-лучей. Мутанты, лишённые способности к пигментообразованию, быстро погибают на свету. Искусственно окрашенные бактерии (например, метиленовым синим) также проявляют повышенную лабильность к инсоляции. Бактерицидное действие солнечного света проявляется в присутствии кислорода и обусловлено фотоокислением. При этом клеточные пигменты (флавины и цитохромы) действуют как катализаторы. Каротиноиды ингибируют этот процесс. У некоторых бактерий образование пигментов происходит только на свету (например, каротиноидов у туберкулёзной палочки).
• Многие пигменты проявляют антибиотические свойства. Между пигментацией и образованием вторичных метаболитов существует такая тесная корреляция, что при наличии пигментов можно с большой долей вероятности ожидать образования антибиотиков и других БАВ.
29. Основные типы биологического окисления субстрата бактериями. Аэробы, факультативные анаэробы, микроаэрофилы, анаэробы. Примеры.
Процесс получения энергии у прокариотов— дыхание (биологическое окисление), в результате которого синтезируются молекулы АТФ. У некоторых микроорганизмов аккумулятором энергии могут быть и другие фосфаты, иногда даже неорганические.
Дыхательный аппарат бактерий состоит из мезосом — инвагинаций ЦПМ, где локализованы ферменты-оксидоредуктазы, с помощью которых происходит биологическое окисление.
В зависимости от того, что является конечным акцептором электронов, выделяют три типа образования энергии у бактерий: аэробное дыхание, анаэробное дыхание и ферментацию (брожение)
Аэробный тип — окислительное фосфорилирование— совокупность процессов ферментативного распада органических веществ (реже — неорганических), происходящих с участием свободного кислорода.
Процесс дыхания у аэробов протекает по типу окислительной реакции путем отщепления от субстратов водорода (или электронов). Чаще наблюдается гликолиз — процесс ферментативного расщепления углеводов.
Аэробное дыхание энергетически более эффективно. Образуется также много промежуточных и конечных продуктов метаболизма, которые используются для синтеза белков, углеводов, витаминов. Филогенетически аэробное дыхание возникло позже.
Облигатным (строгим) аэробам для дыхания необходим молекулярный (атмосферный) кислород. Они не могут жить и размножаться в отсутствие молекулярного кислорода, используют только аэробный путь окисления (некоторые виды псевдомонад, холерный вибрион, туберкулезная палочка).
Для аэробов, растущих на агаре или в тонких слоях жидкости в присутствии воздуха, кислорода вполне достаточно. В жидких средах при большом объеме жидкости аэробные бактерии могут расти только на поверхности, так как в более глубоких слоях по мере удаления от поверхности условия приближаются к анаэробным. Для нормального роста аэробных микроорганизмов в глубоких слоях жидкой культуры требуется аэрация.
Микроаэрофилы (факультативные аэробы) нуждаются в уменьшенной концентрации (низком парциальном давлении) свободного кислорода (от 0,01 до 0,03 бар). При полном доступе кислорода (в воздухе парциальное давление О2 составляет 0,2 бар) рост микроорганизмов прекращается или резко замедляется. Микроэрофилами является большинство аэробных бактерий.
2. Анаэробный тип —совокупность экзотермических процессов ферментативного распада органических веществ, происходящих без участия кислорода. Анаэробы получают энергию в форме АТФ путем ускоренного, но не полного окисления (субстратного фосфорилирования) углеводов, белков, липидов.
Различия между облигатными аэробами и анаэробами касаются ферментативного обеспечения конечных этапов окисления. У анаэробов дегидрогеназы не связаны с мембранами и находятся в ЦП только в растворимой форме.
Анаэробный путь филогенетически более ранний, чем аэробный, но он экономически невыгоден, так как выделяется небольшое количество энергии и образуется мало метаболитов. Так как энергии выделяется мало, микроорганизмам надо использовать большое количество субстратов (сахаров, аминокислот, пуринов и пиримидинов). Многие анаэробы являются строго протеолитическими организмами, неспособными сбраживать углеводы. Протеолитическая активность у некоторых анаэробов (C. histolyticum) настолько высока, при инфекциях, вызванных этими микроорганизмами, наблюдается расплавление мышц. Другие анаэробы обладают слабовыраженной сахаролитической активностью.
Анаэробы осуществляют обмен веществ и размножаются в условиях отсутствия кислорода в среде обитания. Различают облигатных, аэротолерантных и факультативных анаэробов.
Облигатные (строгие) анаэробы (палочка маслянокислого брожения, возбудители столбняка, ботулизма) используют только анаэробный путь биологического окисления и размножаются только в анаэробных условиях. Они лишены ферментов супероксиддисмутазы и каталазы, защищающих микробную клетку от токсических продуктов окисления. Поэтому вегетативные формы облигатных анаэробов погибают от ядовитых концентраций перекиси водорода даже при кратковременном контакте с воздухом. Спорам облигатных анаэробов свойствен крайне выраженный анабиоз, поэтому они могут сохраняться в присутствии кислорода.
Аэротолерантные микроорганизмы (молочнокислые бактерии, C. histolyticum) обладают супероксиддисмутазной активностью, но лишены каталазы и пероксидазы; они могут расти в присутствии атмосферного кислорода, но не способны его использовать; энергию получают исключительно с помощью брожения.
Факультативные анаэробы (большинство патогенных бактерий, например, Enterobacteriaceae (кишечная палочка, сальмонеллы), многие дрожжи) обладают супероксиддисмутазной и каталазной активностью. Факультативные анаэробы образуют АТФ при окислительном и субстратном фосфорилировании. Они могут изменять свой путь биологического окисления в зависимости от наличия или отсутствия кислорода. В кислородных условиях в качестве конечного акцептора водорода они используют атмосферный кислород. В бескислородных условиях в качестве конечного акцептора водорода они используют нитраты или сульфаты.
30. Рост и размножение бактерий. Фазы размножение бактерий.
Рост микроорганизмов — генетически контролируемое увеличение объема и массы микробной клетки, связанное с синтезом новых веществ. Рост в применении к популяции — увеличение биомассы популяции.
Каждая фаза роста культуры в питательной среде характеризуется определенным размером клеток, скоростью размножения и потребления субстрата, синтезом метаболитов.
A — фаза задержки роста (начальная стационарная), или лаг-фаза, в среднем длится 1–2 ч. Начало лаг-фазы связано с адаптацией клеток к среде обитания. Важную роль играет «предыстория» выращивания посевной культуры. Если использован инокулят из культуры с резко отличающимися условиями выращивания, то клеткам требуется время на синтез новых рибосом, РНК и адаптивных ферментов. В этом периоде увеличивается размер клеток, в 8–12 раз повышается содержание РНК. Деления клеток при этом почти не происходит. Полноценная среда, физиологически активная посевная культура, которая подготовлена к синхронному делению, способствуют короткой лаг-фазе (или ее отсутствию) переходу ко II фазе. Синхронизации можно достичь с помощью пониженной температуры, ограничения питательных веществ, фильтрации, обеспечивающей пропускание клеток определенного размера.
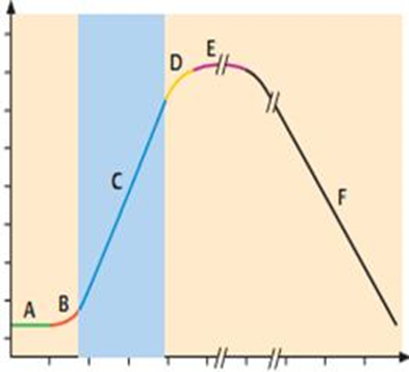 Логарифм количества жизнеспособных клеток
Логарифм количества жизнеспособных клеток
Рис. 62. Фазы роста бактериальной культуры в питательной среде: A – лаг-фаза; B – период положительного ускорения; C – лог-фаза; D – фаза отрицательного ускорения; E – стационарная фаза; F – фаза отмирания
Синхронизация длится 2–4 генерации, а далее наступает асинхронный рост.
B — короткий период положительного ускорения между фазами A и B, когда начинается деление бактерии.
C— фаза логарифмического (экспоненциального) роста начинается, когда скорость роста клеток всей популяции достигает постоянной величины, средняя продолжительность ее 5–6 ч. Скорость деления клеток максимальная, но клетки имеют наименьший размер. Популяция бактериальной культуры состоит из делящихся клеток и достаточно стандартна по своим свойствам (содержание белка, нуклеиновых кислот, наиболее выраженные видовые признаки), поэтому эта фаза удобна для определения многих параметров популяции. В этот период отмечено снижение резистентности к агрессивным веществам.
Несмотря на постоянную скорость роста популяции бактерий в логарифмической фазе, отдельные клетки все же находятся в разных стадиях деления. Иногда важно синхронизировать рост всех клеток популяции, то есть получить синхронную культуру. Простыми методами синхронизации являются изменение температурных условий или культивирование в условиях недостатка питательных веществ. Вначале культуру помещают в неоптимальные условия, затем сменяют их оптимальными. При этом у всех клеток популяции синхронизируется цикл деления, но синхронное деление клеток происходит обычно не более 3–4 циклов.
D— фаза замедления скорости роста (отрицательного ускорения) длится около 2 ч. Количество питательных веществ существенно уменьшается (отмечается воздействие на бактерии лимитирующих факторов), в культуральной жидкости накапливаются метаболиты, в том числе токсичные для бактерий (отмечается ингибирующее воздействие) и скорость деления клеток снижается.
E — стационарная фаза, или фаза максимальной концентрации(М–концентрация). Клетки перестают делиться. Однако, количество живых клеток постоянно, так как количество жизнеспособных бактерий соизмеримо с количеством отмирающих. В этот период клетки переходят на эндогенные субстраты (окисляют запасные вещества, белки, углеводы, липиды). Длительность стационарной фазы различается у разных микроорганизмов. Напр., у E. coli она наступает через 18–24 ч, у Azotobacter — через 72 ч с момента внесения инокулята в питательную среду.
F — фаза отмирания, характеризуется массовой гибелью бактерий. В бактериальной популяции отмечается образование инволюционных форм, аутолиз под действием собственных ферментов.. Гибель может наступить через несколько дней, недель, месяцев.
В эту фазу различают периоды ускоренной гибели (количество живых клеток начинает снижаться с увеличивающейся скоростью), логарифмической гибели (количество живых клеток убывает с максимальной скоростью), уменьшения скорости гибели (количество живых клеток убывает с уменьшающейся скоростью) и стационарную фазу минимума (количество живых клеток минимально).
Если в питательной среде создают условия для поддержания микроорганизмной популяции в экспоненциальной фазе — это хемостатные (непрерывные) культуры.
31. Механические способы создания анаэробных условий
Механические методы удаления кислорода1. Посев анаэробной культуры уколом в высокий столбик сахарного агара или среды Вильсон-Блера. Это наиболее простой способ.
2.Способ Виньяля-Вейона. В расплавленный и остуженный до 50°С агар вносят исследуемую анаэробную культуру, перемешивают и засасывают в пастеровскую пипетку, конец которой запаивают. В среде вырастают ясно видимые снаружи колонии бактерий, которые можно извлечь, распилив трубку.
3. Метод Перетца. В пробирку с растопленным и остужённым до 45° сахарным агаром вносится и размешивается исследуемая культура. Смесь выливается в стерильную чашку Петри, охлаждается. На поверхность накладывается стерильное стекло. Чашку в закрытом виде помещают в термостат на 18-20 часов. Под стеклом вырастают колонии, которые извлекают, отодвинув стекло.
32. Физические методы удаления кислорода
1.Аанаэростат, из которого воздух выкачивается насосом. Можно использовать вместо анаэростата эксикатор.
2. Аппарат Киппа, где воздух заменен индифферентным газом -водородом.
3. Среде Китта-Тароцци: (МПБ, 0,5 % глюкозы и кусочками свежих органов животных, например, печени или с мясным фаршем). Кусочки органов, а также глюкоза обладают рецидивирующими свойствами. Перед посевом её кипятят и заливают сверху стерильным вазелиновым маслом.
33. Химические методы удаления кислорода
1. Прибор Омелянского, где для поглощения кислорода используется пирогаллол.
2. Среда Вильсон – Блера (железо - сульфитный агар). Черные колонии образует C.perfringens за счет образования сульфата железа (FeS).
Биологический метод удаления кислорода по Фортнеру
В чашку Петри с толстым слоем агара делят на 2 половины, на одну половину засевают облигатный аэроб – «чудесную» палочку (S.marcescens), на другую половину чашки засевают исследуемую анаэробную культуру. Чашку заливают растопленным парафином. Через 24-48 часов в чашке вырастают аэробы, затем, когда запас кислорода исчерпывается, начинают размножаться анаэробы
34. Питательные среды для культивирования бактерий. Требования. Классификация.
Питательной средой в микробиологии называют среды, содержащие различные соединения сложного или простого состава, которые применяются для размножения микроорганизмов в лабораторных или промышленных условиях.
Основные требования, предъявляемые к питательным средам:
•Питательные среды должны содержать все необходимые для питания микроба питательные вещества, т.е. обладать питательностью.
•Иметь достаточную влажность
•Иметь оптимальную рН (7,2-7,6) кислотность среды.
•Обладать изотоничностью (концентрация NaCl 0,87%), для галофильных бактерий концентрация соли 1% и выше.
•Иметь оптимальный электронный потенциал, свидетельствующий о содержании в среде растворенного кислорода. Он должен быть высоким для аэробов и низким для анаэробов.
•Быть стерильными (чтобы не было других бактерий).
Для приготовления питательных сред используют продукты животного происхождения (мясо, рыба, кровь, яйца, молоко) и продукты растительного происхождения (картофель), имеющих неопределенный химический состав. Также используют синтетические питательные среды, составленные из химических соединений.
Источником азота для бактерий служат простые аммонийные соединения, аминокислоты или пептоны; источником углерода – сахар, многоатомные спирты, органические кислоты.
Потребность бактерий в неорганических элементах удовлетворяется прибавляемыми к питательной среде солями: NaCl, КН2РО4, К2НРО4.
В зависимости от консистенции питательные среды могут быть: жидкими, полужидкими и плотными. Плотность среды достигается добавлением агара. Агар - полисахарид, получаемый из водорослей. Он плавится при температуре 100℃, остывает при температуре 45-50℃. Для полужидких сред агар добавляют в концентрации 0,5%, для плотных – 1,5-2%. Жидкие среды не содержат агар-агара.
По составу питательные среды могут быть простыми и сложными. К простым средам относятся пептонная вода, мясопептонный бульон, мясопептонный агар, агар Хоттингера. Сложные – это простые с добавлением дополнительного питательного компонента (сахарный, сывороточный, желчный бульоны, кровяной, сывороточный, желточно-солевой агары, среда Кита-Тароцци, Вильсона-Блера).
В зависимости от назначения среды подразделяются:
1.Общего назначения – для культивирования большинства бактерий (мясопептонный агар, кровяной агар).
2.Специального назначения:
а) элективные среды – это среды, на которых растет какой-то определенный микроорганизм. Например, щелочной агар, имеющий рН 9, служит для выделения холерного вибриона.
б) среды обогащения – это такие среды, которые стимулируют рост какого-то определенного микроорганизма, ингибируя рост других. Например, магниевая и селенитовая среды стимулируют рост бактерий рода сальмонелла, ингибируя рост кишечной палочки.
в) дифференциально-диагностические среды служат для изучения ферментативной активности бактерий (среды Гисса).
г) комбинированные питательные среды сочетают в себе элективную среду, подавляющую рост сопутствующей флоры и дифференциально-диагностическую (среда Плоскирева для выделения шигелл, висмут-сульфитный агар – для сальмонелл). Обе эти среды ингибируют рост кишечной палочки.
35. Основные питательные среды. Состав. Назначение.
Универсальные (основные) среды. Эти среды используют для культивирования большинства относительно неприхотливых микроорганизмов или применяют в качестве основы для приготовления специальных сред, добавляя к ним кровь, сахар, молоко, сыворотку и другие ингредиенты, необходимые для размножения того или иного вида микроорганизмов. К этой группе относятся: МПБ – мясо-пептонный бульон, МПА - мясо-пептонный агар, МПЖ – мясо-пептонный желатин и т.п.
МПА = пептон ферментированный + экстракт мясной + NaCl +агар
(растут энтеробактерии, синегнойная палочка, стафилококк)
МПБ = пептон ферментированный, экстракт мясной, NaCl
МПЖ = пептон ферментированный + экстракт мясной + желатин + NaCl
36. Элективные питательные среды. Состав, назначение. Примеры.
Элективные (избирательные) среды. Эти среды предназначены для избирательного выделения и накопления микроорганизмов определенного вида из материала, содержащего несколько видов микробов. При посеве на них материала, содержащего смесь различных микроорганизмов, раньше всего будет проявляться рост того вида, для которого данная среда будет элективной. Избирательность среды достигается путем создания условий, оптимальных для культивирования определенных микробов (рН, Еh, концентрация солей, состав питательных веществ), т.е. положительной селекцией. Или путем добавления в среду веществ, угнетающих другие микроорганизмы (желчь, высокие концентрации NаСl, антибиотики и др.), т.е. отрицательной селекцией. К этой группе относятся:
Сывороточный мясопептонный агар – сывортка крови + МПА – сыворотка как источник белка. Является элективной для менингококков, стрептококков, пневмококков, гонококков, C.diphtiriae
Висмут-сульфит агар — содержит МПА соли висмута, бриллиантовую зелень. Сальмонеллы растут на этой среде в виде колоний черного цвета. Другие виды бактерий на этой среде роста не дают.
Желточно-солевой агар (ЖСА) — МПА - питательная основа; 10%NaCl - элективный фактор; лецитин куриного желтка – дифференциальный фактор. Среда для выделения стафилококков, содержит до 10% хлорида натрия, что подавляет большинство бактерий, содержащихся в материале. Кроме того, эта среда является и дифференциально-диагностической, так как присутствие яичного желтка позволяет выявить фермент лецитиназу (лецитовителлазу), который образуют патогенные стафилококки.
Желчный бульон элективен для сальмонелл, размножение которых стимулирует добавленная 10% желчь, одновременно тормозящая рост сопутствующих микроорганизмов.
Щелочной агар или щелочная пептонная вода элективны для холерных вибрионов, щелочная реакция среды (рН 9,0) не препятствует росту холерных вибрионов, но тормозит рост других микроорганизмов. 3-5 сут.
Среда Левенштейна-Йенсена – яично-картофельно-глицериновая среда. Глицерин подавляет рост других микроорганизмов. Элективна для M.tuberculosis
Среда Борде Жангу – МПА + картофельный настой. Рекомендуют для выделения культур Bordetella pertussis и Bordetella parapertussis.(коклюш).
37. Дифференциально-диагностические среды. Состав, назначение. Примеры.
Используют для окончательнойидентификации выделенной чистой культуры методом определения видовой принадлежности исследуемого микроба, основываясь на особенностях его обмена веществ. По своему назначению дифференциально-диагностические среды разделяют следующим образом:
1.Среды для выявления протеолитической способности микробов, содержащие в своем составе молоко, желатин, кровь и т.д.
2.Среды с углеводами и многоатомными спиртами для обнаружения различных сахаролитических ферментов.
Примеры дифференциально-диагностических сред:
Среда Эндо. Состоит из МПА с добавлением 1% лактозы и обесцвеченного сульфитом натрия основного фуксина (индикатор). Среда Эндо имеет слабо розовый цвет. Используется в диагностике кишечных инфекций для дифференциации бактерий, разлагающих лактозу с образованием кислых продуктов, от бактерий, не обладающих этой способностью. Колонии лактозопозитивных микробов (кишечная палочка) имеют красный цвет вследствие восстановления фуксина. Колонии лактозонегативных микроорганизмов - сальмонелл, шигелл и др. -бесцветны.
К дифференциально-диагностическим средам относятся короткий и развёрнутый пёстрый ряд. Он состоит из сред с углеводами (среды Гисса), МПБ, молока, мясопептонной желатины.
Среды Гисса готовятся на основе пептонной воды, к которой прибавляются химически чистые моно-, ди- или полисахариды (лактоза, сахароза, глюкоза мальтоза, маннит)
Для обнаружения сдвигов рН в результате образования кислот и разложения углевода в среды прибавляют индикатор Андреде-кислый. При более глубоком расщеплении углеводов образуются газообразные продукты (СО2, СН4 и др.), которые улавливаются при помощи поплавков - маленьких пробирочек, опущенных в среду кверху дном. Среды с углеводами могут готовиться и плотными – с добавлением 0,5-1% агар-агара. Тогда газообразование улавливается по образованию пузырьков (разрывов) в столбике среды.
На МПБ, входящем в пёстрый ряд, обнаруживают продукты, образующиеся при расщеплении аминокислот и пептонов (индол, сероводород).
Среда Левина – МПА + лактоза + эозин + метиленовый синий. Колонии бактерий, ферментирующих лактозу окрашиваются в синий цвет. Для дифференцировки сем. Enterobacteriaceae. E.coli –синие, патогенные сальмонеллы и шигеллы – бесцветны.
Среда Плоскирева – МПА + лактоза + нейтральный красный + бриллиантовая зелень + соли желчных кислот. Анализ испражнений на сальмонелл и шилелл. E.coli вырастет через 2-3 дня.
Среда Раппопорта является средой обогащения и дифференциально-диагностической средой. В ее состав входит: МПБ, желчь10%, 2% глюкоза, индикатор (кислый фуксин, обесцвеченный щелочью; в щелочной среде бесцветный, в кислой – красный). Назначение: дл





 Логарифм количества жизнеспособных клеток
Логарифм количества жизнеспособных клеток


