Лекция
ЛЕЙКОЗ КРС.
Лейкоз крупного рогатого скота (ЛКРС, в зарубежном определении энзоотический лейкоз) – контагиозный инфекционный рак крови (гемобластоз) вирусной этиологии. Вирус ЛКРС (ВЛКРС) относится к роду Deltaretrovirus подсемейства Orthoretrovirinae, семейства Retroviridae, которое включает онкогенные, или ретровирусы, РНК-геномные, репродуцирующиеся через ДНК-интермедиат с помощью обратной транскрипции, с альтернативным диморфным существованием в виде зрелых вирусных частиц (межклеточная передача инфекции) или провируса в геномах зараженных гемопоэтических и иных клеток (персистенция, онкогенез и горизонтальная передача инфекции).
Ретровирусы таксономически различаются по видам хозяев и строго видоспецифичны (не отмечено никакой эпидемически значимой естественной полипатогенности), что также может быть обусловлено «сверхспецифичностью» их интимных паразито-хозяинных взаимоотношений с клетками на самом глубоком, генетическом и биохимическом уровне паразитизма. ВЛКРС – экзогенный ретровирус, опасности для человека и животных других видов не представляет, всевозможные спекуляции на этот счет не имеют оснований и не заслуживают серьезного обсуждения [23].
Обратная стратегия генома ВЛКРС и всех ретровирусов как патогенов представляет предел эволюционного совершенства паразитизма с сохранением их биологических видов на уровне только генотипа и полной утратой фенотипических признаков (структура, морфология, размножение). Это объясняет многие особенности патобиоза при лейкозе, прежде всего злокачественное перерождение клетки-хозяина и репродукцию вирусного генома в контексте неограниченной пролиферации лимфоцитов, абсолютную иммунную эвазию в отношении эффекторов противовирусной защиты как врожденного, так и приобретенного иммунитета, внутриклеточную передачу инфекции по эпизоотической цепи.
Передача инфекции.
Цепная трансмиссия и воспроизведение очередного, нового случая заражения при ЛКРС происходит не за счет зрелого вируса; трансмиссибельным инфектом являются инфицированные лимфоциты коров в состоянии персистентной инфекции или лимфоцитоза с интегрированным в их хромосомы вирусным ДНК-интермедиатом, т.е. провирусом (рисунок 1). Внеорганизменным субстратом выделяемого инфекта служат любые жидкости организма с находящимися в них такими лимфоцитами, прежде всего кровь и ее примеси к другим жидкостям, в минимальном объеме которой содержатся многие тысячи клеток, молоко и молозиво, слюна, моча и проч. [18, 20, 24].
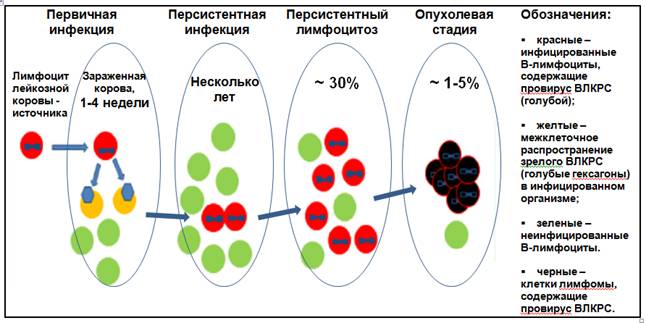
Рисунок 1. Принципиальная схема патогенеза ЛКРС [по 18].
Внутриклеточной передачей обусловливается сравнительная сложность горизонтального и вертикального пути распространения инфекции. Клеточная структурная организация инфекта, внутриклеточная персистенция и трансмиссия полностью исключают некоторые банальные элементы инфекционного патобиоза, в частности, вирусную нейтрализацию антителами, колостральный иммунитет, трансплацентарное заражение.
В то же время вероятность «успешного» заражения предполагает целый ряд нетривиальных условий, прежде всего (i) эффективное проникновение аллогенного лимфоцита-инфекта коровы во внутреннюю среду и циркулирующие системы реципиента, а также (ii) максимальное сохранение целостности крайне неустойчивой во внешней среде эукариотической клетки-инфекта за счет теснейшего контакта между организмом-источником инфекции и восприимчивым организмом.
Первое реализуется вследствие разнообразных непредсказуемых естественных и особенно искусственных повреждений внешних и внутренних покровов животного-реципиента (кожи и слизистых), независимо от продуктивных, физических и иных кондиций, и гематогенной кросс-контаминации его кровотока жидкостями инфицированных животных. Подавляющее большинство случаев перезаражения происходит ятрогенно при многократном использовании инъекционных игл, диагностического, терапевтического, акушерского, хирургического и иного медицинского инструментария, оборудования для искусственного осеменения, обработки копыт, обезроживания, мечения, при вакцинации и иных массовых инвазивных обработках, репродуктивных обследованиях, кастрации и т.п. Сюда относятся также такие факторы, как плодные жидкости и все, что сопутствует родам, кормление молоком и молозивом, открытые травмы, жалящие насекомые, кровь и другие выделения инфицированных животных.
Второе происходит, главным образом, в процессе самых ранних постнатальных отношений «мать↔новорожденный теленок», следствием чего является паравертикальное заражение при прохождении родовых путей и далее через молозиво и слюну. В этом находит объяснение ПЦР-положительное тестирование новорожденных телочек с 15-дневного возраста, инфицированность молодняка КРС, высокий коэффициент паравертикальной передачи (см. ниже и рисунок 7) [2, 3, 7, 8, 25].
Патогенез.
При ЛКРС, как и любом онкологическом заболевании, развитие инфекционного процесса происходит очень длительно, многостадийно с продолжительным инкубационным периодом от нескольких месяцев до нескольких лет.
Прямое проникновение инфекта в кровоток восприимчивого животного-реципиента за счет гематогенной кросс-контаминации не встречает особых препятствий и вероятность такой передачи достаточно высока в крупных группировках КРС, где обеспечивается необходимая популяционная плотность инфицированного и восприимчивого хозяина как первостепенное условие устойчивости данной паразитарной системы. По-видимому, главное при этом – эффективная инфицирующая доза, т.е. количество передаваемых по цепи лимфоцитов, содержащих провирус.
Однако неизвестны конкретные механизмы инвазивности аллогенного лимфоцита-инфекта, проникающего в восприимчивый организм алиментарно. Исходя из канонов инфекционного патогенеза, определенно, что инфект в такой форме не может проследовать через желудок. Так же остаются окончательно не выясненными механизмы реактивации в нем провируса, репродукции и экзоцитоза полноценного ВЛКРС «на новом месте», заражения интактных, преимущественно В-лимфоцитов в циркулирующих системах нового организма и в целом судьбы инфицированных аллогенных клеток в этих условиях. Предположительно критическая роль в этом может принадлежать реакциям клеточного иммунитета животного-реципиента на анти(алло)генность последних, о чем косвенно свидетельствует активация образования полноценного вируса при стимуляции инфицированных клеток некоторыми митогенами [18, 20, 24].
Инкубационный период заболевания протекает в две фазы, отражающие диморфизм существования ВЛКРС. Первичная острая инфекция аллогенных лимфоцитов-инфектов сопровождается репродукцией полноценных вирусных частиц и распространением их в популяции интактных лимфоцитов зараженного животного. Развивающийся вследствие этого клеточный иммунитет последнего в течение нескольких недель прерывает продуктивную инфекцию, осуществляя негативную селекцию лимфоцитов, репродуцирующих полноценный вирус. При этом сохраняются инфицированные лимфоциты с интегрированным провирусом, т.е. злокачественно трансформированные, способные начать неограниченную пролиферацию с моно- или олигоклональной экспансией и тем самым репродукцией инфекта, обеспечивая ему абсолютную иммунную эвазию. Инфекция переходит во вторую фазу со становлением персистенции, в течение которой количество лимфоцитов с провирусом достигает 1% от общего пула циркулирующих В-лимфоцитов, т.е. более 100 тысяч структурных единиц инфекта в мл крови (см. рисунок 1) [18, 20, 24].
В ходе персистентной фазы инкубационного периода развивается гуморальный иммунный ответ на отдельные вирусспецифические антигены – продукты ограниченного и замедленного функционирования вирусного ДНК-интермедиата в составе генома медленно пролиферирующего лимфоцита-хозяина. По этой причине процесс накопления антител достаточно продолжителен: серопозитивность в пределах чувствительности реакции радиальной иммунодиффузии, общепринятой для ее регистрации (стадия РИД-позитивности), возникает через шесть месяцев после заражения и изначально прямо указывает на инфицированность животных.
Клональная пролиферация онкогенно трансформированных лимфоцитов, несущих провирус, гематологически регистрируемая с концентрации > 10000 клеток в мкл крови (стадия ГЕМ-позитивности), развивается только у ~ трети РИД-позитивных. Остальные инфицированные ВЛКРС животные (70% и более) остаются в алейкемическом состоянии в качестве бессимптомных провирусоносителей. Алейкемичные особи могут быть идентифицированы только по наличию провируса с помощью ПЦР и / или антителам к вирусным антигенам [18, 20, 24].
В отличие от транзиторных лейкемоидных реакций при воспалительных процессах, зачастую присутствующих у коров в условиях «не самого лучшего» содержания и эксплуатации (маститы, эндометриты, гнойная патология нижних отделов конечностей) [15], лимфоцитоз при ЛКРС имеет персистентный характер. Стадия ГЕМ-позитивности в обычных зоотехнологических условиях отечественного животноводства с относительно непродолжительной продуктивной жизнью молочных коров (в среднем три лактации) не сопровождается какими-либо регистрируемыми клиническими отклонениями.
Но медленно прогрессирующий, неуклонный рост количества циркулирующих лимфоцитов со значительным превышением физиологических уровней (в исключительных случаях до многих десятков тысяч клеток в мкл крови) теоретически может приводить к драматическим последствиям у более старых животных вследствие нарушений иммунной системы, сходных с таковыми при хорошо изученных вирусных иммунодефицитах классического типа – СПИД'е человека и кошек (недостаточная защита от условно-патогенных микроорганизмов и оппортунистических инфекций, прежде всего маститов, факторных респираторных и кишечных болезней, гнойно-воспалительной патологии) [18, 24].
Конечная опухолевая, летальная стадия с образованием лимфосарком за счет прогрессивного неконтролируемого накопления злокачественно перерожденных поликлональных инфицированных лимфоцитов, увеличением лимфоидных (лимфоузлов, селезенки) и других внутренних органов наступает, как правило, в возрасте не менее восьми лет лишь у 1-5% (см. рисунок 1), т.е. у старых животных (по данным медицинской статистики общеизвестно, что преобладающая подверженность онкологической патологии стереотипна для пожилого возраста) [18].
С точки зрения саморегуляции инфекционной паразитарной системы неблагополучные хозяйственные группировки животных популяционно неоднородны по перечисленным трем стадиям течения ЛКРС в зависимости от их возрастного состава, зоотехнологической структуры, числа лактаций. Установлено, что инфицированность КРС в молочном хозяйстве значительно возрастает, начиная с третьей лактации [17].
Принципиальной особенностью эпизоотического процесса и энзоотичности ЛКРС является уже клинический диморфизм – (i) состояние скрытой инфицированности, абсолютное количественное и хронологическое преобладание инкубационного периода течения, по сути криптической формы инфекции на протяжении всей продуктивной жизни и (ii) собственно болезнь в патологическом смысле, чрезвычайно редкие, спорадические случаи манифестной формы лимфосаркоматоза, возникающие и реально регистрируемые только у старых животных, за пределами продуктивного возраста, что иллюстрируется данными таблицы 1.
Таблица 1.
Таблица 2.
Общая характеристика возможных программ контроля ЛКРС [23].
| Сценарии
| Основополагающие действия
| Преимущества
| Недостатки
|
| «Тестировать и удалить» («test and eliminate»)
| Выявление инфицированных и убой положительно реагирующих
| § Эффективность
§ Минимальные усилия
§ Краткость периода оздоровления
| § Вероятность ущерба в зависимости от уровня превалентности
§ Постоянный надзор
§ Официальная политика компенсации
|
| «Тестировать и изолировать» («test and segregate»
| § Выявление инфицированных и изоляция в отдельные стада («вечный карантин»)
§ Раздельное обслуживание и содержание инфицированных и здоровых
| Не требуется возмещение взамен удаленного скота
| § Помещения для раздельного содержания
§ Затраты на раздельное содержание
§ Постоянный надзор
§ Продолжительность программы оздоровления
|
| «Тестировать и управлять» («test and manage»)
| Меры по биобезопасности и минимизации распространения инфекции
| § Наименьшие затраты
§ Минимальные усилия
§ Не требуется возмещение взамен удаленного скота
| § Трудоемкость
§ Строгое соблюдение необходимых мер
§ Продолжительность программы оздоровления
§ Ограничения для людей и окружения
§ Дополнительная квалификация персонала
|
Текущий глобальный паттерн ситуации по ЛКРС характеризуется практически всесветной регистрацией инфекции (рисунок 2) и представляется следующим образом [22, 24]:
§ в период 1990-2010 гг. заболевание ликвидировано в > 20 странах по всему миру, в числе которых как многие экономически развитые западноевропейские, так и небольшие государства (например, Великобритания, Дания, Испания, Швейцария, Швеция и Андорра, Египет, Кипр, Эстония, декларировалось благополучие Белоруссии, Казахстана и Киргизии). Эффективные программы весьма продолжительны; например, на эрадикацию ЛКРС в Финляндии потребовалось тридцать лет (1966-1996 гг.);
§ в последние годы встречаются единичные случаи ЛКРС в персистентной стадии или в отдельных регионах Австралии, в Мексике, десяти странах Европы (Венгрия, Германия, Италия, Франция, Латвия, Литва и др.);
§ до настоящего времени ЛКРС эндемичен с регистрацией клинических форм заболевания в > 20 странах по всему миру, в числе которых также весь спектр государств (от РФ, США, Канады, Японии, Аргентины до Гондураса, Колумбии, Узбекистана, Украины).

Рисунок 2. Глобальный нозоареал ЛКРС в настоящее время [ WAHIS, 2019].
В странах последней группы, где из ЛКРС не делается проблемы государственной важности и нет программ контроля, в частности, в США и Канаде, неблагополучными являются от 63 до 97% молочных хозяйств с внутристадной превалентностью от 16 до 61% и прогнозируемой исторической тенденцией к дальнейшему росту распространенности [17, 19]. В недавнем специально проведенном широком аналитическом исследовании эпизоотологических особенностей ЛКРС в США на достоверном статистическом материале показано, что в 94,2% хозяйств обнаружена по крайней мере одна серопозитивная корова, средний показатель преваленности составил 46,5% [19]. При этом установлена выраженная продуктивно-возрастная зависимость превалентности от числа лактаций с повышением от 10% в первой лактации до 40% - во второй, 70% - в третьей и далее безотносительно к региону, породе или размеру хозяйства, что формирует так называемый неблагополучный профиль стада. Одновременно эта внутристадная динамика свидетельствует об интенсивном перекрестном инфицировании в ходе эксплуатации лактирующих коров и характеризует процесс как серьезный фактор риска распространения ВЛКРС [24].
В аналогичной ситуации в Китае, Японии неблагополучны от 30 до 50% стад, в Аргентине - до 90% [18, 22, 24].
Отсутствие национальных программ также диктуется соображениями экономики животноводства. Наиболее рентабельная технология молочного производства с быстрым оборотом стада предполагает использование коров в течение двух-трех лактаций, несмотря на то, что продуктивность зараженных особей до клинического периода не отличается от таковой интактных и нередко даже превышает ее, старые коровы, как правило, производят больше молока по сравнению с молодыми, а самыми эффективными являются лактации с пятой по девятую [13, 14, 17].
Ввиду короткого лактационного периода даже ГЕМ-позитивные животные не доживают до клинической, опухолевой стадии, а потенциальные потери в производстве молока и снижении продуктивного долголетия, связанные с субклиническими нарушениями иммунитета, не имеют значения. Отношение к ЛКРС в США иллюстрируется данными анкетирования производителей молока, согласно которым 50% из них не видят проблемности, 40% считают проблему несущественной, и только 10% ЛКРС принимается во внимание [17].
Эпизоотический надзор за лейкозом в странах третьей группы предполагает выявление серопозитивных животных (исследование молока с помощью ИФА) и различные общепринятые меры по минимизации их способности к передаче инфекции (см. таблицу 2). Выбраковке подлежат не серопозитивные (инфицированные), а только действительно больные особи в онкологической стадии болезни, если таковые встречаются [17, 24].
В подобных условиях, с учетом зарубежных тенденций и опыта контроля ЛКРС без чрезмерной и безальтернативной выбраковки, возникла необходимость разрабатывать новые подходы и способы минимизации паравертикальной и горизонтальной трансмиссии инфекции внутри стада с сохранением высокопродуктивных, генетически ценных и т.п. инфицированных, но алейкемичных особей. Для этого предложен принцип оценки их индивидуальной провирусной нагрузки (ПВН, proviral load), который основан на различном содержании инфекционного начала в лимфоцитах. По имеющимся данным, титр провируса ВЛКРС в крови серопозитивных коров колеблется в диапазоне от 30 до 48826 х 104 копий на мкл, т.е. амплитуда индивидуальных различий - более 1600 раз [24], или, в другом измерении от 2 до более 2000 копий на 50 нг геномной ДНК [21]. Это позволяет распределить животных в этом диапазоне показателей на три группы опасности по содержанию копий провируса в мкл крови на уровне (i) десятков (очень низкая ПВН, контактной передачи инфекции не происходит), (ii) тысяч (низкая ПВН, передача инфекции непостоянна) и (iii) десятков тысяч (высокая ПВН у опасных супер-носителей), чего невозможно сделать серологическими тестами. В прямых достоверных экспериментах подтверждено, что при совместном содержании 20 инфицированных коров первой группы, имеющих очень низкую ПВН, с группой из более 100 интактных коров передачи ЛКРС не происходило в течение 30 месяцев наблюдения. Аналогичные результаты получены при тестировании инфицированных быков. Преимуществом данного подхода, основанного на применении ПЦР, особенно эффективном в количественном варианте (real-time), является возможность выявлять инфекцию задолго до обнаружения РИД-позитивности (несколько недель и месяцев) и независимо от присутствия материнских антител [7, 8, 21, 24, 25].
Новый подход в ближайшей перспективе может существенно изменить жесткие программы контроля ЛКРС в сторону их либерализации: идентификация с помощью ПЦР инфицированных алейкемичных, в том числе серопозитивных животных, не являющихся источником инфекции, позволяет исключить преждевременную выбраковку, сохранить их продуктивность, сократить излишние потери.
Лейкоз КРС в РФ.
Лейкоз вероятно стали обнаруживать еще в довоенном периоде с началом процесса метизации местного скота с чистопородными животными [4], а также в дальнейшем в связи с поступлением КРС в ходе репараций после ВОВ. Беспрецедентное повсеместное распространение в 1950-60-х гг. ЛКРС получил в связи с многообещающей, но не продуманной как следует национальной программой так называемой тотальной голштинизации (опять же по аналогии с индустриализацией животноводства и созданием комплексов в 1960-х гг. или современной нацпрограммой по поставкам импортного племенного скота, не приспособленного к местным условиям зоотехнологии).
ЛКРС, бывший в начале естественной истории в нашей стране прерогативой не эпизоотологов и инфекционистов, а гематологов и патологоанатомов, тем не менее занял беспрецедентное место в отечественной ветеринарной науке и практике. Об этом свидетельствуют бурный всплеск деятельности по всей территории СССР - более полутысячи диссертаций на исходных этапах (рисунки 3, 4) и свыше полутора тысяч публикаций в базе данных РИНЦ уже в новом веке, в среднем 80 публикаций ежегодно [eLIBRARY]. Сейчас не представляется интересным и просто невозможно разобраться в таком невиданном по объему массиве информации, хотя очевидно, что подавляющее ее большинство с современных позиций – от фиксации локальной эпизоотологии до шарлатанства со всевозможными способами лечения рака крови с претензиями на лейкоз человека. Положительным итогом можно считать только освоение известной в принципе по зарубежным публикациям гематологической и серологической диагностики и ее повсеместное внедрение [1, 9, 12], что при инфекции с таким патогенетическим стереотипом не представляет особенностей – это симптоматология и обязательный иммунный (антительный) ответ при продолжительном течении любого инфекционного процесса.
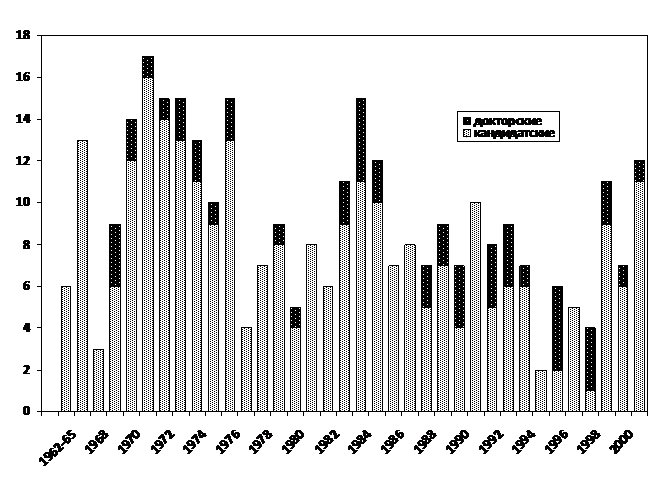
Рисунок 3. Число диссертаций по лейкозу КРС к началу 21 в.



Рисунок 4. Поголовье КРС в стране и число кандидатских и докторских диссертаций по лейкозу КРС в 1990-начале 2000 гг. (данные комасштабированы). Очевидна обратная зависимость трендов в животноводстве и науке.
В конечном итоге на текущий период в инфекционном профиле страны ЛКРС занимает первое место (более 60%) – до 70 неблагополучных субъектов федерации, миллионы инфицированных голов (до трети национального поголовья скота) и десятки тысяч новых случаев ежегодно, тысячи неблагополучных пунктов, сотни новых неблагополучных пунктов из года в год и удручающие тренды [5, 10]. Статистическая характеристика эпизоотической обстановки по данным презентации Департамента ветеринарии Минсельхоза России на Международном ветеринарном конгрессе (Калининград, 2019 г.) представлена в таблице 3 и на рисунке 5 [11].
Таблица 3.
24 767
2 064
| |
|
2 863
239
12
| |
|
| Выявлено инфицированных гол. всего,
в среднем ежегодно
| 384 200
32 000
| |

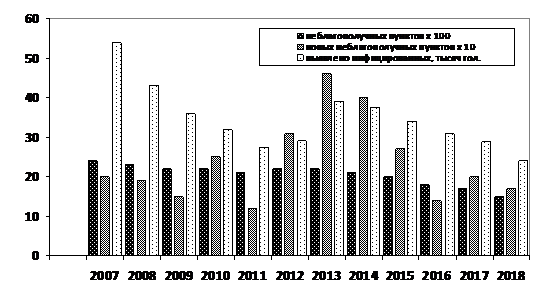
Рисунок 5. Графические показатели и общий линейный тренд интенсивности распространения ЛКРС в РФ в 2007-2018 гг. (данные комасштабированы).
Реальная клинически выраженная форма заболевания как таковая практически не регистрируется, скот в товарных хозяйствах в связи с коротким сроком продуктивной жизни до опухолевой стадии не доживает, поэтому прямого ущерба от ЛКРС нет. Даже персистентный лейкоцитоз в ГЕМ-позитивной стадии инфекции на протяжении нескольких лет вреда здоровью не наносит – многочисленные декларативные публикации по биохимии, гематологии, патогенетике, иммунодефицитам, оппортунистическим инфекциям и т.п. субклиническим явлениям не содержат контролируемых эпизоотологических, клинических и иных доказательств. В огромном массиве доступных публикаций по ЛКРС, как упомянуто выше, результатов стандартных для таких целей рандоминизированных сравнительных аналитических эпизоотологических исследований типа случай контроль или когортного исследования нет.
В обычных условиях существования у животных развиваются так называемые лейкемоидные реакции [15] на любой воспалительный процесс (что лежит в основе диагностической лейкоформулы), не говоря уже о РИД-позитивности, стадии, которая начинается с шестимесячного возраста. Все заявления в литературе относительно снижения молочной продуктивности бездоказательны, чисто умозрительны и «выдают желаемое за действительное». Реальный ущерб от инфекции с точки зрения ветеринарии сводится разве что к расходам на РИД-диагностику, применяемую в многомиллионном масштабе по всей стране (таблица 4).
Таблица 4.
Годы
Исследования
| | РИД
| Гематология
| ПЦР
|
| 2016
| 14 952 837
| 2 301 927
| 6 525
|
| 2017
| 15 679 325
| 2 301 927
| 8 958
|
| 2018
| 16 131 361
| 2 005 219
| 16 071
|
Вместе с тем существенные потери несут (i) племенные хозяйства с потерей генофонда из-за всевозможных ограничений в продаже скота и (ii) товарные хозяйства молочного направления из-за преждевременной выбраковки высокопродуктивных животных (а именно они наиболее восприимчивы к ЛКРС), на что идут крупные специальные дотации из субъектовых бюджетов, по сути стимулирующие «вырезание» скота. Эпизоотическая динамика лейкоза (см. рисунок 4) дает основания полагать, что во втором случае дотационная программа, рассчитанная на ближайшие годы, окажется бесполезной тратой денег, т.к. «вырезание» скота встречает у рядовых животноводов ожесточенное неприятие (сокрытие, перестановка, ремаркирование животных и т.п. «партизанские» приемы, известные по борьбе с АЧС).
Объективная реальность приводит к выводу, что в условиях отечественного животноводства (молочного) ЛКРС в абсолютно преобладающей алейкемической (РИД-позитивной) форме и даже при персистентном лимфоцитозе (ГЕМ-позитивность) не является инфекцией, наносящей какой-либо прямой ущерб. Согласно весьма серьезным эпизоотологическим данным из США и Канады (см. выше) потери всего по двум параметрам - некоторое снижение молочной продуктивности и продолжительности жизни лейкозных коров наблюдаются только на уровне 8-10 лактаций, т.е. в возрасте 10-12 лет. В повсеместной отечественной зоотехнологии коровы больше пяти, максимум шести лет не живут, т.е. попросту не доживают до патологического состояния (3-4 лактации, а то и меньше, особенно импортируемый скот). Это аксиома, элементарная логика ветеринарной медицины.
Следует также признать, что действующая система противолейкозных мероприятий объективно не может быть в этой связи эффективной и всячески отторгается «снизу». Серологический (РИД) и гематологический (лимфоцитоз) тесты, используемые сейчас согласно утвержденным НТД для идентификации животных, подлежащих ликвидации, крайне не удовлетворительны по чувствительности, т.к. выявляют двух из трех или одного из пяти действительно инфицированных соответственно (см. ниже), т.е. за пределами тестирования остается значительное количество ложно-отрицательных результатов, и с их помощью быстро искоренить лейкоз невозможно по определению.
Полное искоренение ЛКРС в настоящей ситуации по всей стране, ориентированное исключительно на выбраковку положительно реагирующих животных, вряд ли возможно и целесообразно. Как показано в таблице 2, существуют иные сценарии контроля.
Заключение.
Сама по себе ретроспективная сущность системы РИД, недостаточная чувствительность положенной в ее основу эпизоотологической диагностики, значительно «отложенный» эффект, вероятно, даже теоретически не позволяют предположить полное оздоровление стада таким путем. Весьма продолжительный «шлейф» инфицированных животных, регистрируемый повсеместно (см. рисунок 6), прямо указывает на продолжающееся реинфицирование (или рециркуляцию возбудителя), в котором единственно возможным источником являются РИД-ложно-отрицательные особи. С учетом возможности провирусного состояния возбудителя этот процесс может быть бесконечным, т.е. в реальных условиях в РИД-оздоровленном стаде будут периодически выявляться единицы инфицированных (за счет как горизонтального реинфицирования, так и вертикального, у так называемых «внучек»).
Однако изложенные соображения, зарубежные данные и международный опыт вносят определенный оптимизм и свидетельствуют, что эпизоотологические перспективы лейкоза крупного рогатого скота не столь безутешны. Переход от эпизоотологически пассивной ретроспективной диагностики с полугодовым «отложенным» эффектом как основной причины несвоевременного и неполного выявления инфицированных животных к прямому быстрому обнаружению возбудителя (в состоянии провируса) с помощью ПЦР-тестирования, уже достаточно испытанному на полевом материале и апробированному практикой, является единственно реальным направлением для эффективного оздоровления стад КРС от лейкоза и предупреждения распространения инфекции. Чрезвычайно важно, что ПЦР применима для обследования молодняка как самой критической группы риска, начиная с 15-дневного возраста. Своевременный вывод из оборота инфицированных телочек и их дальнейшее использование по различным сценариям (см. таблицу 2) позволяет минимизировать потери, быстро ликвидировать неблагополучие и обезопасить стадо (ферму) от возникновения случаев лейкоза КРС.
Лекция
ЛЕЙКОЗ КРС.
Лейкоз крупного рогатого скота (ЛКРС, в зарубежном определении энзоотический лейкоз) – контагиозный инфекционный рак крови (гемобластоз) вирусной этиологии. Вирус ЛКРС (ВЛКРС) относится к роду Deltaretrovirus подсемейства Orthoretrovirinae, семейства Retroviridae, которое включает онкогенные, или ретровирусы, РНК-геномные, репродуцирующиеся через ДНК-интермедиат с помощью обратной транскрипции, с альтернативным диморфным существованием в виде зрелых вирусных частиц (межклеточная передача инфекции) или провируса в геномах зараженных гемопоэтических и иных клеток (персистенция, онкогенез и горизонтальная передача инфекции).
Ретровирусы таксономически различаются по видам хозяев и строго видоспецифичны (не отмечено никакой эпидемически значимой естественной полипатогенности), что также может быть обусловлено «сверхспецифичностью» их интимных паразито-хозяинных взаимоотношений с клетками на самом глубоком, генетическом и биохимическом уровне паразитизма. ВЛКРС – экзогенный ретровирус, опасности для человека и животных других видов не представляет, всевозможные спекуляции на этот счет не имеют оснований и не заслуживают серьезного обсуждения [23].
Обратная стратегия генома ВЛКРС и всех ретровирусов как патогенов представляет предел эволюционного совершенства паразитизма с сохранением их биологических видов на уровне только генотипа и полной утратой фенотипических признаков (структура, морфология, размножение). Это объясняет многие особенности патобиоза при лейкозе, прежде всего злокачественное перерождение клетки-хозяина и репродукцию вирусного генома в контексте неограниченной пролиферации лимфоцитов, абсолютную иммунную эвазию в отношении эффекторов противовирусной защиты как врожденного, так и приобретенного иммунитета, внутриклеточную передачу инфекции по эпизоотической цепи.
Передача инфекции.
Цепная трансмиссия и воспроизведение очередного, нового случая заражения при ЛКРС происходит не за счет зрелого вируса; трансмиссибельным инфектом являются инфицированные лимфоциты коров в состоянии персистентной инфекции или лимфоцитоза с интегрированным в их хромосомы вирусным ДНК-интермедиатом, т.е. провирусом (рисунок 1). Внеорганизменным субстратом выделяемого инфекта служат любые жидкости организма с находящимися в них такими лимфоцитами, прежде всего кровь и ее примеси к другим жидкостям, в минимальном объеме которой содержатся многие тысячи клеток, молоко и молозиво, слюна, моча и проч. [18, 20, 24].

Рисунок 1. Принципиальная схема патогенеза ЛКРС [по 18].
Внутриклеточной передачей обусловливается сравнительная сложность горизонтального и вертикального пути распространения инфекции. Клеточная структурная организация инфекта, внутриклеточная персистенция и трансмиссия полностью исключают некоторые банальные элементы инфекционного патобиоза, в частности, вирусную нейтрализацию антителами, колостральный иммунитет, трансплацентарное заражение.
В то же время вероятность «успешного» заражения предполагает целый ряд нетривиальных условий, прежде всего (i) эффективное проникновение аллогенного лимфоцита-инфекта коровы во внутреннюю среду и циркулирующие системы реципиента, а также (ii) максимальное сохранение целостности крайне неустойчивой во внешней среде эукариотической клетки-инфекта за счет теснейшего контакта между организмом-источником инфекции и восприимчивым организмом.
Первое реализуется вследствие разнообразных непредсказуемых естественных и особенно искусственных повреждений внешних и внутренних покровов животного-реципиента (кожи и слизистых), независимо от продуктивных, физических и иных кондиций, и гематогенной кросс-контаминации его кровотока жидкостями инфицированных животных. Подавляющее большинство случаев перезаражения происходит ятрогенно при многократном использовании инъекционных игл, диагностического, терапевтического, акушерского, хирургического и иного медицинского инструментария, оборудования для искусственного осеменения, обработки копыт, обезроживания, мечения, при вакцинации и иных массовых инвазивных обработках, репродуктивных обследованиях, кастрации и т.п. Сюда относятся также такие факторы, как плодные жидкости и все, что сопутствует родам, кормление молоком и молозивом, открытые травмы, жалящие насекомые, кровь и другие выделения инфицированных животных.
Второе происходит, главным образом, в процессе самых ранних постнатальных отношений «мать↔новорожденный теленок», следствием чего является паравертикальное заражение при прохождении родовых путей и далее через молозиво и слюну. В этом находит объяснение ПЦР-положительное тестирование новорожденных телочек с 15-дневного возраста, инфицированность молодняка КРС, высокий коэффициент паравертикальной передачи (см. ниже и рисунок 7) [2, 3, 7, 8, 25].
Патогенез.
При ЛКРС, как и любом онкологическом заболевании, развитие инфекционного процесса происходит очень длительно, многостадийно с продолжительным инкубационным периодом от нескольких месяцев до нескольких лет.
Прямое проникновение инфекта в кровоток восприимчивого животного-реципиента за счет гематогенной кросс-контаминации не встречает особых препятствий и вероятность такой передачи достаточно высока в крупных группировках КРС, где обеспечивается необходимая популяционная плотность инфицированного и восприимчивого хозяина как первостепенное условие устойчивости данной паразитарной системы. По-видимому, главное при этом – эффективная инфицирующая доза, т.е. количество передаваемых по цепи лимфоцитов, содержащих провирус.
Однако неизвестны конкретные механизмы инвазивности аллогенного лимфоцита-инфекта, проникающего в восприимчивый организм алиментарно. Исходя из канонов инфекционного патогенеза, определенно, что инфект в такой форме не может проследовать через желудок. Так же остаются окончательно не выясненными механизмы реактивации в нем провируса, репродукции и экзоцитоза полноценного ВЛКРС «на новом месте», заражения интактных, преимущественно В-лимфоцитов в циркулирующих системах нового организма и в целом судьбы инфицированных аллогенных клеток в этих условиях. Предположительно критическая роль в этом может принадлежать реакциям клеточного иммунитета животного-реципиента на анти(алло)генность последних, о чем косвенно свидетельствует активация образования полноценного вируса при стимуляции инфицированных клеток некоторыми митогенами [18, 20, 24].
Инкубационный период заболевания протекает в две фазы, отражающие диморфизм существования ВЛКРС. Первичная острая инфекция аллогенных лимфоцитов-инфектов сопровождается репродукц













