Растворами называются молекулярно-дисперсные и ионно-дисперсные гомогенные системы, состоящие из двух и более химически индивидуальных веществ.
Концентрацией раствора называется количество растворенного вещества, содержащееся в единице массы или единице объема раствора.
Пример 1. Вычислите: а) массовую долю растворенного вещества (%); б) молярную концентрацию вещества (СМ, М); в) молярную концентрацию эквивалентов вещества (Сн); г) моляльность вещества в растворе (Сm), который получен растворением 60 г карбоната калия в 250 мл воды (плотность раствора r = 1190 кг/м3 = 1,19 г/см3 = 1,19 г/мл). Чему равен титр (Т) этого раствора?
Решение. а) массовая доля (w) показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или в процентах.
Так как массу 250 мл воды можно принять равной 250 г (r  =1г/мл), то масса полученного раствора равна: 60 + 250 = 310 г и, следовательно:
=1г/мл), то масса полученного раствора равна: 60 + 250 = 310 г и, следовательно:
в 310 г раствора содержится 60 г К2СО3
в 100 г раствора содержится х г К2СО3

Таким образом, массовая доля К2СО3 равна 19,35 % (w  =19,35%).
=19,35%).
б) молярная концентрация вещества – отношение количества растворенного вещества (в молях) к объему раствора. Единица измерения молярной концентрации моль/л.
Для расчета молярной концентрации карбоната калия необходимо найти массу 1 л раствора: 
Массу карбоната калия (m) в 1 л раствора находим из соотношения:
в 310 г раствора содержится 60 г К2СО3
в 1190 г раствора содержится m г К2СО3
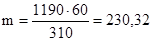 г К2СО3
г К2СО3
Число молей соли, содержащихся в 1 л раствора равно отношению:  , где
, где  .
.
Следовательно, 
Молярная концентрация карбоната калия  (1,67М)
(1,67М)
в) молярная концентрация эквивалентов (нормальная концентрация) – отношение количества эквивалентов растворенного вещества (в молях эквивалентов) к объему раствора. Единица измерения моль/л.
Молярная масса эквивалента кислоты равна отношению ее молярной массы к основности. Например: 
Молярная масса эквивалента основания равна отношению ее молярной массы к кислотности. Например: 
Молярная масса эквивалента соли равна отношению ее молярной массы к произведению числа атомов металла на валентность металла. Например:

Так как молярная масса эквивалента карбоната калия равна:  то число молей эквивалентов К2СО3, содержащихся в 1 л раствора равно отношению:
то число молей эквивалентов К2СО3, содержащихся в 1 л раствора равно отношению:
 молей эквивалентов.
молей эквивалентов.
Молярная концентрация эквивалентов карбоната калия  (3,34 н.)
(3,34 н.)
г) моляльность вещества в растворе – отношение количества растворенного вещества (в молях) к массе растворителя. Единица измерения моляльности вещества в растворе моль/кг.
Масса раствора складывается из суммы масс растворенного вещества и растворителя: mр-ра = mв-ва + mр-ля.
По условию задачи масса растворителя (воды) равна 250 г. Массу карбоната калия в 1000 г растворителя находим из соотношения:
на 250 г растворителя приходится 60 г К2СО3
на 1000 г растворителя приходится m г К2СО3
Отсюда,  г К2СО3.
г К2СО3.
Число молей соли, содержащихся в 1000 г (1 кг) растворителя равно отношению: 
Моляльность карбоната калия в растворе Сm = 1,74 моль/кг
Титр раствора (Т) показывает количество граммов растворенного вещества, содержащегося в 1 мл (1 см3) раствора.
Так как в 1 л раствора карбоната калия содержится 230,32 г К2СО3, то 
Пример 2. На нейтрализацию 20 мл раствора гидроксида калия, содержащего 0,4 г КOH, израсходовано 42 мл кислоты. Вычислите молярную концентрацию эквивалентов кислоты в растворе.
Решение. Согласно закону эквивалентов вещества взаимодействуют между собой в эквивалентных количествах, следовательно,
 или
или 
Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их молярным концентрациям эквивалентов.
Рассчитываем молярную концентрацию эквивалентов гидроксида калия:
в 0,02 л раствора содержится 0,4 г КOH
в 1 л раствора содержится m г КOH

Число молей эквивалентов гидроксида калия, содержащихся в 1 л раствора, равно  молей эквивалентов, где 56 г/моль – молярная масса эквивалента гидроксида калия.
молей эквивалентов, где 56 г/моль – молярная масса эквивалента гидроксида калия.
Следовательно, молярная концентрация эквивалентов гидроксида калия Сн(КOH) = 0,36 моль/л.
На основании зависимости между объемами растворов реагирующих веществ и их молярными концентрациями эквивалентов рассчитываем молярную концентрацию эквивалентов кислоты:  ; отсюда
; отсюда
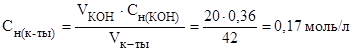 (0,17н.)
(0,17н.)
Пример 3. К 1 л раствора серной кислоты с массовой долей Н2SO4 12% (плотность 1,083 г/см3) прибавили 0,5 л раствора той же кислоты с массовой долей Н2SO4 8 % (плотность 1,055 г/см3).Объем смеси довели до 2 л. Вычислите молярную концентрацию серной кислоты в полученном растворе.
Решение. Масса 1 л раствора серной кислоты с массовой долей Н2SO4 12 % равна: 
В этом растворе содержится  г Н2SO4.
г Н2SO4.
Масса 0,5 л раствора серной кислоты с массовой долей Н2SO4 8 % равна:  В этом растворе содержится
В этом растворе содержится  г Н2SO4.
г Н2SO4.
По условию задачи объем смеси довели до 2 литров, следовательно, в общем объеме полученного раствора (2 л) масса H2SO4 составляет
129,96 + 42,2 = 172,16 г.
Таким образом, в 1 л раствора содержится:  г Н2SO4. Рассчитаем число молей серной кислоты, содержащихся в 1 л раствора:
г Н2SO4. Рассчитаем число молей серной кислоты, содержащихся в 1 л раствора:
 молей, где 98 г/моль – молярная масса H2SO4.
молей, где 98 г/моль – молярная масса H2SO4.
Следовательно, молярная концентрация серной кислоты в полученном растворе СМ = 0,88 моль/л (0,88М).
Пример 4. Какой объем хлороводородной кислоты с массовой долей HCl 36 % (r = 1,183 г/см3 = 1,183 г/мл) потребуется для приготовления 2,5л 0,5н. раствора этой кислоты?
Решение. Молярная масса эквивалента хлороводородной кислоты
 =
=  г/моль. Масса HCl, необходимая для приготовления 2 л 0,5н. раствора хлороводородной кислоты равна:
г/моль. Масса HCl, необходимая для приготовления 2 л 0,5н. раствора хлороводородной кислоты равна:

Находим, в каком количестве раствора хлороводородной кислоты с массовой долей 36 % содержится 45,63 г HCl:
в 100 г 36% - го раствора содержится 36 г HCl
в m г 36% - го раствора содержится 45,63 г HCl
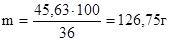
Следовательно, объем раствора хлороводородной кислоты с массовой долей HCl 36 % равен: 
ЗАДАНИЯ
141. Вычислите молярную концентрацию, молярную концентрацию эквивалентов и титр раствора хлорида кальция с массовой долей СаCl2 20%, плотность раствора 1,178 г/см3.
142. Вычислите молярную концентрацию, молярную концентрацию эквивалентов, моляльность и титр раствора щелочи с массовой долей NaOH 30%. Плотность раствора щелочи 1,328 г/см3.
143. К 3 л раствора азотной кислоты (r = 1,054 г/см3) с массовой долей HNO3 10% прибавили 5 л раствора той же кислоты (r = 1,009 г/см3) с массовой долей HNO3 2%. Вычислите молярную концентрацию полученного раствора и массовую долю (%) HNO3 в этом растворе.
144. Вычислите молярную концентрацию, молярную концентрацию эквивалентов, моляльность и титр раствора азотной кислоты
(r = 1,120 г/см3) с массовой долей HNO3 20,8%.
145.Вычислите молярную концентрацию, молярную концентрацию эквивалентов, моляльность и титр раствора хлорида алюминия
(r=1,149 г/см3) с массовой долей AlCl3 16%.
146.Сколько и какого вещества останется в избытке, если к 7 мл 0,3н. раствора серной кислоты прибавить 125 мл 0,2н. раствора гидроксида калия.
147. Для осаждения в виде хлорида серебра всего серебра, содержащегося в 100 мл раствора нитрата серебра потребовалось 50 мл 0,2 н. раствора хлороводородной кислоты. Вычислите молярную концентрацию эквивалентов и титр раствора нитрата серебра.
148.Какой объем раствора хлороводородной кислоты (r=1,100 г/см3)
с массовой долей HCl 20,01% требуется для приготовления 1 л раствора
(r = 1,050 г/см3) с массовой долей HCl 10,17%?
149. Смешали 10 мл раствора азотной кислоты (r = 1,056 г/см3) с массовой долей HNO3 10% и 100 мл раствора той же кислоты
(r =1,184 г/см3) с массовой долей HNO3 30%. Вычислите молярную концентрацию и массовую долю (%) HNO3 в полученном растворе.
150.Какой объем раствора гидроксида калия (r = 1,056 г/см3) с массовой долей КОН 50% требуется для приготовления 3 л раствора
(r=1,048 г/см3) с массовой долей КОН6%?
151. Какой объем раствора карбоната натрия (r = 1,105 г/см3) с массовой долей Na2CО3 10% требуется для приготовления 5л раствора (r=1,020г/см3) с массовой долей Na2CО3 2%?
152.На нейтрализацию 31мл 0,16н. раствора щелочи требуется 217мл раствора серной кислоты. Вычислите молярную концентрацию эквивалентов и титр раствора серной кислоты.
153. Какой объем 0,3н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 мл раствора гидроксида натрия.
154. На нейтрализацию 1 л раствора, содержащего 1,4 г гидроксида калия, требуется 50 мл раствора кислоты. Вычислите молярную концентрацию эквивалентов кислоты.
155. Вычислите молярную концентрацию, молярную концентрацию эквивалентов, моляльность и титр раствора хлорида натрия
(r = 1,148 г/см3) с массовой долей NaCl 20%?
156. Вычислите молярную концентрацию, молярную концентрацию эквивалентов, моляльность и титр раствора серной кислоты
(r = 1,040 г/cм3), в 200 мл которого содержится 9 г Н2SО4.
157. Вычислите молярную концентрацию, молярную концентрацию эквивалентов, моляльность и титр раствора азотной кислоты
(r = 1,054 г/см3) с массовой долей HNO3 10%.
158. Какой объем раствора азотной кислоты (r = 1,367 г/см3) с массовой долей HNO3 60% требуется для приготовления 0,5 л раствора той же кислоты (r = 1,054 г/см3) с массовой долей HNO3 10%?
159. Смешали 50 мл раствора серной кислоты (r = 1,098 г/см3) с массовой долей Н2SО4 14% и 100 мл раствора той же кислоты
(r = 1,224 г/см3) с массовой долей Н2SО4 30%. Вычислите молярную концентрацию и массовую долю (%) Н2SО4 в полученном растворе.
160. Смешали 25 мл раствора хлорида натрия (r = 1,029 г/см3) с массовой долей NaCl 4% и 225 мл раствора той же соли (r = 1,151 г/см3) с массовой долей NaCl 20%. Вычислите молярную концентрацию и массовую долю (%) NaCl в полученном растворе.
Общие свойства растворов
К общим свойствам растворов относятся понижение давления насыщенного пара растворителя над раствором, понижение температуры замерзания, повышение температуры кипения и осмотическое давление.
Исследование свойств разбавленных растворов показало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном объеме данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля.
В общем виде зависимость повышения температуры кипения Dtкип. и понижения температуры замерзания Dtзам. разбавленных растворов от концентрации можно записать так:
Dtкип = Кэ×Сm и Dtзам = Кк×Сm,
где Кэ и Кк – эбулиоскопическая и криоскопическая постоянные растворителя (°С × кг × моль-1 или К × кг × моль-1).
Сm – моляльность вещества в растворе (моль/кг)
В этих уравнениях моляльную концентрацию можно заменить отношением массы растворенного вещества в 1000 г растворителя (m) к молярной массе этого вещества (М). Тогда 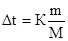
По этой формуле можно рассчитать молярную массу растворенного вещества.
Пример 1. Вычислите температуры кристаллизации и кипения водного раствора глюкозы с массовой долей С6Н12О6 2 %.
Решение. По закону Рауля:  или
или  (1)
(1)
и  или
или  (2)
(2)
Для воды Кк = 1,86 и Кэ = 0,52
Молярная масса глюкозы 
Исходя из понятия массовой доли растворенного вещества, выраженной в процентах: в 100 г раствора содержится 2 г глюкозы. Следовательно, масса растворителя будет равна: 100-2=98 г.
Найдем массу растворенного вещества в 1000 г растворителя (воды):
в 98 г воды содержится 2 г глюкозы
в 1000 г воды содержится m г глюкозы

Следовательно, понижение температуры замерзания раствора по формуле (1): 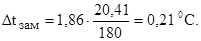
Так как  , то температура замерзания (кристаллизации) раствора равна:
, то температура замерзания (кристаллизации) раствора равна:
 , где 0 °С - температура замерзания воды.
, где 0 °С - температура замерзания воды.
Повышение температуры кипения раствора равно по формуле (2): 
Вода кипит при 100 °С, следовательно, температура кипения этого раствора равна: 
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529 0С. Температура кипения сероуглерода 46,3 0С. Вычислите эбулиоскопическую константу сероуглерода.
Решение. По закону Рауля:  (2),
(2),
где Dtкип – повышение температуры кипения раствора равно:

Молярная масса бензойной кислоты 
Найдем массу растворенного вещества в 1000 г растворителя:
в 100 г сероуглерода содержится 1,22 г бензойной кислоты
в 1000 г сероуглерода содержится m г бензойной кислоты

Из формулы (2) находим эбулиоскопическую константу:
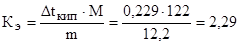
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при t  = –0,279 0С. Вычислите молярную массу глицерина.
= –0,279 0С. Вычислите молярную массу глицерина.
Решение. Из формулы (1) находим молярную массу: 
Температура кристаллизации чистой воды 0 °С, следовательно, понижение температуры кристаллизации (замерзания) равно:
Dt  = 0 – (-0,279) = 0,279 °С
= 0 – (-0,279) = 0,279 °С
Криоскопическая константа для воды Кк = 1,86. Массу глицерина (m), приходящуюся на 1000 г воды найдем из пропорции:
в 800 г Н2О содержится 11,04 г глицерина
в 1000 г Н2О содержится m г глицерина

Подставляя в уравнение числовые значения Кк, m и Dt  , находим молярную массу глицерина:
, находим молярную массу глицерина:

Пример 4. Вычислите массовую долю (в процентах) мочевины (NH2)2CO в водном растворе, зная, что раствор замерзает при температуре
tзам. раствора = –0,465 0С.
Решение. Температура замерзания чистой воды 00С, следовательно,
Dt  = 0 – (-0,465) = 0,465°С. Зная, что молярная масса мочевины
= 0 – (-0,465) = 0,465°С. Зная, что молярная масса мочевины 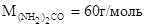 , находим массу m (г) растворенного вещества в 1000 г воды, из формулы (1):
, находим массу m (г) растворенного вещества в 1000 г воды, из формулы (1):

Общая масса раствора равна сумме масс растворенного вещества и растворителя: mраствора = 1000 + 15 = 1015 г.
Массовую долю мочевины в данном растворе находим из соотношения:
в 1015 г раствора содержится 15 г мочевины
в 100 г раствора содержится х г мочевины

Массовая доля мочевины в водном растворе составляет 1,48 %.
ЗАДАНИЯ
161. Раствор, содержащий 0,512 г вещества в 100 г бензола, кристаллизуется при 5,296 0С. Температура кристаллизации бензола 5,5 0С. Криоскопическая константа 5,1. Вычислите молярную массу растворенного вещества.
162. Вычислите массовую долю (в процентах) сахара С12Н22О11 в водном растворе, зная температуру кристаллизации этого раствора
t  = -0,93 0С. Криоскопическая константа воды 1,86.
= -0,93 0С. Криоскопическая константа воды 1,86.
163. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды равна 1,86.
164. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,714 0С. Температура кипения бензола 80,2 0С. Вычислите эбулиоскопическую константу бензола.
165.Вычислите массовую долю (в процентах) глицерина С3Н5(ОН)3 в водном растворе, зная, что этот раствор кипит при 100,39 0С. Эбулиоскопическая константа воды 0,52.
166. Вычислите молярную массу вещества, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при
t  = – 0,279 0С. Криоскопическая константа воды 1,86.
= – 0,279 0С. Криоскопическая константа воды 1,86.
167. Вычислите температуру кипения раствора нафталина С10Н8 в бензоле с массовой долей С10Н8 5 %. Температура кипения бензола 80,2 °С. Эбулиоскопическая константа бензола равна 2,57.
168. Раствор, содержащий 25,65 г некоторого вещества в 300 г воды, кристаллизуется при t  = – 0,465 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
= – 0,465 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
169. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 3,56 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718 0С. Температура кристаллизации уксусной кислоты 16,65 0С.
170. Равные массовые количества камфоры С10Н16О и нафталина С10Н8 растворены в одинаковых количествах бензола. Какой из этих растворов кипит при более высокой температуре?
171. Температура кристаллизации раствора, содержащего 66,3 г некоторого вещества в 500 г воды, равна t  = –0,558 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
= –0,558 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
172. Сколько граммов анилина С6Н5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53 0С. Эбулиоскопическая константа этилового эфира 2,12.
173. Вычислите температуру кристаллизации водного раствора этилового спирта с массовой долей С2Н5ОН 2 %. Криоскопическая константа воды 1,86.
174. Сколько граммов мочевины (NH2)2CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,4650С? Криоскопическая константа воды 1,86.
175. Вычислите массовую долю (в процентах) глюкозы С6Н12О6 в водном растворе, зная, что этот раствор кипит при 100,26 0С. Эбулиоскопическая константа воды 0,52.
176. Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7 0С? Криоскопическая константа бензола 5,1.
177.Сколько граммов мочевины (NH2)2CO следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26 0С? Эбулиоскопическая константа воды 0,52.
178. При растворении 2,3 г некоторого вещества в 125 г воды температура кристаллизации понижается на 0,372 0С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86.
179. Вычислите температуру кипения водного раствора пропилового спирта с массовой долей С3Н7ОН 15 %. Эбулиоскопическая константа воды 0,52.
180. Вычислите массовую долю (в процентах) метанола СН3ОН в водном растворе, температура кристаллизации которого tзам = –2,79 0С. Криоскопическая константа воды 1,86.





 =1г/мл), то масса полученного раствора равна: 60 + 250 = 310 г и, следовательно:
=1г/мл), то масса полученного раствора равна: 60 + 250 = 310 г и, следовательно:
 =19,35%).
=19,35%).
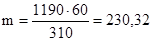 г К2СО3
г К2СО3 , где
, где  .
.
 (1,67М)
(1,67М)


 то число молей эквивалентов К2СО3, содержащихся в 1 л раствора равно отношению:
то число молей эквивалентов К2СО3, содержащихся в 1 л раствора равно отношению: молей эквивалентов.
молей эквивалентов. (3,34 н.)
(3,34 н.) г К2СО3.
г К2СО3.

 или
или 

 молей эквивалентов, где 56 г/моль – молярная масса эквивалента гидроксида калия.
молей эквивалентов, где 56 г/моль – молярная масса эквивалента гидроксида калия. ; отсюда
; отсюда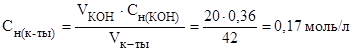 (0,17н.)
(0,17н.)
 г Н2SO4.
г Н2SO4. В этом растворе содержится
В этом растворе содержится  г Н2SO4.
г Н2SO4. г Н2SO4. Рассчитаем число молей серной кислоты, содержащихся в 1 л раствора:
г Н2SO4. Рассчитаем число молей серной кислоты, содержащихся в 1 л раствора: молей, где 98 г/моль – молярная масса H2SO4.
молей, где 98 г/моль – молярная масса H2SO4. =
=  г/моль. Масса HCl, необходимая для приготовления 2 л 0,5н. раствора хлороводородной кислоты равна:
г/моль. Масса HCl, необходимая для приготовления 2 л 0,5н. раствора хлороводородной кислоты равна:
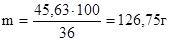

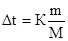
 или
или  (1)
(1) или
или  (2)
(2)

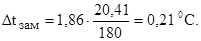
 , то температура замерзания (кристаллизации) раствора равна:
, то температура замерзания (кристаллизации) раствора равна: , где 0 °С - температура замерзания воды.
, где 0 °С - температура замерзания воды.

 (2),
(2),


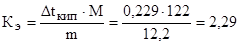
 = –0,279 0С. Вычислите молярную массу глицерина.
= –0,279 0С. Вычислите молярную массу глицерина.

 , находим молярную массу глицерина:
, находим молярную массу глицерина:
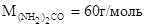 , находим массу m (г) растворенного вещества в 1000 г воды, из формулы (1):
, находим массу m (г) растворенного вещества в 1000 г воды, из формулы (1):




