Международный государственный экологический
институт им. А. Д. Сахарова. БГУ




Факультет мониторинга окружающей среды
Кафедра общей и медицинской физики
Лабораторная работа № 5.5 (К)
Изучение спектра атома водорода
Минск
2018
ИЗУЧЕНИЕ СПЕКТРА АТОМА ВОДОРОДА
Цель работы: наблюдение спектра испускания атомарного водорода и измерение длин волн видимой области; проверка формулы Бальмера; определение постоянной Ридберга, энергии ионизации и уровней энергии атома водорода; оценка скорости электрона и размеров атома в различных стационарных состояниях.
Эмпирические спектральные закономерности
К началу ХХ века на основе обширного экспериментального материала было установлено:
1. Оптические спектры атомарных газов состоят из отдельных, достаточно узких линий.
2. Набор частот в спектре каждого элемента строго индивидуален.
3. Частоты спектра поглощения составляют часть множества частот спектра испускания того же элемента.
4. У каждого элемента имеется свой дискретный набор положительных чисел, называемых спектральными термами:  ,
, 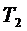 ,
,  ,…; обратные длины волн всех спектральных линий этого элемента
,…; обратные длины волн всех спектральных линий этого элемента  являются разностями его термов:
являются разностями его термов:
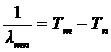 . .
|
(5.1)
|
Данное утверждение является одной из возможных формулировок комбинационного принципа Ритца.
5. Спектральные термы атома водорода с большой точностью описываются эмпирически найденным выражением:
 , , 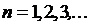
|
(5.2)
|
Термы (5.2) называются бальмеровскими, 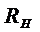 – постоянной Ридберга.
– постоянной Ридберга.
Объяснение основных спектральных закономерностей
Для объяснения эмпирических спектральных закономерностей 1, 2 и 4 (см. раздел. 5.1) на основе элементарных квантовых представлений достаточно поставить в соответствие: термам - уровни энергии, а спектральным линиям - квантовые переходы. При этом комбинационный принцип Ритца (5.1) станет следствием условия частот Бора (5.3), если принять
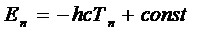 . .
| (5.4)
|
При обосновании (5.4) использовано соотношение, связывающее длину волны и частоту электромагнитного излучения:  (
(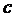 - скорость света). Знак минус в (4) связан с необходимостью ставить в соответствие более высоким уровням энергии термы с меньшими численными значениями. Если энергия атома отсчитывается от границы ионизации, то в (5.4) следует принять
- скорость света). Знак минус в (4) связан с необходимостью ставить в соответствие более высоким уровням энергии термы с меньшими численными значениями. Если энергия атома отсчитывается от границы ионизации, то в (5.4) следует принять 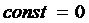 .
.
Для объяснения спектральной закономерности 3 (из раздела 5.1) достаточно учесть, что при получении спектра поглощения практически все атомы исследуемого вещества находятся в основном состоянии.
В то же время, для объяснения закономерности 5 (т.е. для вывода формулы (5.2)) постулатов Бора недостаточно. Мы изучим вначале уровни энергии и спектр атома водорода, основываясь на (5.2) как на эмпирической формуле, а затем вернемся к вопросу о её выводе.
Экспериментальная установка
В данной работе изучается серия Бальмера в спектре испускания атома водорода. Длины волн линий этой серии удовлетворяют соотношению (5.6) при 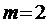 , (формуле Бальмера):
, (формуле Бальмера):
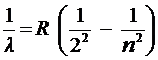 . .
|
(5.15)
|
Квантовое число 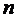 для первых четырёх линий серии Бальмера, лежащих в видимой области спектра, принимает значения 3, 4, 5, 6. Эти линии обозначаются соответственно
для первых четырёх линий серии Бальмера, лежащих в видимой области спектра, принимает значения 3, 4, 5, 6. Эти линии обозначаются соответственно  ,
,  ,
, 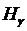 ,
, 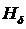 .
.
Свечение водорода создаётся в газоразрядной лампе при пропускании через неё электрического тока от высоковольтного источника. Для наблюдения спектра и измерения длин волн спектральных линий используется монохроматор.
Экспериментальная установка состоит из монохроматора типа МУМ, водородной лампы ТВС-15 в кожухе и источника питания лампы. Монохроматор и лампа крепятся с помощью рейтеров на двойном рельсе. Оптическая схема установки представлена на рис.5.3.
Универсальный монохроматор МУМ представляет собой спектральный прибор с вогнутой отражательной дифракционной решеткой 10, и входной щелью 5 постоянной ширины 0,05 мм. Вместо выходной щели в монохроматоре установлены окуляр 9 и указатель 8 в виде острия, на которое при сканировании спектра можно выводить нужную спектральную линию.
Сканирование спектра производится поворотом решётки с помощью рукоятки 11, находящейся на боковой стенке справа. При этом длина волны спектральной линии, совмещённой с указателем 8, определяется непосредственно по цифровому механическому счётчику 12 с точностью до ±0,2 нм. Водородная лампа 1 устанавливается перед конденсорной линзой 4, закреплённой в блоке входной щели монохроматора. Поступающее в щель излучение направляется зеркалом 6 на дифракционную решётку 10, где разлагается на монохроматические компоненты и, отразившись от зеркала 7, попадает в окуляр 9.
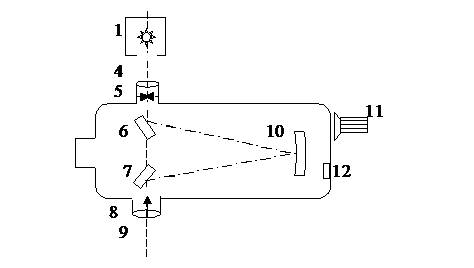
Рис. 5.3
Источник питания водородной лампы содержит следующие узлы: повышающий трансформатор 220 В ´ 3000 В, блок конденсаторов для повышения устойчивости горения лампы, выключатель и индикатор включения. Кожух лампы обеспечивает безопасность подключения высокого напряжения и свободное перемещение лампы вдоль рельса.
Измерения
После включения водородной лампы производят фокусировку окуляра (путём его небольших перемещений вдоль оптической оси), добиваясь чёткой видимости указателя и спектральных линий. Спектр излучения водородной лампы содержит много спектральных линий, в большинстве принадлежащих молекулярному водороду Н2. На фоне молекулярного спектра легко обнаруживаются линии атомарного водорода из серии Бальмера. Они выглядят значительно ярче молекулярных линий. Их поиск удобнее всего начинать с красной линии 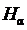 . Следующая – наиболее яркая – зелёно-голубая линия
. Следующая – наиболее яркая – зелёно-голубая линия  . Третья линия
. Третья линия  – фиолетово-синяя. Четвёртая линия
– фиолетово-синяя. Четвёртая линия 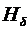 – тёмно-фиолетовая. Из-за небольшой интенсивности наблюдать её значительно труднее первых трёх.
– тёмно-фиолетовая. Из-за небольшой интенсивности наблюдать её значительно труднее первых трёх.
Пронаблюдав весь спектр, схематически зарисовывают его атомарную часть, приблизительно соблюдая интервалы между линиями. После этого тщательно измеряют длины волн четырех линий. Результаты измерений и цвет линий указывают на рисунке. Длины волн вносят также в табл. 5.1.
Таблица 5.1
Задание
1. Наблюдать и схематически зарисовать спектр излучения атома водорода.
2. Измерить длины волн линий 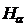 ,
,  ,
, 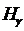 ,
,  .
.
3. Найти экспериментальные значения постоянной Ридберга 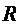 , энергетической постоянной
, энергетической постоянной  , энергии ионизации
, энергии ионизации  и резонансной энергии
и резонансной энергии 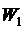 атома водорода. Вычислить энергии восьми нижних стационарных состояний.
атома водорода. Вычислить энергии восьми нижних стационарных состояний.
4. Построить в масштабе 1 эВ/см диаграмму уровней энергии атома водорода и отметить на ней квантовые переходы для серий Лаймана, Бальмера и Пашена.
5. Найти границы этих трёх серий в нанометрах и электрон-вольтах.
6. Вычислить теоретическое значение постоянной Ридберга для лёгкого изотопа водорода и сравнить его с экспериментально полученным значением.
7. Вычислить диаметр атома водорода и скорость его электрона для основного состояния и для состояния с n = 700.
5.11. Контрольные вопросы
1. Какой вид имеют бальмеровские термы? Формула Бальмера? Обобщенная формула Бальмера?
2. Как формулируется комбинационный принцип Ритца? Какова его связь с условием частот Бора?
3. Чему равна постоянная Ридберга, как она связана с энергией ионизации атома водорода и с фундаментальными постоянными?
4. Какие важнейшие свойства атома не находят своего объяснения в классической теории?
5. Как формулируются постулаты Бора? Утверждал ли Н. Бор, что атом может существовать лишь в стационарных состояниях?
6. Что такое кратность вырождения уровня энергии?
7. В каких случаях спектр энергии атомной системы дискретен, а в каких непрерывен?
8. Как интерпретируется условие частот Бора на основе представлений о фотонах?
9. К какому типу относится каждый из переходов a, b,…. h, изображённых на рис.1? Какой из них соответствует наибольшей, а какой – наименьшей длине волны излучения?
10. Какая из величин (Еатома или Есвязи) растёт вместе с ростом численного значения спектрального терма? С ростом главного квантового числа n?
11. Какая величина называется резонансной энергией? Резонансным потенциалом? Потенциалом ионизации?
12. При каком выборе начала отсчёта на шкале энергии связанным состояниям будут соответствовать отрицательные значения энергии атома?
13. Чем обусловлен знак минус в формуле (3.4)? От чего зависит значение постоянной (const) в этой формуле?
14. Что называется спектральной серией? Почему в поглощении, как правило, наблюдается лишь одна из серий? Какая?
15. С какой стороны (со стороны меньших или больших значений l) к дискретным линиям спектральной серии может примыкать участок непрерывного спектра? При каких условиях?
16. Как выводится соотношение (3.17), связывающее длину волны и энергию фотона? Оцените его точность.
17. Какие предположения лежат в основе боровской модели круговых орбит? Оценки каких величин можно сделать в рамках этой модели?
18. Какими представлениями были заменены боровские орбиты в последовательной квантовой теории?
19. Каковы порядки расстояний от ядра для электрона в атоме водорода и для самого сильно связанного электрона в атоме урана? Каковы порядки их энергий связи? Порядки скоростей?
20. Что такое боровский радиус? Что такое постоянная тонкой структуры? Каковы их численные значения?
21. Как в теории боровских орбит учесть конечность массы ядра?
22. Каковы пределы видимого диапазона для длин волн (в нм), для обратных длин волн, для частот, для энергий фотонов (в эВ)?
23. Чему равно время одного оборота электрона по боровской круговой орбите при заданных Z и n? Сравнить время обращения при Z = 1, n = 1 с типичным временем жизни возбуждённого состояния атома.
24. Какие атомные системы называются водородоподобными?
Международный государственный экологический
институт им. А. Д. Сахарова. БГУ




Факультет мониторинга окружающей среды







 ,
, 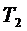 ,
,  ,…; обратные длины волн всех спектральных линий этого элемента
,…; обратные длины волн всех спектральных линий этого элемента  являются разностями его термов:
являются разностями его термов: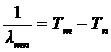 .
.
 ,
, 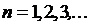
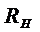 – постоянной Ридберга.
– постоянной Ридберга.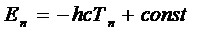 .
.
 (
(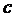 - скорость света). Знак минус в (4) связан с необходимостью ставить в соответствие более высоким уровням энергии термы с меньшими численными значениями. Если энергия атома отсчитывается от границы ионизации, то в (5.4) следует принять
- скорость света). Знак минус в (4) связан с необходимостью ставить в соответствие более высоким уровням энергии термы с меньшими численными значениями. Если энергия атома отсчитывается от границы ионизации, то в (5.4) следует принять 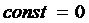 .
.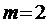 , (формуле Бальмера):
, (формуле Бальмера):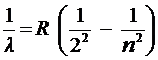 .
.
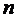 для первых четырёх линий серии Бальмера, лежащих в видимой области спектра, принимает значения 3, 4, 5, 6. Эти линии обозначаются соответственно
для первых четырёх линий серии Бальмера, лежащих в видимой области спектра, принимает значения 3, 4, 5, 6. Эти линии обозначаются соответственно  ,
,  ,
, 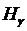 ,
, 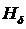 .
.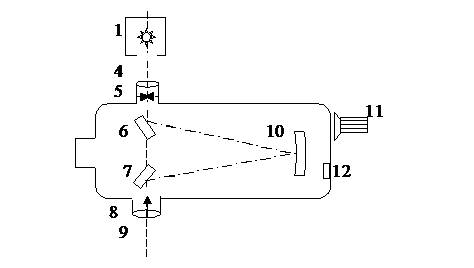
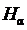 . Следующая – наиболее яркая – зелёно-голубая линия
. Следующая – наиболее яркая – зелёно-голубая линия  . Третья линия
. Третья линия  – фиолетово-синяя. Четвёртая линия
– фиолетово-синяя. Четвёртая линия 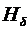 – тёмно-фиолетовая. Из-за небольшой интенсивности наблюдать её значительно труднее первых трёх.
– тёмно-фиолетовая. Из-за небольшой интенсивности наблюдать её значительно труднее первых трёх.
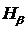

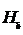
 , м-1
, м-1
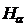 ,
,  ,
, 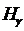 ,
,  .
.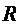 , энергетической постоянной
, энергетической постоянной  , энергии ионизации
, энергии ионизации  и резонансной энергии
и резонансной энергии 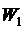 атома водорода. Вычислить энергии восьми нижних стационарных состояний.
атома водорода. Вычислить энергии восьми нижних стационарных состояний.


