

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
Топ:
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Вывод формулы (5.5) (и тем самым объяснение закономерности 5 раздела 5.1), описывающей уровни энергии атома водорода, и нахождение других характеристик стационарных состояний этого атома были осуществлены Нильсом Бором в рамках модели круговых орбит. В отличие от постулатовБора, отражающих наиболее общие квантовые закономерности и всесторонне подтвержденных дальнейшим ходом развития физики, модельная теория Бора содержала предположения, противоречивость и временный характер которых были ясны Н. Бору с самого начала.
В простейшем варианте этой модели предполагается, что:
а) Электрон движется вокруг ядра, обладающего зарядом Ze, по круговой орбите радиуса r со скоростью V согласно законам классической механики и, следовательно:
 . .
| (5.7) |
б) Стационарным состояниям атома соответствуют те орбиты, для которых момент импульса кратен  :
:
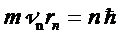 , ,
| (5.8) |
где 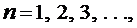
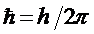 .
.
Этих предположений достаточно для того, чтобы найти дискретные – «проквантованные» в рамках данной модели - значения различных физических характеристик стационарных состояний водородоподобных систем: атома водорода (Z = 1), иона гелия Не+ (Z = 2), двукратно ионизированного атома лития Li++ (Z = 3) и т.д. Действительно, непосредственно из (5.7) и (5.8) получаются наборы для радиусов «разрешенных» орбит r n и для скоростей электрона V n:
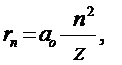 где где  , ,
| (5.9) |
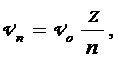 где где 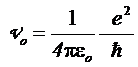 , ,
| (5.10) |
а с помощью (5.9) и (5.10) – для полной энергии системы:
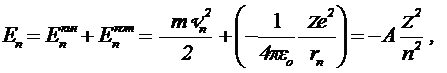
 . .
| (5.11) |
Таким образом, боровская модель круговых орбит позволяет не только вывести формулу (5.5) для уровней энергии атома водорода, но и выразить постоянную Ридберга через фундаментальные константы. В самом деле, совпадение найденного из эксперимента значения  с величиной
с величиной 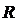 , вычисленной в соответствии с (5.11), по формуле:
, вычисленной в соответствии с (5.11), по формуле:
|
|
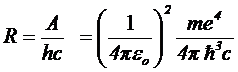 , ,
| (5.12) |
является очень хорошим. Оно становится еще лучшим (до седьмого знака), если в (5.12) под  понимать не массу электрона
понимать не массу электрона  , а приведенную массу системы электрон-ядро:
, а приведенную массу системы электрон-ядро:

| (5.13) |
и тем самым принять во внимание движение ядра (учесть конечность его массы).
В заключение отметим, что в ходе развития квантовой физики представления об орбитах электронов были отвергнуты. Согласно квантовой механике – последовательной теории микроявлений, созданной к 1926 г, состояние электрона в атоме следует описывать с помощью волновой функции, определяющей, в частности, вероятность нахождения электрона в том или ином месте пространства. Уравнения квантовой механики позволяют в принципе найти эти функции для любого состояния любой микросистемы (атома, молекулы и т.д.). В случае атома водорода получены точные решения этих уравнений, полностью согласующиеся с результатами точнейших экспериментов. Из этих решений следует, что формула для уровней энергии (5.11) не требует пересмотра (она лишь уточняется при учете спина электрона и релятивистских поправок), в тогда как формулы (5.9) и (5.10) следует понимать лишь как приближенные оценки для расстояния электрона от ядра и для скорости электрона в водородоподобном атоме. Таким образом, величины 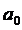 и
и 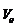 , наряду с постоянной
, наряду с постоянной  , остались в качестве естественных масштабов в физике атома. Постоянную
, остались в качестве естественных масштабов в физике атома. Постоянную  называют (первым) боровским радиусом, а отношение
называют (первым) боровским радиусом, а отношение 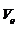 к скорости света – постоянной тонкой структуры (a):
к скорости света – постоянной тонкой структуры (a):
 . .
| (5.14) |
Экспериментальная установка
В данной работе изучается серия Бальмера в спектре испускания атома водорода. Длины волн линий этой серии удовлетворяют соотношению (5.6) при 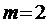 , (формуле Бальмера):
, (формуле Бальмера):
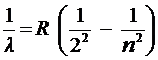 . .
| (5.15) |
Квантовое число 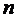 для первых четырёх линий серии Бальмера, лежащих в видимой области спектра, принимает значения 3, 4, 5, 6. Эти линии обозначаются соответственно
для первых четырёх линий серии Бальмера, лежащих в видимой области спектра, принимает значения 3, 4, 5, 6. Эти линии обозначаются соответственно  ,
,  ,
, 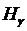 ,
, 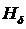 .
.
|
|
Свечение водорода создаётся в газоразрядной лампе при пропускании через неё электрического тока от высоковольтного источника. Для наблюдения спектра и измерения длин волн спектральных линий используется монохроматор.
Экспериментальная установка состоит из монохроматора типа МУМ, водородной лампы ТВС-15 в кожухе и источника питания лампы. Монохроматор и лампа крепятся с помощью рейтеров на двойном рельсе. Оптическая схема установки представлена на рис.5.3.
Универсальный монохроматор МУМ представляет собой спектральный прибор с вогнутой отражательной дифракционной решеткой 10, и входной щелью 5 постоянной ширины 0,05 мм. Вместо выходной щели в монохроматоре установлены окуляр 9 и указатель 8 в виде острия, на которое при сканировании спектра можно выводить нужную спектральную линию.
Сканирование спектра производится поворотом решётки с помощью рукоятки 11, находящейся на боковой стенке справа. При этом длина волны спектральной линии, совмещённой с указателем 8, определяется непосредственно по цифровому механическому счётчику 12 с точностью до ±0,2 нм. Водородная лампа 1 устанавливается перед конденсорной линзой 4, закреплённой в блоке входной щели монохроматора. Поступающее в щель излучение направляется зеркалом 6 на дифракционную решётку 10, где разлагается на монохроматические компоненты и, отразившись от зеркала 7, попадает в окуляр 9.
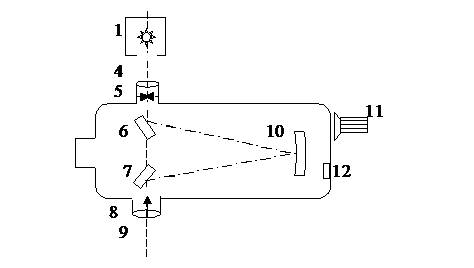
Рис. 5.3
Источник питания водородной лампы содержит следующие узлы: повышающий трансформатор 220 В ´ 3000 В, блок конденсаторов для повышения устойчивости горения лампы, выключатель и индикатор включения. Кожух лампы обеспечивает безопасность подключения высокого напряжения и свободное перемещение лампы вдоль рельса.
Измерения
После включения водородной лампы производят фокусировку окуляра (путём его небольших перемещений вдоль оптической оси), добиваясь чёткой видимости указателя и спектральных линий. Спектр излучения водородной лампы содержит много спектральных линий, в большинстве принадлежащих молекулярному водороду Н2. На фоне молекулярного спектра легко обнаруживаются линии атомарного водорода из серии Бальмера. Они выглядят значительно ярче молекулярных линий. Их поиск удобнее всего начинать с красной линии 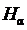 . Следующая – наиболее яркая – зелёно-голубая линия
. Следующая – наиболее яркая – зелёно-голубая линия  . Третья линия
. Третья линия  – фиолетово-синяя. Четвёртая линия
– фиолетово-синяя. Четвёртая линия 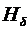 – тёмно-фиолетовая. Из-за небольшой интенсивности наблюдать её значительно труднее первых трёх.
– тёмно-фиолетовая. Из-за небольшой интенсивности наблюдать её значительно труднее первых трёх.
|
|
Пронаблюдав весь спектр, схематически зарисовывают его атомарную часть, приблизительно соблюдая интервалы между линиями. После этого тщательно измеряют длины волн четырех линий. Результаты измерений и цвет линий указывают на рисунке. Длины волн вносят также в табл. 5.1.
Таблица 5.1
| Линия | 
| 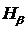
| 
| 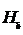
|
| n | ||||
| цвет | ||||
| l, нм | ||||
 , м-1 , м-1
|
|
|
|

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!