Кем быть? Как гемопоэтическая стволовая клетка "выбирает профессию "
Костный мозг - кроветворный орган, расположенный в ячейках губчатых костей и в эпифизах трубчатых. Его населяют различные виды клеток. Если посмотреть на срез костного мозга в микроскоп, в нём можно увидеть участки кости, в которых представлены клетки костной ткани. Также обнаруживаются наполненные кровью синусоиды, образованные эндотелиоцитами, вокруг которых располагаются периваскулярные клетки. Рядом с сосудами расположены симпатические нервные волокна. Кроме того, в костном мозге находятся адипоциты - крупные жировые клетки, количество которых увеличивается с возрастом. Но так как главной функцией костного мозга является кроветворение, его основную массу составляют клетки крови на разных стадиях дифференцировки. Среди них можно выделить гемопоэтические стволовые клетки (ГСК) — примитивные клетки, дающие начало всем клеткам крови и способные поддерживать свое количество относительно постоянным на протяжении всей жизни организма.
Часть ГСК находится в состоянии покоя: такие клетки неактивны и не участвуют в клеточном цикле. Но проснувшись, гемопоэтическая стволовая клетка делает очень важный выбор. Уникальным свойством всех стволовых клеток является способность к самообновлению — так называют симметричное деление с образованием идентичных копий материнской клетки. Так гемопоэтическая стволовая клетка может практически бесконечно продлять свое детство.
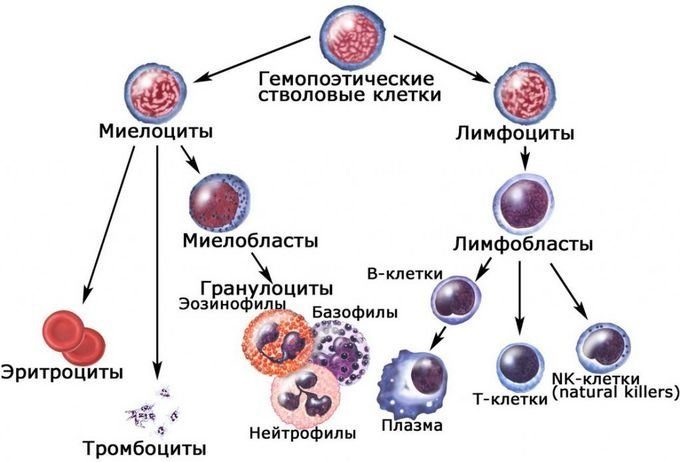
Но если ГСК решила взрослеть, она приступает к асимметричному делению, которое в итоге приводит к дифференцировке (приобретению специфических свойств). Согласно классической схеме кроветворения*, в результате такого асимметричного деления образуется коммитированный («выбравший свой путь») предшественник, который дает начало одному из двух основных ростков кроветворения - миелоидному («учеба») и лимфоидному («армия») [10].
Общие миелоидные предшественники в дальнейшем выбирают одно из направлений («специальностей»): мегакариоцитарное (конечный результат которого - образование тромбоцитов, участвующих в формировании тромбов при повреждении сосудов), эритроцитарное (с образованием эритроцитов, осуществляющих перенос кислорода к тканям и углекислого газа от них), моноцитарное (моноциты впоследствии превращаются в макрофаги и поглощают чужеродные частицы) или гранулоцитарное (зрелые клетки содержат гранулярные структуры (зернистость), накапливающие специфические вещества, и представлены нейтрофилами, эозинофилами и базофилами, выполняющими разнообразные функции).
* — По современным данным, гемопоэтическая стволовая клетка «взрослеет», постепенно теряя способность к самообновлению и приобретая способность к дифференцировке. А решение выбрать «рабочую специальность», то есть мегакариоцитарное и эритроцитарное направление дифференцировки, клетка принимает еще до того, как рассмотрит варианты с «учебой» и «армией» (миелоидным или лимфоидным ростками) [11].
Общие лимфоидные предшественники дают начало клеткам иммунной системы — NK-клеткам, T- и B-лимфоцитам, — которые защищают организм от вторжения. NK-клетки (большие гранулярные лимфоциты) убивают чужаков, T-лимфоциты могут распознавать эпитоп (участок антигена) врага и организовывать наступление (T-хелперы) или атаковать самостоятельно (цитотоксические лимфоциты), а B-лимфоциты, тоже после знакомства с антигеном, могут превращаться в плазматические клетки, вырабатывать специфические антитела и поражать ими врага на расстоянии.
Каким же образом гемопоэтическая стволовая клетка решает, оставаться ей вечно юной или встать на путь дифференцировки и превратиться в зрелую клетку крови? И как она выбирает свою будущую профессию? Результаты большого количества исследований доказывают, что важную роль играет окружение гемопоэтической стволовой клетки*. В первую очередь, это различные виды клеток, формирующие гемопоэтическую нишу костного мозга.
Как правило, выделяют эндостальную нишу, компонентами которой являются остеобласты. Есть данные, что в эндостальной нише находятся клетки в состоянии покоя [12]. Также ряд исследований показал, что остеобласты важны для формирования лимфоидных предшественников — будущих «солдат» [13]. Говорят и о васкулярной (сосудистой) нише, образованной эндотелиоцитами синусоидов и периваскулярными клетками [12, 13]. В 2012 году Ванг и соавторы опубликовали работу, в которой описали зону между эндотелиальными клетками синусоида и периваскулярными клетками, назвав ее гемосферой [15]. Именно в этом пространстве обнаруживалось большое количество гемопоэтических стволовых клеток, что свидетельствовало об особых условиях для поддержания «юного» состояния клеток крови. Однако из-за анатомической близости этих ниш однозначно разделить их невозможно. С помощью методов трехмерной визуализации было показано, что эндостальная область костного мозга с хорошей васкуляризацией как раз и обеспечивает условия для существования и функционирования гемопоэтических стволовых клеток [16].
Кроме того, другие клетки костного мозга также могут влиять на судьбу гемопоэтической стволовой клетки. Например, было показано, что адипоциты препятствуют гемопоэзу, а немиелинизирующие шванновские клетки, расположенные рядом с симпатическими нервными волокнами, поддерживают ГСК в состоянии покоя [13].
Кроме непосредственного влияния окружающих клеток, на ГСК воздействует множество растворимых веществ — цитокинов и ростовых факторов. Часть из них вырабатывается клетками ниши, другие синтезируются далеко от костного мозга (например, эритропоэтин — в почках, а паратиреоидный гормон — паращитовидной железой). Некоторые вещества продляют детство ГСК (например, CXCL-12 — хемокин подсемейства CXC), способствуя ее самообновлению [14]. А некоторые заставляют задуматься о взрослении и будущей профессии. Например, интерлейкин-7, как военная игрушка, способствует появлению у юных клеток мыслей о службе, а гранулоцитарный колониестимулирующий фактор развивает тягу к знаниям. Также в регуляции кроветворения участвует симпатическая нервная система, передавая сигналы о ситуации в организме [12].
Однако выбор профессии — непростой процесс. И огромную роль в нём, помимо внешнего воздействия, играют личные предпочтения и склонности. Как и у человека, у гемопоэтической стволовой клетки богатый и сложный внутренний мир, который представлен транскрипционными факторами. Именно их взаимодействия приводят в конечном итоге к принятию решения, кем же ей быть [17, 18].
Например, экспрессия гена транскрипционного фактора GATA1 способствует выбору эритроцитарного и мегакариоцитарного направления дифференцировки, в то время как высокий уровень PU.1 связан с дифференцировкой по моноцитарному пути и подавляет желание клетки стать эритроцитом или мегакариоцитом. Эти два транскрипционных фактора взаимосвязаны таким образом, что повышение продукции одного из них снижает экспрессию гена другого. Уровень экспрессии гена PU.1 (SPI1) также регулируется транскрипционным фактором Ikaros, который стимулирует синтез транскрипционного репрессора Gfi1. Вместе они подавляют экспрессию SPI1. Увеличение концентрации PU.1 активирует транскрипционные факторы Egr, запускающие программу дифференцировки в моноциты. Egr также активируют гены белков семейства Id (ингибиторов ДНК-связывающих белков), что приводит к снижению продукции E2A — важнейшего транскрипционного фактора в развитии B-лимфоцитов. Кроме того, пониженный уровень PU.1 блокирует дифференцировку клетки в B-лимфоцит другим путем — через снижение экспрессии генов факторов EBF [17, 18].
Конечно, представление работы транскрипционных факторов в виде механических блоков — чрезвычайное упрощение. Кроме того, описанные взаимодействия — лишь малая часть огромной сети транскрипционных факторов. В настоящее время ведутся масштабные исследования, чтобы составить представление о внутренних факторах, участвующих в регуляции дифференцировки гемопоэтической стволовой клетки, и об их взаимосвязи с внешними факторами, такими как влияние других клеток и растворимых факторов. Все эти знания помогут лучше понять процессы, лежащие в основе кроветворения в норме и при различных заболеваниях, разработать подходы к лечению этих заболеваний, а также научиться управлять судьбой гемопоэтических стволовых клеток in vitro и in vivo.
Дополнительная информация:

Работа клеток иммунной системы. Типы иммунитета (базовые понятия + видеопояснения).
(рекомендовано к прочтению)
К разделу:
· Микробиом, иммунитет и пробиотики
Дополнительно см.:
· Цитокины в системе иммунитета.
· Толл-подобные рецепторы и иммунный ответ (+видео)
· Иммунитет, лимфоциты и дендритные клетки
· T-лимфоциты и их циркуляция
· Врожденные лимфоидные клетки (ILCs) и патогенные бактерии (+ видео)
· Регуляторные Т-клетки - миротворцы иммунной системы
· Развитие и поддержание регуляторных Т-клеток кишечника
· Роль микробиоты в иммунитете и воспалении (+ видео)
· Микробиота кишечника и воспаление
· Иммунопатология атеросклероза и кишечная микробиота
· Кишечный дисбиоз и иммунометаболические нарушения
· ВЗК, микробиота и иммунитет слизистой оболочки
· Роль кишечной микробиоты и метаболитов в гомеостазе кишечника и заболеваниях человека
· Эпигенетика, короткоцепочечные жирные кислоты и врожденная иммунная память
Источник (по материалам): А. Боголюбова. Иммунитет: борьба с чужими и… своими. / Спецпроект: аутоиммунные заболевания / biomolecula 26.01.2017
Литература:
1. Mark D. Turner, Belinda Nedjai, Tara Hurst, Daniel J. Pennington. (2014). Cytokines and chemokines: At the crossroads of cell signalling and inflammatory disease. Biochimica et Biophysica Acta (BBA) - Molecular CellResearch. 1843, 2563-2582;
2. Janeway C.A. Jr., Travers P., Walport M., Shlomchik M.J. Immunobiology: the immune system in health and disease (5th Edition). NY: Garland Science, 2001;
3. M. Goodell. (2015). Introduction to a review series on hematopoietic stem cells. Blood. 125, 2587-2587;
4. 4Himanshu Kumar, Taro Kawai, Shizuo Akira. (2011). Pathogen Recognition by the Innate Immune System. International Reviews of Immunology. 30, 16-34;
5. N. D. Pennock, J. T. White, E. W. Cross, E. E. Cheney, B. A. Tamburini, R. M. Kedl. (2013). T cell responses: naive to memory and everything in between. AJP: Advances in Physiology Education. 37, 273-283;
6. Т-лимфоциты: путешественники и домоседы;
7. Касацкая С. (2016). Клональная селекция гамма/дельта Т-лимфоцитов: новые роли для субпопуляций и отличия от классических альфа/бета Т-клеток. Сайт ИБХ;
8. S. Paul, Shilpi, G. Lal. (2015). Role of gamma-delta () T cells in autoimmunity. Journal of Leukocyte Biology. 97, 259-271;
9. Focus on 50 years of B cells. (2015). Nat. Rev. Immun. 15;
10. Zhu J. and Emerson S.G. (2002). Hematopoietic cytokines, transcription factors and lineage commitment. Oncogene. 21, 3295–3313;
11. Rieger M.A. and Schroeder T. (2012). Hematopoiesis. Cold Spring Harb. Perspect. Biol. 4 (12), a008250;
12. Семенова Н.Ю., Бессмельцев С.С., Ругаль В.И. (2014). Биология ниши гемопоэтических клеток. Клиническая онкогематология. 7 (4), 501–511;
13. Ugarte F. and Forsberg E.C. (2013). Haematopoietic stem cell niches: new insights inspire new questions. EMBO J. 32 (19), 2535–2547;
14. Oh I.H. and Humphries R.K. (2012). Concise review: Multidimensional regulation of the hematopoietic stem cell state. Stem Cells. 30 (1), 82–88;
15. Wang L., Benedito R., Bixel M.G., Zeuschner D., Stehling M., Sävendahl L. et al. (2012). Identification of a clonally expanding haematopoietic compartment in bone marrow. EMBO J. 32, 219–230;
16. Nombela-Arrieta C., Pivarnik G., Winkel B., Canty K.J., Harley B., Mahoney J.E. et al. (2013). Quantitative imaging of haematopoietic stem and progenitor cell localization and hypoxic status in the bone marrow microenvironment. Nat. Cell Biol. 15, 533–543;
17. Borghesi L. (2014). Hematopoiesis in steady-state versus stress: self-renewal, lineage fate choice, and the conversion of danger signals into cytokine signals in HSCs. J. Immunol. 193 (5), 2053–2058;
18. Schütte J., Moignard V., Göttgens B. (2012). Establishing the stem cell state: insights from regulatory network analysis of blood stem cell development. Wiley Interdiscip. Rev. Syst. Biol. Med. 4 (3), 285–295..







