ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Пензенский государственный педагогический университет
Имени В.Г. Белинского
Факультет Кафедра
Естественно-географический Биохимии
ДИПЛОМНАЯ РАБОТА НА ТЕМУ:
Антиатеросклеротическое действие смеси масел льна и расторопши с селенопираном
Студент________________________________________Краснова Ю.В.
Руководитель___________________________________Петрушова О. П.
________________Кравченко Ю. В.
К защите допустить. Протокол № от «_____» ____________2007 г.
Зав. Кафедрой______________________________________Генгин М. Т.
Пенза, 2007 год
СПИСОК СОКРАЩЕНИЙ
АО - антиоксиданты
АКМ – активные кислородные метаболиты
АС - атеросклероз
БОТ – бутилокситолуол
ВЖР – высокожировой рацион
ГМК - гладкомышечные клетки
ДК – диеновые коньюгаты
ИА - индекс атерогенности
ЛНП – липопротеиды низкой плотности
ЛОНП - липопротеиды очень низкой плотности
ЛП – липопротеиды
ЛВП - липопротеиды высокой плотности
мГМК - модифицированные ГМК
МДА – малоновый диальдегид
мЛНП - модифицированные ЛНП
ПНЖК – полиненасыщенные жирные кислоты
ПОЛ – перекисное окисление липидов
СМЛР - смеси масел льна и расторопши с селенопираном
СП - селенопиран
ТГ - триглицеридов
ТФ - токоферол
ХС - холестерин
ХС- ЛВП – холестерин липопротеидов высокой плотности
ХС- ЛНП - холестерин липопротеидов низкой плотности
ХС- ЛОНП - холестерин липопротеидов очень низкой плотности
ХСобщ - общий холестерин
ЭХС – эфиры холестерина
ВВЕДЕНИЕ
В настоящее время в диетотерапии и профилактике различных заболеваний, особенно сердечно-сосудистой системы, широко используются полиненасыщенные жирные кислоты (ПНЖК) семейства Омега-3. В многочисленных клинических и экспериментальных исследованиях выявлен положительный эффект применения данных жирных кислот, связанный с их влиянием на липидный обмен, иммунологическую реактивность и механизмы свертывания крови. Большинство подобных исследований [26, 27, 31] посвящено изучению эффективности ПНЖК, входящих в состав рыбных жиров. Растительным жирам в этом смысле уделено гораздо меньше внимания, хотя традиционным в России сырьем для получения масла, богатого альфа-линоленовой кислотой (семейства Омега-3), является семя льна. Комбинируя масло семян льна с другими растительными маслами, можно добиться оптимального соотношения ПНЖК класса Омега-3 и Омега-6, рекомендованного для целей диетотерапии. Существенным недостатком пищевого масла, богатого ПНЖК, является низкий срок хранения из-за высокой способности этих жирных кислот к окислению, поэтому актуальным является поиск способа стабилизации продукта. Второй аспект проблемы заключается в биологической целесообразности употребления такого масла. Известно, что в условиях недостатка в организме антиоксидантов поступление в него ПНЖК может приводить к индукции перекисного окисления липидов [36]. Решением этих вопросов может служить введение в композицию масла расторопши пятнистой с комплексом флаволигнанов [10] и синтетического антиоксиданта (АО). В качестве жирорастворимого АО в данной работе исследовалось органическое соединение селена – 9-фенил-симметричный октагидроселеноксантен (селенопиран – СП). Обладая высокой водородо- и электронодонорной активностью, данное соединение препятствует образованию перекисей [3]. Кроме того, СП в живом организме подвергается метаболизации в системе микросомального окисления [4], после чего из него высвобождается атом селена, встраивающийся в селенопротеины, основной функцией которых является антиоксидантная защита.
Целью нашей работы было исследование антиоксидантных свойств селенопирана in vitro, а также изучение антиатеросклеротического действия смеси масел льна и расторопши, стабилизированной селенопираном при моделировании экспериментального атеросклероза.
При выполнении работы были поставлены следующие задачи:
Исследовать количество липидов плазмы крови и их соотношение.
1. Изучить влияние смеси масел льна и расторопши, стабилизированной селенопираном, на процессы перекисного окисления липидов.
2. Выявить влияние смеси масел льна и расторопши, стабилизированной селенопираном, на процесс атерогенеза.
Научная новизна. Впервые выявлено антиатеросклеротическое действие смеси масел льна и расторопши, стабилизированной селенопираном in vivo при моделировании экспериментального атеросклероза. Выявлены различия действия исследуемого масла в клетках (эритроцитах, печени) и плазме крови.
Апробация работы. Материалы работы доложены на Научной студенческой конференции ПГПУ им. В.Г. Белинского.
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
Атеросклероз (АС) – патологическое изменение внутреннего слоя (интимы) и мышечного слоя (медии) артерии. Слово образовано от греч. «атере» - кашица, основной компонент которой – эфиры холестерина (ЭХС), включенные в уплотненную склерозированную бляшку [2]. Клиническими проявлениями АС являются различные широко распространенные сосудистые заболевания разных органов: сердца, аорты, головного мозга, почек, нижних конечностей. Атеросклеротическая бляшка затрудняет кровоток и вызывает ишемию и гипоксию органа, а при полной закупорке сосуда бляшкой или индуцированным ею тромбом возникают грозные осложнения АС: инфаркт миокарда, инсульт, гангрена конечностей [2].
1.1.Биохимические ОСНОВЫ ПАТОГЕНЕЗА АТЕРОСКЛЕРОЗА
По мере накопления экспериментальных данных по атеросклерозу, возникли разные гипотезы об этиологии заболевания и патогенезе. Все гипотезы связаны с транспортом липопротеидов (ЛП) и холестерина (ХС) в сосудистую стенку. Повышенный уровень ХС является, бесспорно, главным патогенетическим фактором развития атеросклероза, существенную роль играют и другие факторы риска: факторы повреждения эндотелия (инфекции, воспаления, гипертония, токсические факторы, например никотин, высокие содержания липопротеинов низкой плотности (ЛНП) и липопротеинов очень низкой плотности (ЛОНП), повышенная свертываемость крови, гемодинамические факторы (бляшки возникают в местах изгибов, ветвления, стенозов сосудов) и изменение содержания гормонов, но, пожалуй, важнейшим фактором можно назвать химическую и физико-химическую модификацию ЛНП (гликозилирование, перикисное окисление ХС и ПНЖК в ЛНП, десиалирование, частичный протеолиз, агрегация) [2].
В состав атеросклеротических бляшек входят: ЭХС, триацилглицерины, гликозаминогликаны, коллаген, эластин, кальций, макрофаги, модифицированные гладкомышечные клетки (мГМК), погибшие клетки. В атеросклеротических бляшках с большой частотой обнаруживаются ДНК герпесвирусов (цитомегаловируса и простого герпеса), а также хламидии. Роль этих микроорганизмов остается пока невыясненной. При разрыве фиброзной капсулы под действием механических и токсических факторов обнажается холестериновая кашица, и такая злокачественная бляшка становится центром агрегации тромбоцитов, отложения сгустков фибрина и тромбообразования [2].
Учитывая все перечисленные этиологические и патогенетические факторы, можно привести пример механизма интегральной модели АС артериальной стенки. В норме ЛНП крови транспортируют в эндотелий и другие клетки сосуда ХС, необходимый им для формирования мембран. При гиперхолестеринемии, обусловленной повышенным уровнем ЛНП, или при модификации ЛНП, главный поток ХС, во внутреннюю стенку сосудов, осуществляют моноциты. Последние фагоцитируют ЛНП, модифицированные ЛНП (мЛНП), аутоиммунные комплексы мЛНП с антителами и переносят ХС в субэндотелиальный участок интимы. ЛНП разрушаются в эндолизосоме, освобождая ХС, который накапливается в цитозоле макрофагов в виде капель ЭХС, придавая клеткам пенистый вид («пенистые» клетки). Этерификацию ХС катализирует ацетил-коэнзим А-холестеринацилтрансфераза, активируемая свободным ХС. «Пенистые» клетки, погибая освобождают ХС в межклеточное пространство для формирования бляшек [2].
Источником ХС бляшек так же служат гладкомышечные клетки (ГМК). Активированные макрофаги продуцируют в интиме цитокины (интерлейкин – 1 и др.), которые стимулируют миграцию ГМК из медии сосуда в интиму, а так же их пролиферацию и трансформацию в ГМК синтезирующего типа («миома сосуда»). Последние продуцируют коллаген и другие структуры соединительной ткани фиброзной бляшки. мГМК также фагоцитируют ЛНП и мЛНП, превращаясь в «пенистые» клетки [2].
Около 70% ХС крови содержится в составе ЛНП. Уровень ХС в крови зависит от огромного количества факторов: поглощаемой пищи, синтеза и регуляции, транспорта, расходования на синтез жирных кислот и других соединений с выведением. При патологических процессах нарушается динамическое равновесие между указанными факторами, что может привести к гиперхолестеринемии. Следовательно, гиперхолестеринемия – главный фактор риска развития атеросклероза, как правило, связана с увеличением содержания в крови ЛНП и их предшественников ЛОНП – двух атерогенных ЛП. Поэтому более строгим фактором риска следует считать не гиперхолестеринемию, а дислипопротеинемию – количественное преобладание ЛНП, ЛОНП и качественные изменения в структуре ЛНП (мЛНП) [2]. В формировании модифицированных липопротеидов центральную роль играют процессы свободнорадикального окисления (перекисное окисление липидов (ПОЛ)).
АТЕРОГЕНЕЗ
Многие исследователи отмечают, что необходимым условием атерогенеза является повреждение стенки сосуда, что приводит к секвестрации и накоплению в интиме фагоцитирующих клеток с последующим их перерождением в «пенистые» клетки. Тот факт, что формирование «пенистых» клеток происходит при инкубации макрофагов только с окисленными или модифицированными («атерогенные ЛНП»), но не с нативными ЛНП, послужил основой концепции, согласно которой, начальным этапом атерогенеза является возникновение окисленных ЛНП, цитотоксичных для эндотелиоцитов и усиливающих адгезию нейтрофилов, что вызывает повреждение эндотелия; захват окисленных ЛНП макрофагами и приводит к образованию «пенистых» клеток, их накоплению в интиме сосудов и в последующем – к формированию атеросклеротической бляшки [20, 33, 37, 38]. Таким образом, свободнорадикальные реакции с участием активированных кислородных метаболитов (АКМ) являются атерогенным фактором, так как вызывают модификацию ЛП (преимущественно ЛНП) плазмы крови; кроме того АКМ и продукты их реакции, в том числе и окисленные ЛП, оказывают цитотоксическое и деструктивное воздействие на клетки и ткани [23, 29], что может лежать в основе повреждения сосудов [16]. Множество экспериментальных, клинических и эпидемиологических исследований позволяют отнести АС к классическим свободно радикальным патологиям [1, 6].
В моноцитах (макрофагах) и в эндотелии сосудов основную роль в поглощении окисленных ЛНП играют не ЛНП-рецепторы, а особые нерегулируемые скэвенджер-рецепторы, (рецепторы – «мусорщики») для модифицированных ЛНП [21]. Общим признаком всех лигандов для скэвенджер – рецепторов является наличие полианионных комплексов («рецептор-липучка»). Скэвенджер – рецепторы связывают только модифицированные ЛНП, и их экспрессия не регулируется внутриклеточным содержанием холестерина [21]. Больше всего скэвенджер – рецепторов выявляется в моноцитах/ макрофагах [34].
Проникновению моноцитов в эндотелиальную стенку предшествует их адгезия на поверхности эндотелия, по-видимому, в ответ на появление в интиме мЛНП и секрецию хемотаксических веществ - хемоатрактантов. Адгезивные молекулы обеспечивают прилипание моноцитов на поверхности эндотелия. Часть проникших в интиму моноцитов/макрофагов подвергается в ней пролиферации [35].
Значительная часть макрофагов после захвата ими мЛНП и накопления в них ЭХС трансформируется в «пенистые» клетки и остается в интиме. Подавляющая часть «пенистых» клеток гибнет, при этом в интиму изливаются накопленные в них ЭХС, ненасыщенных эфиров холестерина и кристаллы моногидрата ХС. Образуются очаговые скопления ХС и создается угроза развития сначала липидных пятен, а затем и атеросклеротических бляшек [13].
Оценивая участие макрофагов в атерогенезе, следует сказать, что эти клетки, захватывая мЛНП, стремятся выжить и покинуть артериальную стенку вместе с захваченными ЛП. Об этом свидете6льствует активация пролиферации макрофагов в интиме при появлении в ней мЛНП и миграция макрофагов из интимы в кровяное русло еще до превращения в «пенистые» клетки. Есть и другие пути избавления стенки сосуда от ХС [13]:
- гидроксилирование ХС и превращение его в более растворимые производные, которые клетка секретирует в окружающую среду.
- усиленный синтез макрофагами аполипопротеина Е и фосфолипидов с последующим образованием дискоидальных комплексов, способных связывать и удалять ХС из клетки.
- гидролиз ЭХС и удаление ненасыщенных эфиров холестерина при участии ЛВП.
- уменьшить содержание ХС и ЛНП в крови могут такие гормоны, как иодтиронины и эстрогены. Иодтиронины индуцируют на уровне транскрибции образование ЛНП-рецепторов и 7a-гидроксилазы печени – регуляторного фермента синтеза желчных кислот из ХС. Эстрогены ингибируют образование последнего фермента, но активируют синтез ЛНП-рецепторов и ГМГ-СоА-редуктазы печени (регуляторный фермент синтеза ХС) [2].
Одним из важных защитных механизмов можно считать действие различных АО, которые являются ингибиторами образования мЛНП.
Определение концентрации триглицеридов (ТГ) в сыворотке и плазме крови энзиматическим колориметрическим методом
 Тглицериды липаза глицерин + жирная кислота
Тглицериды липаза глицерин + жирная кислота
 Глицерин + АТФ глицерокиназа глицерил-3-фосфат +2 H2O
Глицерин + АТФ глицерокиназа глицерил-3-фосфат +2 H2O
 Глицерил-3-фосфат + O2 ГФО диоксиацетон фосфат +2 H2O
Глицерил-3-фосфат + O2 ГФО диоксиацетон фосфат +2 H2O
 H2O2 + 4-ААР + 4-хлорфенол пероксидаза хинонимин + 4H2O
H2O2 + 4-ААР + 4-хлорфенол пероксидаза хинонимин + 4H2O
Набор реагентов: TRIGLYCERIDES «E – D» («Vital-Diagnostics»)
ПРОВЕДЕНИЕ АНАЛИЗА
| Реагенты
| Опытные пробы, (мл.)
| Калибровочные пробы, (мл.)
| Контрольные пробы, (мл.)
|
| Сыворотка или плазма
| 0,02
| _
| _
|
| Физ. Раствор (H2O)
| _
| _
| 0,02
|
| Реагент
| 2,0
| 2,0
| 2,0
|
| Стандартный раствор
| _
| 0,02
| _
|
Реакционную смесь перемешивают и инкубируют не менее 5 мин при комнатной температуре (20-25°С) и измеряют оптическую плотность опытных и калибровочных проб против контрольной пробы в кювете с толщиной поглощающего слоя 5 см (1 см.) при длине волны 505 нм (ФЭК- 490 нм). Окраска стабильна не менее часа после окончания инкубации при предохранении от прямого солнечного света. (таблица).
Расчет концентрации триглицеридов проводят по формуле:
С = [Ео/Ест *250] – 10 (мг/100мл) или С = [Ео/Ест *2,85] – 0,11ммоль/л
Ео и Ест – экстинция образца и стандарта, измеряется относительно контрольной пробы. 10 мг/100мл (0,11ммоль/л) – поправка на содержание свободного глицерина в сыворотке (плазме крови).
Определение индекса атерогенности (ИА) расчетным методом
Расчет индекса атерогенности призводят по формуле:
ХСпл – £-ХС /£-ХС Х (ЭХС/СХС)
ХСпл – общий холестерол плазмы
£-ХС (альфа-ХС) – холестерол супернатанта (ЛПВП)
ЭХС/СХС – отношение содержания эфиросвязанного и свободного холестерола супернатанта плазмы [12].
Определение содержания малонового диальдегида (МДА) в эритроцитах
За основу взят классический метод Ernster et al [25] в модификации для эритроцитов. 0,5 мл гемолизата эритроцитов (1:1) смешивают с 1 мл охлажденной 5% ТХУ и тщательно растирают смесь стеклянной палочкой. После выдерживают при 0±5 °С не менее 1-2 часов смесь центрифугируют при 4000 g 30 мин. Далее тщательно отбирают 0,4мл надосадка в пробирки для кипячения и добавляют 1,0 мл 0,5% тиобарбитуровой кислоты. Смесь инкубируют в кипящей воде более 10 мин после чего охлаждают и фотометрируют при 532 нм против соответствующего контроля. В расчет принимают коэффициент молярной экститнции – 1,56*105 см-1 М-1. С(нмоль/мл эр) = ∆А * 115,8
Гистологический анализ
Выполняли для подтверждения наличия атеросклеротических изменений в опытных группах. Для гистологического исследования брали грудную и брюшную аорту, фиксировали 10% нейтральным формалином. Гистологическое исследование выполняли сотрудники гистологической лаборатории.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Признаки
Опытная 1
|
Опытная 2
| | %
| степень
| %
| степень
|
|
МИКРО-
Скопическое
Исследование
| Очаговые утолщения стенки в брюшном отделе
| 100
| ++
| 70
| +
|
| Очаговые утолщения стенки в грудном отделе
| 50
| +
| -
| -
|
| Наложения фибрина
| 100
| ++
| -
| -
|
| Склероз ветвей брюшной аорты
| 100
| +++
| 70
| ++
|
| Облитерация просвета ветвей брюшной аорты
| 40
| ++
| -
| -
|
Примечание: +++ сильно выражены, ++ умеренно выражены, + слабо выражены
У животных второй опытной группы при микро- и макроскопическом исследовании аорты все указанные изменения были выражены в меньшей степени.
Рисунок 2
Фиброзная бляшка в стенке брюшного отдела аорты (из препаратов 1 опытной группы), окраска гематоксилин-эозин х 250.

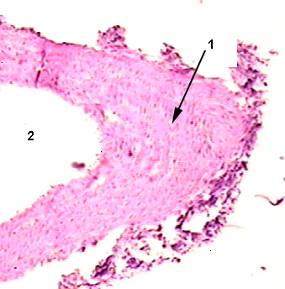
1- грубая соединительная ткань, сформированная фиброзная бляшка
2 – нарушение целостности эндотелия.
Обнаруживались лишь начальные признаки повреждения интимы и специфические «завихрения» в слое гладкомышечных волокон, ни в одном препарате не находили сформированных «бляшек», просвет ветвей аорты свободен, а в 30% случаев (у 3-х животных) признаков атеросклероза аорты вообще не выявлено.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Введение СП в сочетании с ПНЖК в атерогенный рацион оказало существенное влияние на развитие атеросклеротических процессов и на процессы ПОЛ. Вероятнее всего, это связано с антиоксидантными свойствами СП.
Липидограмма плазмы эксперементальных животных более наглядно показала действие СП, так как отличия второй опытной группы от первой было значительным. Концентрация ХСобщ, ХС-ЛНП и ХС-ЛОНП второй опытной группы была достоверно ниже, чем у животных первой опытной группы. Данные изменения в липидограмме, в совокупности с повышением ХС фракции ЛВП, можно трактовать как положительные, так как ЛНП и ЛОНП являются атерогенными, а ЛВП - антиатерогенными частицами. ЛВП осуществляют обратный транспорт ХС из периферических органов и тканей в печень для окисления в желчные кислоты и выведения с желчью [14]. Этим можно объяснить более низкую концентрацию ХСобщ у животных второй опытной группы в отличие от первой. Понижение концентрации ТГ объясняется снижением количества ЛОНП, которые являются транспортной формой эндогенных ТГ [14].
При исследовании продуктов ПОЛ было выявлено достоверное увеличение концентрации ДК в эритроцитах и печени, и снижение ДК в плазме у животных, получавших СМЛР. Это объясняется тем, что вдыхание кислорода приводит к десятикратному увеличению количества перекисей в печени [18], эритроциты же осуществляют транспорт кислорода и содержат мощный катализатор ПОЛ – гемоглобин [7]. Между тем, большинство тканей в норме содержит некоторое количество липидных перекисей [17]. Так, по данным Нейфаха и Кагана в печени, мозге, сальнике крыс обнаруживается от 15 до 80 нмолей перекисей на 1 г липидов или от 1 до 4,5 нмоль перекисей на 1 г ткани [18]. Следовательно, концентрация ДК, как первичных продуктов ПОЛ, высока именно в печени и эритроцитах. Накопление ДК в клетках приводит к тому, что в мембранах появляются участки («поры»), через которые наружу выходит содержимое самих клеток и органелл, а в эритроцитах возрастает перекисный и осмотический гемолиз. ДК являются неустойчивыми и через образование липоперекисей превращаются в МДА [12]. СП взаимодействует именно с перекисями жирных кислот, причем это взаимодействие имеет двойной характер. Во-первых, в нашем исследовании была показана способность СП тормозить накопление перекисей жирных кислот, а ранее автором соединения [3] было показано, что увеличение содержания перекисей в системе приводит к рециклизации соединения, протоны расходуются на инактивацию перекисей и обрыв цепи свободнорадикального окисления. При дальнейшем разрыве ковалентных связей в системе микросомального окисления с участием ферментов цитохрома р -450 из состава СП высвобождается восстановленный селен, который участвует в образовании селеноцистеина и таким образом стимулирует синтез глутатионпероксидазы [4] – главного внутри- и внеклеточного фермента, обезвреживающего липопероксиды. Таким образом, при обрыве цепи и инактивации липопероксидов, следующая степень повреждения жирных кислот – образование МДА – не наступает, чем и объясняется достоверно более низкое содержание МДА в печени и эритроцитах у животных второй опытной группы.
По результатам гистологического анализа у животных первой опытной группы были обнаружены сформировавшиеся фиброзные бляшки в отличие от второй опытной группы, у которой были найдены только липидные пятна. Большинство морфологов считают, что развитие атеросклероза протекает по схеме: липидные пятна или полоски Ò фиброзные бляшки Òосложненные поражения (изъязвления, кальциноз, тромбоз), хотя отдельные авторы не исключают возможности образования фиброзных бляшек без предварительного формирования липидных пятен [5], но так же известно и то, что липидные пятна могут исчезнуть, если произойдет значительное и длительное снижение уровня ХС и ЛНП в плазме крови, и достигнутый уровень будет поддерживаться на протяжении полутора-двух лет у людей [14]. Важную роль в регрессии играют так же ЛВП, благодаря их способности осуществлять транспорт ХС в печень [14]. Можно предположить, что время опыта было слишком мало для того, чтобы увидеть, какие изменения произойдут с липидными пятнами во второй опытной группе, но даже полученные данные подтверждают положительное действие СМЛР. Возможно, СМЛР в сочетании с физическими нагрузками имела бы более выраженный положительный эффект, так как из-за малой подвижности у экспериментальных животных наблюдалось ожирение [14].
ВЫВОДЫ
1. В исследованиях in vitro доказано, что селенопиран, благодаря электроно- и водорододонорным свойствам, обладает способностью тормозить накопление пероксидов в системе нерафинированных растительных масел с различным содержанием полиненасыщенных жирных кислот в большей степени, чем бутилокситолуол и токоферол.
2. Введение в высокожировой рацион экспериментальных животных смеси масел льна и расторопши с селенопираном способствует торможению атеросклеротических процессов: снижению концентрации холестерина и атерогенных липопротеидов в плазме крови, повышению содержания антиатерогенных липопротеидов.
3. Полученные данные свидетельствуют о стабилизации перекисных процессов в липопротеидах низкой и очень низкой плотности, что подтверждается положительной корреляцией между показателями содержания диеновых конъюгатов плазмы и холестерина в липопротеидах низкой и очень низкой плотности.
4. Гистологический анализ препаратов аорты подтверждает полученные биохимические данные, и свидетельствует о значительном торможении развития морфологических изменений, вызванных атерогенной диетой, при внесении в нее испытуемой смеси масел льна и расторопши с селенопираном.
СПИСОК ЛИТЕРАТУРЫ
1. Абрамова Ж.И., Оксенгендлер Г.И. Человек и противоокислительные вещества. – Л.: Наука, 1985.-232с.
2. Биохимические основы патологических процессов / Под ред. Е.С. Северина / – М.: Медицина, 2000. –304 с.
3. Боряев Г.И., Жуков О.И., Блинохватов А.Ф., Древко Б.И. Оценка антиоксидантной активности селен органических соединений // Сб. науч. трудов Саратовского университета. – Саратов, 1996. – С.199.
4. Боряев Г.И., Галочкин В.А., Блинохватов А.Ф. Функциональная активность монооксигеназной системы печени цыплят – бройлеров при введение в рацион селеноорганического соединения СП-1 // Бюлл.ВНИИФБиП с.-х. животных. – 1990. – Вып.3 (99). – С.70-73.
5. Вихтер А. М. Атеросклероз // Руководство по кардиологии / Под ред. Е. И.Чазова. – М.: Медицина, 1982. – Т. 1. – С. 417 - 443.
6. Владимиров Ю.А., Азизова О.А., Деев А.И. и др. Свободные радикалы в живых системах // Итоги науки и техники. Сер. Биофизика. - Т.29. - М., 1991. - С.1-249.
7. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. - М.: Наука, 1972. - С.237-238.
8. Владимиров Ю.А. Свободные радикалы в биологических системах // Соросовский образовательный журнал. - 2000. - Т.6. - №12. - С.13-19
9. Гаврилов В.Б., Мишкорудная М.И. // Лаб. дело. - 1983. -№3. - С.33-35.
10. Гильмиярова Ф.Н. Патент РФ № 2131672, кл. А 23 D 9/00, 1998.
11. Зенков Н.К., Ланкин В.З., Меньщикова ЕБ. Окислительный стресс: Биохимический и патофизиологический аспекты. – М.:МАИК «Наука\Интерпереодика», 2001.-343 с.
12. Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике. В 2 т. – Минск: Беларусь, 2000. - Т.1-2
13. Климов А.Н., Никульчева Н.Г Липиды и липопротеиды и атеросклероз. – СПб.: Питер, 1995.–298с.
14. Климов А.Н., Никульчева Н.Г. Обмен липидов и липопротеидов и его нарушения. - С-Пб: «Питер – Ком», 1999.–512с.
15. Кравченко Ю.В. Экспериментальное исследование системы антиоксидантной защиты на этапах онтогенеза при токсическом и алиментарном воздействии: // Дис. к.б.н.-М., 2005
16. Ланкин В.З., Вихерт А.М., Тихазе А.К. и др. Роль перекисного окисления липидов в этиологии и патогенезе атеросклероза // Вопр. мед. химии. - 1989. -№3. - С.18-24.
17. Нейфах ЕА Биофизика. – 1971. - С.16-560.
18. Нейфах ЕА., Каган ВЕ. Биохимия. – 1969. - С.34-511.
19. Соколовский В.В. Тиолдисульфидное соотношение крови как показатель состояния неспецефической резистентности организма: Учебное пособие. – С-Пб., 1996.-30 с.
20. Aviram M. Modified forms of low-density lipoprotein and atherogenesis // Atherosclerosis.-1993. - Vol.98.- P.1-9.
21. Brown M.S., Goldstein J.L. Lipoprotein metabolism in the macrophage: implication for cholesterol deposition in atherosclerosis // Annu. Rev. Biochem. - 1983. - Vol.52.- P.223-261.
22. Burton G., Ingold K. Vitamin E: application of the principles of physical organic chemistry to the exploration of its structure and function. // Acc. Chem. Res. – 1986. - Vol.19.- P.194 -201
23. Cthcart M.K., Menally A.K., Morel D.W., Chisolm G.M. Superoxid anion participation in human monocyte-mediated oxidation of low-density lipoprotein and conversion of low-density lipoprotein to a cytotoxin // J. Immunol. - 1989. -Vol.142. - P1963-1969.
24. Doba T., Burton G., Ingold K. Antioxidant and co- antioxidant activity of vitamin C. The effect of vitamin C, either alone or in the presence of vitamin E analogue, upon the peroxidation of agueous multilamellarphospholipid liposomes. // Biochem. biophys. аcta.- 1985. - Vol.835. - P.298 -303.
25. Ernster L, Nordenbrandt K. Microsomal lipid peroxidation // Methods Enzymol., 1967. - Vol. 10. - P. 575-576.
26. Fan Y.Y., Chapkin R.S. Importance of Dietory γ-Linolenic Acid in Human Health and Nutrition // The Journal of Nutrition. – 1998. – Vol.128. – P.1411-1414.
27. Frenoux J-M.R., Prost E.D., Belleville J.L., Prost J.L. A Polyunsaturated Fatty Acid How us Blood Pressure and Improves Antioxidant Status in Spontaneously Hypertensive Rats // The Journal of Nutrition – 2001. – Vol.131. – Р.39-45.
28. Halliwel B. Oxidation of low-density lipoproteins: guestions of initiation, propagation, and the effect of antioxidants // Amer. J. Clin. Nutr. - 1995. - Vol.61 (suppl). - P.670S-677S.
29. Henning B., Chow C.K. Lipid peroxidation and endothelial cell injury: Implications in atherosclerosis. Review // Free Radical Biol. and Med. - 1988. - Vol.4. - P.99-105.
30. Michara M., Uchiyama M., Fukuzava K. Thiobarbituric acid value on fresh homogenate of rat as a parameter of lipid peroxidation in aging, CCL4 intoxication, аnd vitamin E deficiency // Biochem. Med. 1980. - Vol. 23 (3). P. 302-311.
31. Nair S.D., Leitch J.W., Falconer J., Gard M.L. Prevention of Cardiac Arrhythmia by Dietory (n-3) Poly un saturated Fatty Acid and Their Mechanism of Action // The Journal of Nutrition – 1997. – Vol.127. – Р.383-393.
32. Park E., Thomas J. The mechanisms of reduction of protein mixed disulfides (dethiolation) in cardiac tissue. // Arch. Biochem. Biophys. – 1989. - Vol.274 (1). - P.47 -54.
33. Parthasarathy S., Steiberg D., Witzturm J.L. The role of oxidized low-density lipoprotein in the pathogenesis of atherosclerosis // Annu. Rev. Med. - 1992. - Vol.43. - P.219-225.
34. Pitas R.E. Expression of the acetyl low-density lipoprotein receptor by rabbit fibroblasts and smooth muscle cells. Up-regulation by phorbol esters // J. Biol. Chem. -1990. - Vol.265. - P.12722 -12727.
35. Sakai M., Miyazaki A., Hakamata H. et al. The scavenger receptor serves as a route for internalization of lysophospatidilcholine in oxidized low density lipoprotein - induced macrophage proliferation // J. Biol. Chen. – 1996. - Vol.271. - P.27346 -27352.
36. Schwarz K., Porter L.A., Fredga A. Some regularities in the structure-function relationship of organoselenium compounds effective against dietary liver necrosis // Ann.N.Y.Acad.Sci. – 1972. – Vol.14. – Р.192-200.
37. Steinbrecher U.P., Zang H.F., Lougheed M. Role of oxidatively modified LDL in atherosclerosis // Free Radical Biol. and Med. - 1990. - Vol.9. - P.155-168.
38. Yla-Herttuala S. Macrophages and oxidized low-density lipoprotein in the pathogenesis of atherosclerosis // Ann. Med. - 1991. - Vol.23. - P.561 -566.
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Пензенский государственный педагогический университет
Имени В.Г. Белинского
Факультет Кафедра
Естественно-географический Биохимии
ДИПЛОМНАЯ РАБОТА НА ТЕМУ:
Антиатеросклеротическое действие смеси масел льна и расторопши с селенопираном
Студент________________________________________Краснова Ю.В.
Руководитель___________________________________Петрушова О. П.
________________Кравченко Ю. В.
К защите допустить. Протокол № от «_____» ____________2007 г.
Зав. Кафедрой______________________________________Генгин М. Т.
Пенза, 2007 год
СПИСОК СОКРАЩЕНИЙ
АО - антиоксиданты
АКМ – активные кислородные метаболиты
АС - атеросклероз
БОТ – бутилокситолуол
ВЖР – высокожировой рацион
ГМК - гладкомышечные клетки
ДК – диеновые коньюгаты
ИА - индекс атерогенности
ЛНП – липопротеиды низкой плотности
ЛОНП - липопротеиды очень низкой плотности
ЛП – липопротеиды
ЛВП - липопротеиды высокой плотности
мГМК - модифицированные ГМК
МДА – малоновый диальдегид
мЛНП - модифицированные ЛНП
ПНЖК – полиненасыщенные жирные кислоты
ПОЛ – перекисное окисление липидов
СМЛР - смеси масел льна и расторопши с селенопираном
СП - селенопиран
ТГ - триглицеридов
ТФ - токоферол
ХС - холестерин
ХС- ЛВП – холестерин липопротеидов высокой плотности
ХС- ЛНП - холестерин липопротеидов низкой плотности
ХС- ЛОНП - холестерин липопротеидов очень низкой плотности
ХСобщ - общий холестерин
ЭХС – эфиры холестерина
ВВЕДЕНИЕ
В настоящее время в диетотерапии и профилактике различных заболеваний, особенно сердечно-сосудистой системы, широко используются полиненасыщенные жирные кислоты (ПНЖК) семейства Омега-3. В многочисленных клинических и экспериментальных исследованиях выявлен положительный эффект применения данных жирных кислот, связанный с их влиянием на липидный обмен, иммунологическую реактивность и механизмы свертывания крови. Большинство подобных исследований [26, 27, 31] посвящено изучению эффективности ПНЖК, входящих в состав рыбных жиров. Растительным жирам в этом смысле уделено гораздо меньше внимания, хотя традиционным в России сырьем для получения масла, богатого альфа-линоленовой кислотой (семейства Омега-3), является семя льна. Комбинируя масло семян льна с другими растительными маслами, можно добиться оптимального соотношения ПНЖК класса Омега-3 и Омега-6, рекомендованного для целей диетотерапии. Существенным недостатком пищевого масла, богатого ПНЖК, является низкий срок хранения из-за высокой способности этих жирных кислот к окислению, поэтому актуальным является поиск способа стабилизации продукта. Второй аспект проблемы заключается в биологической целесообразности употребления такого масла. Известно, что в условиях недостатка в организме антиоксидантов поступление в него ПНЖК может приводить к индукции перекисного окисления липидов [36]. Решением этих вопросов может служить введение в композицию масла расторопши пятнистой с комплексом флаволигнанов [10] и синтетического антиоксиданта (АО). В качестве жирорастворимого АО в данной работе исследовалось органическое соединение селена – 9-фенил-симметричный октагидроселеноксантен (селенопиран – СП). Обладая высокой водородо- и электронодонорной активностью, данное соединение препятствует образованию перекисей [3]. Кроме того, СП в живом организме подвергается метаболизации в системе микросомального окисления [4], после чего из него высвобождается атом селена, встраивающийся в селенопротеины, основной функцией которых является антиоксидантная защита.
Целью нашей работы было исследование антиоксидантных свойств селенопирана in vitro, а также изучение антиатеросклеротического действия смеси масел льна и расторопши, стабилизированной селенопираном при моделировании экспериментального атеросклероза.
При выполнении работы были поставлены следующие задачи:
Исследовать количество липидов плазмы крови и их соотношение.
1. Изучить влияние смеси масел льна и расторопши, стабилизированной селенопираном, на процессы перекисного окисления липидов.
2. Выявить влияние смеси масел льна и расторопши, стабилизированной селенопираном, на процесс атерогенеза.
Научная новизна. Впервые выявлено антиатеросклеротическое действие смеси масел льна и расторопши, стабилизированной селенопираном in vivo при моделировании экспериментального атеросклероза. Выявлены различия действия исследуемого масла в клетках (эритроцитах, печени) и плазме крови.
Апробация работы. Материалы работы доложены на Научной студенческой конференции ПГПУ им. В.Г. Белинского.
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
Атеросклероз (АС) – патологическое изменение внутреннего слоя (интимы) и мышечного слоя (медии) артерии. Слово образовано от греч. «атере» - кашица, основной компонент которой – эфиры холестерина (ЭХС), включенные в уплотненную склерозированную бляшку [2]. Клиническими проявлениями АС являются различные широко распространенные сосудистые заболевания разных органов: сердца, аорты, головного мозга, почек, нижних конечностей. Атеросклеротическая бляшка затрудняет кровоток и вызывает ишемию и гипоксию органа, а при полной закупорке сосуда бляшкой или индуцированным ею тромбом возникают грозные осложнения АС: инфаркт миокарда, инсульт, гангрена конечностей [2].
1.1.Биохимические ОСНОВЫ ПАТОГЕНЕЗА АТЕРОСКЛЕРОЗА
По мере накопления экспериментальных данных по атеросклерозу, возникли разные гипотезы об этиологии заболевания и патогенезе. Все гипотезы связаны с транспортом липопротеидов (ЛП) и холестерина (ХС) в сосудистую стенку. Повышенный уровень ХС является, бесспорно, главным патогенетическим фактором развития атеросклероза, существенную роль играют и другие факторы риска: факторы повреждения эндотелия (инфекции, воспаления, гипертония, токсические факторы, например никотин, высокие содержания липопротеинов низкой плотности (ЛНП) и липопротеинов очень низкой плотности (ЛОНП), повышенная свертываемость крови, гемодинамические факторы (бляшки возникают в местах изгибов, ветвления, стенозов сосудов) и изменение содержания гормонов, но, пожалуй, важнейшим фактором можно назвать химическую и физико-химическую модификацию ЛНП (гликозилирование, перикисное окисление ХС и ПНЖК в ЛНП, десиалирование, частичный протеолиз, агрегация) [2].
В состав атеросклеротических бляшек входят: ЭХС, триацилглицерины, гликозаминогликаны, коллаген, эластин, кальций, макрофаги, модифицированные гладкомышечные клетки (мГМК), погибшие клетки. В атеросклеротических бляшках с большой частотой обнаруживаются ДНК герпесвирусов (цитомегаловируса и простого герпеса), а также хламидии. Роль этих микроорганизмов о



 Тглицериды липаза глицерин + жирная кислота
Тглицериды липаза глицерин + жирная кислота Глицерин + АТФ глицерокиназа глицерил-3-фосфат +2 H2O
Глицерин + АТФ глицерокиназа глицерил-3-фосфат +2 H2O Глицерил-3-фосфат + O2 ГФО диоксиацетон фосфат +2 H2O
Глицерил-3-фосфат + O2 ГФО диоксиацетон фосфат +2 H2O  H2O2 + 4-ААР + 4-хлорфенол пероксидаза хинонимин + 4H2O
H2O2 + 4-ААР + 4-хлорфенол пероксидаза хинонимин + 4H2O



