Результаты комплексного биохимического и гистологического анализа биоматериала, полученного от экспериментальных животных, свидетельствуют о существенном торможении развития атеросклеротических процессов при введении СМЛР в качестве добавки к ВЖР.
Достоверные различия между опытными группами обнаруживались как в количестве липидов плазмы крови, так и в их соотношении (Таблица 2). В первой опытной группе наблюдались характерные признаки нарушения липидного обмена: повышение ХСобщ на 54% и ХС-ЛНП на 350 % по сравнению с контрольной группой, на фоне снижения содержания ХС-ЛВП на 57 %. При этом ИА повышался до 6,29 по сравнению с 1,03 в контроле. Введение в ВЖР животных второй опытной группы СМЛР привело к торможению накопления в плазме ХС, снижение на 38 % и снижение концентрации ХС атерогенных ЛП: ХС-ЛНП на 272% и ХС-ЛОНП на 55% по сравнению с контролем, а также к повышению содержания ХС-ЛВП 42%, что отразилось на величине ИА – 3,91.
Таблица 2
Липидограмма плазмы экспериментальных животных
| Группа
| ТГ
ммоль/л
| ХС общ.,
ммоль/л
| ХС-ЛВП, ммоль/л
| ХС-ЛНП,
ммоль/л
| ХС-ЛОНП,
ммоль/л
| Индекс
Атероген.,
у.е.
|
| Контроль
n=10
| 0,906±
0,031
| 1,74±
0,052
| 0,858±
0,024
| 0,459±
0,049
| 0,421±
0,019
| 1,03±
0,069
|
| Опытная 1
n=10
| 0,512# ±
0,044
| 2,68# ±
0,083
| 0,372# ±
0,01
| 2,07# ±
0,08
| 0,240# ±
0,018
| 6,29# ±
0,393
|
| Опытная 2
n=10
| 0,442#±
0,015
| 2,40# * ±
0,083
| 0,496# * ±
0,025
| 1,71# * ±
0,077
| 0,191# * ±
0,007
| 3,91# * ±
0,235
|
Примечание: * - p<0,05 относительно опытной группы 1
# - p<0,05 относительно контрольной группы
Было также установлено, что применение СМЛР существенно влияло на процессы ПОЛ. Выявлено достоверное снижение ДК плазмы на 12%, МДА эритроцитов на 37% и печени на 11% животных второй опытной группы по сравнению с животными, не получавшими СМЛР (Таблица 3).
Таблица 3
Содержание ДК и МДА в плазме, эритроцитах и печени экспериментальных животных
| Группа
| ДК плазмы, нмоль/мл
| ДК эритроц., нмоль/мл
| ДК печени, нмоль/г
| МДА плазмы, нмоль/мл
| МДА эритроц., нмоль/мл
| МДА печени, нмоль/г
|
| Контроль
n=10
| 3,06±
0,097
| 13,2±
0,482
| 47,0±
1,14
| 11,6±
0,068
| 53,8±
0,914
| 36,7±
0,656
|
| Опытная 1
n=10
| 3,24±
0,101
| 14,3# ±
0,168
| 85,5#±
3,21
| 13,4# ±
0,107
| 54,2±
3,30
| 50,6#±
1,52
|
| Опытная 2
n=10
| 2,68 # * ±
0,127
| 16,3# * ±
0,655
| 87,9±
2,32
| 13,1±
0,051
| 33,9 # * ±
1,48
| 32,8# *±
0,362
|
Примечание: * - p<0,05 относительно опытной группы 1
# - p<0,05 относительно контрольной группы
ГИСТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ПРЕПАРАТОВ АОРТЫ ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ
Результаты гистологического исследования препаратов аорты представлены в таблице 4. При макроскопическом исследовании аорты у 100% животных первой опытной группы наблюдали умеренно выраженные уплотнения в брюшном и грудном отделе аорты и снижение эластичности стенки аорты.
При микроскопическом исследовании аорты животных первой опытной группы во всех образцах обнаружен склероз ветвей брюшной отдела у 100% с наложением фибрина у 100% и частичной облитерацией их просвета у 40 %. При исследовании грудного отдела аорты выявлены слабо выраженные очаговые утолщения стенки у 50 %. В целом в препаратах аорты наблюдали признаки атеросклероза в стадии сформированной фиброзной бляшки (Рис. 2).
Таблица 4
Макро- и микроскопические изменения стенки аорты экспериментальных животных
Признаки
Опытная 1
|
Опытная 2
| | %
| степень
| %
| степень
|
|
МАКРО-скопическое исследование
| Уплотнения в брюшном отделе
| 100
| ++
| 70
| +
|
| Уплотнения в грудном отделе
| 100
| ++
| -
| -
|
| Снижение эластичности стенки
| 100
| ++
| 70
| +
|
|
МИКРО-
Скопическое
Исследование
| Очаговые утолщения стенки в брюшном отделе
| 100
| ++
| 70
| +
|
| Очаговые утолщения стенки в грудном отделе
| 50
| +
| -
| -
|
| Наложения фибрина
| 100
| ++
| -
| -
|
| Склероз ветвей брюшной аорты
| 100
| +++
| 70
| ++
|
| Облитерация просвета ветвей брюшной аорты
| 40
| ++
| -
| -
|
Примечание: +++ сильно выражены, ++ умеренно выражены, + слабо выражены
У животных второй опытной группы при микро- и макроскопическом исследовании аорты все указанные изменения были выражены в меньшей степени.
Рисунок 2
Фиброзная бляшка в стенке брюшного отдела аорты (из препаратов 1 опытной группы), окраска гематоксилин-эозин х 250.

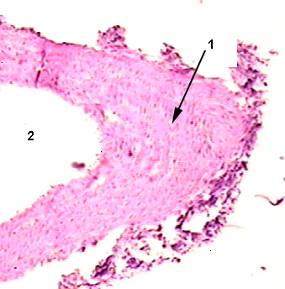
1- грубая соединительная ткань, сформированная фиброзная бляшка
2 – нарушение целостности эндотелия.
Обнаруживались лишь начальные признаки повреждения интимы и специфические «завихрения» в слое гладкомышечных волокон, ни в одном препарате не находили сформированных «бляшек», просвет ветвей аорты свободен, а в 30% случаев (у 3-х животных) признаков атеросклероза аорты вообще не выявлено.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Введение СП в сочетании с ПНЖК в атерогенный рацион оказало существенное влияние на развитие атеросклеротических процессов и на процессы ПОЛ. Вероятнее всего, это связано с антиоксидантными свойствами СП.
Липидограмма плазмы эксперементальных животных более наглядно показала действие СП, так как отличия второй опытной группы от первой было значительным. Концентрация ХСобщ, ХС-ЛНП и ХС-ЛОНП второй опытной группы была достоверно ниже, чем у животных первой опытной группы. Данные изменения в липидограмме, в совокупности с повышением ХС фракции ЛВП, можно трактовать как положительные, так как ЛНП и ЛОНП являются атерогенными, а ЛВП - антиатерогенными частицами. ЛВП осуществляют обратный транспорт ХС из периферических органов и тканей в печень для окисления в желчные кислоты и выведения с желчью [14]. Этим можно объяснить более низкую концентрацию ХСобщ у животных второй опытной группы в отличие от первой. Понижение концентрации ТГ объясняется снижением количества ЛОНП, которые являются транспортной формой эндогенных ТГ [14].
При исследовании продуктов ПОЛ было выявлено достоверное увеличение концентрации ДК в эритроцитах и печени, и снижение ДК в плазме у животных, получавших СМЛР. Это объясняется тем, что вдыхание кислорода приводит к десятикратному увеличению количества перекисей в печени [18], эритроциты же осуществляют транспорт кислорода и содержат мощный катализатор ПОЛ – гемоглобин [7]. Между тем, большинство тканей в норме содержит некоторое количество липидных перекисей [17]. Так, по данным Нейфаха и Кагана в печени, мозге, сальнике крыс обнаруживается от 15 до 80 нмолей перекисей на 1 г липидов или от 1 до 4,5 нмоль перекисей на 1 г ткани [18]. Следовательно, концентрация ДК, как первичных продуктов ПОЛ, высока именно в печени и эритроцитах. Накопление ДК в клетках приводит к тому, что в мембранах появляются участки («поры»), через которые наружу выходит содержимое самих клеток и органелл, а в эритроцитах возрастает перекисный и осмотический гемолиз. ДК являются неустойчивыми и через образование липоперекисей превращаются в МДА [12]. СП взаимодействует именно с перекисями жирных кислот, причем это взаимодействие имеет двойной характер. Во-первых, в нашем исследовании была показана способность СП тормозить накопление перекисей жирных кислот, а ранее автором соединения [3] было показано, что увеличение содержания перекисей в системе приводит к рециклизации соединения, протоны расходуются на инактивацию перекисей и обрыв цепи свободнорадикального окисления. При дальнейшем разрыве ковалентных связей в системе микросомального окисления с участием ферментов цитохрома р -450 из состава СП высвобождается восстановленный селен, который участвует в образовании селеноцистеина и таким образом стимулирует синтез глутатионпероксидазы [4] – главного внутри- и внеклеточного фермента, обезвреживающего липопероксиды. Таким образом, при обрыве цепи и инактивации липопероксидов, следующая степень повреждения жирных кислот – образование МДА – не наступает, чем и объясняется достоверно более низкое содержание МДА в печени и эритроцитах у животных второй опытной группы.
По результатам гистологического анализа у животных первой опытной группы были обнаружены сформировавшиеся фиброзные бляшки в отличие от второй опытной группы, у которой были найдены только липидные пятна. Большинство морфологов считают, что развитие атеросклероза протекает по схеме: липидные пятна или полоски Ò фиброзные бляшки Òосложненные поражения (изъязвления, кальциноз, тромбоз), хотя отдельные авторы не исключают возможности образования фиброзных бляшек без предварительного формирования липидных пятен [5], но так же известно и то, что липидные пятна могут исчезнуть, если произойдет значительное и длительное снижение уровня ХС и ЛНП в плазме крови, и достигнутый уровень будет поддерживаться на протяжении полутора-двух лет у людей [14]. Важную роль в регрессии играют так же ЛВП, благодаря их способности осуществлять транспорт ХС в печень [14]. Можно предположить, что время опыта было слишком мало для того, чтобы увидеть, какие изменения произойдут с липидными пятнами во второй опытной группе, но даже полученные данные подтверждают положительное действие СМЛР. Возможно, СМЛР в сочетании с физическими нагрузками имела бы более выраженный положительный эффект, так как из-за малой подвижности у экспериментальных животных наблюдалось ожирение [14].
ВЫВОДЫ
1. В исследованиях in vitro доказано, что селенопиран, благодаря электроно- и водорододонорным свойствам, обладает способностью тормозить накопление пероксидов в системе нерафинированных растительных масел с различным содержанием полиненасыщенных жирных кислот в большей степени, чем бутилокситолуол и токоферол.
2. Введение в высокожировой рацион экспериментальных животных смеси масел льна и расторопши с селенопираном способствует торможению атеросклеротических процессов: снижению концентрации холестерина и атерогенных липопротеидов в плазме крови, повышению содержания антиатерогенных липопротеидов.
3. Полученные данные свидетельствуют о стабилизации перекисных процессов в липопротеидах низкой и очень низкой плотности, что подтверждается положительной корреляцией между показателями содержания диеновых конъюгатов плазмы и холестерина в липопротеидах низкой и очень низкой плотности.
4. Гистологический анализ препаратов аорты подтверждает полученные биохимические данные, и свидетельствует о значительном торможении развития морфологических изменений, вызванных атерогенной диетой, при внесении в нее испытуемой смеси масел льна и расторопши с селенопираном.
СПИСОК ЛИТЕРАТУРЫ
1. Абрамова Ж.И., Оксенгендлер Г.И. Человек и противоокислительные вещества. – Л.: Наука, 1985.-232с.
2. Биохимические основы патологических процессов / Под ред. Е.С. Северина / – М.: Медицина, 2000. –304 с.
3. Боряев Г.И., Жуков О.И., Блинохватов А.Ф., Древко Б.И. Оценка антиоксидантной активности селен органических соединений // Сб. науч. трудов Саратовского университета. – Саратов, 1996. – С.199.
4. Боряев Г.И., Галочкин В.А., Блинохватов А.Ф. Функциональная активность монооксигеназной системы печени цыплят – бройлеров при введение в рацион селеноорганического соединения СП-1 // Бюлл.ВНИИФБиП с.-х. животных. – 1990. – Вып.3 (99). – С.70-73.
5. Вихтер А. М. Атеросклероз // Руководство по кардиологии / Под ред. Е. И.Чазова. – М.: Медицина, 1982. – Т. 1. – С. 417 - 443.
6. Владимиров Ю.А., Азизова О.А., Деев А.И. и др. Свободные радикалы в живых системах // Итоги науки и техники. Сер. Биофизика. - Т.29. - М., 1991. - С.1-249.
7. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. - М.: Наука, 1972. - С.237-238.
8. Владимиров Ю.А. Свободные радикалы в биологических системах // Соросовский образовательный журнал. - 2000. - Т.6. - №12. - С.13-19
9. Гаврилов В.Б., Мишкорудная М.И. // Лаб. дело. - 1983. -№3. - С.33-35.
10. Гильмиярова Ф.Н. Патент РФ № 2131672, кл. А 23 D 9/00, 1998.
11. Зенков Н.К., Ланкин В.З., Меньщикова ЕБ. Окислительный стресс: Биохимический и патофизиологический аспекты. – М.:МАИК «Наука\Интерпереодика», 2001.-343 с.
12. Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике. В 2 т. – Минск: Беларусь, 2000. - Т.1-2
13. Климов А.Н., Никульчева Н.Г Липиды и липопротеиды и атеросклероз. – СПб.: Питер, 1995.–298с.
14. Климов А.Н., Никульчева Н.Г. Обмен липидов и липопротеидов и его нарушения. - С-Пб: «Питер – Ком», 1999.–512с.
15. Кравченко Ю.В. Экспериментальное исследование системы антиоксидантной защиты на этапах онтогенеза при токсическом и алиментарном воздействии: // Дис. к.б.н.-М., 2005
16. Ланкин В.З., Вихерт А.М., Тихазе А.К. и др. Роль перекисного окисления липидов в этиологии и патогенезе атеросклероза // Вопр. мед. химии. - 1989. -№3. - С.18-24.
17. Нейфах ЕА Биофизика. – 1971. - С.16-560.
18. Нейфах ЕА., Каган ВЕ. Биохимия. – 1969. - С.34-511.
19. Соколовский В.В. Тиолдисульфидное соотношение крови как показатель состояния неспецефической резистентности организма: Учебное пособие. – С-Пб., 1996.-30 с.
20. Aviram M. Modified forms of low-density lipoprotein and atherogenesis // Atherosclerosis.-1993. - Vol.98.- P.1-9.
21. Brown M.S., Goldstein J.L. Lipoprotein metabolism in the macrophage: implication for cholesterol deposition in atherosclerosis // Annu. Rev. Biochem. - 1983. - Vol.52.- P.223-261.
22. Burton G., Ingold K. Vitamin E: application of the principles of physical organic chemistry to the exploration of its structure and function. // Acc. Chem. Res. – 1986. - Vol.19.- P.194 -201
23. Cthcart M.K., Menally A.K., Morel D.W., Chisolm G.M. Superoxid anion participation in human monocyte-mediated oxidation of low-density lipoprotein and conversion of low-density lipoprotein to a cytotoxin // J. Immunol. - 1989. -Vol.142. - P1963-1969.
24. Doba T., Burton G., Ingold K. Antioxidant and co- antioxidant activity of vitamin C. The effect of vitamin C, either alone or in the presence of vitamin E analogue, upon the peroxidation of agueous multilamellarphospholipid liposomes. // Biochem. biophys. аcta.- 1985. - Vol.835. - P.298 -303.
25. Ernster L, Nordenbrandt K. Microsomal lipid peroxidation // Methods Enzymol., 1967. - Vol. 10. - P. 575-576.
26. Fan Y.Y., Chapkin R.S. Importance of Dietory γ-Linolenic Acid in Human Health and Nutrition // The Journal of Nutrition. – 1998. – Vol.128. – P.1411-1414.
27. Frenoux J-M.R., Prost E.D., Belleville J.L., Prost J.L. A Polyunsaturated Fatty Acid How us Blood Pressure and Improves Antioxidant Status in Spontaneously Hypertensive Rats // The Journal of Nutrition – 2001. – Vol.131. – Р.39-45.
28. Halliwel B. Oxidation of low-density lipoproteins: guestions of initiation, propagation, and the effect of antioxidants // Amer. J. Clin. Nutr. - 1995. - Vol.61 (suppl). - P.670S-677S.
29. Henning B., Chow C.K. Lipid peroxidation and endothelial cell injury: Implications in atherosclerosis. Review // Free Radical Biol. and Med. - 1988. - Vol.4. - P.99-105.
30. Michara M., Uchiyama M., Fukuzava K. Thiobarbituric acid value on fresh homogenate of rat as a parameter of lipid peroxidation in aging, CCL4 intoxication, аnd vitamin E deficiency // Biochem. Med. 1980. - Vol. 23 (3). P. 302-311.
31. Nair S.D., Leitch J.W., Falconer J., Gard M.L. Prevention of Cardiac Arrhythmia by Dietory (n-3) Poly un saturated Fatty Acid and Their Mechanism of Action // The Journal of Nutrition – 1997. – Vol.127. – Р.383-393.
32. Park E., Thomas J. The mechanisms of reduction of protein mixed disulfides (dethiolation) in cardiac tissue. // Arch. Biochem. Biophys. – 1989. - Vol.274 (1). - P.47 -54.
33. Parthasarathy S., Steiberg D., Witzturm J.L. The role of oxidized low-density lipoprotein in the pathogenesis of atherosclerosis // Annu. Rev. Med. - 1992. - Vol.43. - P.219-225.
34. Pitas R.E. Expression of the acetyl low-density lipoprotein receptor by rabbit fibroblasts and smooth muscle cells. Up-regulation by phorbol esters // J. Biol. Chem. -1990. - Vol.265. - P.12722 -12727.
35. Sakai M., Miyazaki A., Hakamata H. et al. The scavenger receptor serves as a route for internalization of lysophospatidilcholine in oxidized low density lipoprotein - induced macrophage proliferation // J. Biol. Chen. – 1996. - Vol.271. - P.27346 -27352.
36. Schwarz K., Porter L.A., Fredga A. Some regularities in the structure-function relationship of organoselenium compounds effective against dietary liver necrosis // Ann.N.Y.Acad.Sci. – 1972. – Vol.14. – Р.192-200.
37. Steinbrecher U.P., Zang H.F., Lougheed M. Role of oxidatively modified LDL in atherosclerosis // Free Radical Biol. and Med. - 1990. - Vol.9. - P.155-168.
38. Yla-Herttuala S. Macrophages and oxidized low-density lipoprotein in the pathogenesis of atherosclerosis // Ann. Med. - 1991. - Vol.23. - P.561 -566.







