Экологические изменения. Изменения климата. Изменения человеческой демографии и поведения людей. Международный туризм и коммерция. Технологии и индустрии. Опасные эксперименты. Пищевые технологии. Улучшение диагностики. Микробные адаптации и изменения. Разрушение общественного здравоохранения и недостаточное развитие его инфраструктуры.
«Новыми» называются инфекционные болезни, недавно возникшие в популяциях людей либо существовавшие там ранее, но количество их случаев начало вдруг быстро расти, либо они распространились в новом для них географическом регионе (табл. 15).
Таблица 15
Примеры недавно появившихся инфекций [7]
Инфекция или агент | Факторы, необходимые для их возникновения
Вирусные
Аргентинская и боливийская геморрагические лихорадки | Изменения в сельском хозяйстве, способствующие увеличению численности грызунов
Бычья спонгиформная энцефалопатия | Изменения в питании животных
Лихорадка Денге | Занос, миграция, урбанизация
Лихорадки Эбола и Марбург | Неизвестны, в Европу и США были занесены с обезьянами
Хантавирусы | Изменения в окружающей среде, увеличивающие контакты людей с природными резервуарами возбудителя (популяции грызунов)
Гепатиты В и С | Переливание крови, трансплантация органов, половое инфицирование, инъекции, вертикальное распространение от инфицированных матерей к детям
ВИЧ | Миграция в города и туризм, сексуальные контакты, вертикальная передача от инфицированных матерей к детям, контаминация через медицинские инструменты (включая внутривенное введение лекарств), переливание крови, трансплантация органов
HTLV | Контаминированные медицинские инструменты, другое
Пандемический грипп | Возможно, сельскохозяйственное разведение уток и свиней, что облегчает пересортировку генов птичьих вирусов и вирусов млекопитающих
Лихорадка Ласса | Урбанизация, способствующая увеличению численности грызунов — природных резервуаров возбудителя; увеличение экспозиции людей (обычно в домах)
Лихорадка долины Рифт | Строительство дамб, развитие сельскохозяйственного производства, ирригация; возможно, изменения в патогенности и вирулентности вируса
Желтая лихорадка в «новых» регионах | Формирование благоприятных условий для москитов — переносчиков возбудителя заболевания
Бактериальные
Бразильская пурпурная лихорадка (Haemophilus influenzae, биотип aegyptius) | Вероятно, появился новый штамм
Холера | Недавние эпидемии в Южной Америке вызваны возбудителем, вероятно, завезенным из Азии с грузом. Его распространению способствовало уменьшение хлорирования воды. Новый штамм возбудителя (тип 0139) был разнесен из Азии путешественниками (т. е. так же как в прошлом распространялась классическая холера)
Helicobacter pylori | Вероятно, уже давно широко распространен, но не был распознан (ассоциировался с другими гастроинтестинальными болезнями)
Гемолитический уремический синдром (Escherichia coli 0157:Н7) | Массовые пищевые технологии, способствующие контаминации мяса
Legionella (легионеллезные болезни) | Охлаждающие и водопроводные системы (микроорганизм растет в биопленках, которые формируются в емкостях со стоячей водой)
Боррелиоз Лайма (Borrelia burgdorferi) | Преобразования природной среды вокруг населенных пунктов, способствующие распространению клещей (носителей заболевания) и оленей (его вторичных резервуаров)
Стрептококки группы А (инвазивные, некротизирующие) | Неизвестны
Синдром токсического шока (Staphylococcus aureus) | Ультраабсорбирующие тампоны
Паразитические
Cryptosporidium и другие, распространяемые с водой патогены | Загрязнение поверхностных вод, плохая очистка воды
Малярия (в «новых» регионах) | Путешествия и миграция
Schistosomiasis | Строительство дамб
S. Morse (1995) считает, что возникновение новой инфекционной болезни происходит в два этапа:
1) агент интродуцируется в новую популяцию хозяина;
2) закрепляется в ней и распространяется дальше в популяции нового хозяина.
Факторы, обеспечивающие один или оба этих этапа, стимулируют возникновение новой инфекции. По мнению этого же исследователя, большинство таких инфекций как, впрочем, и антибиотико-резистентных штаммов известных бактериальных патогенов, обычно возникают в одном географическом регионе, а затем распространяется в другие.
Большинство появившихся за последние годы инфекционных болезней вызваны патогенами, уже существовавшими в окружающей человека среде. Они получили преимущества перед другими паразитическими видами в результате изменения природных условий и образования нового механизма проникновения в популяции новых хозяев (только в очень редких случаях может возникнуть новый вариант микроорганизма, вызывающий новую инфекцию — см. «Микробные адаптация и изменения»).
В табл. 16 обобщены основные факторы, ответственные за появление «новых» инфекционных болезней [Morse S., 1995]. Эта классификация, как и любая другая, произвольна, но, тем не менее, она отражает те основные процессы, которые находятся в основе возникновения новых инфекций у людей.
Таблица 16
Факторы, способствующие появлению «новых» инфекционных болезней у людей [8]
Факторы | Примеры специфических факторов | Примеры болезней
Экологические и климатические изменения | Сельское хозяйство; дамбы; изменения водных экосистем; наводнения; засуха; голод | Шистозомиаз (дамбы), лихорадка долины Рифт (дамбы, ирригация), аргентинская геморрагическая лихорадка (сельское хозяйство), хантавирусный легочный синдром (Юго-Восточная часть США, с 1993 г.; аномалии климата)
Демография и поведение людей | Социальные факторы: рост численности популяций и миграция (перемещение из сельских районов в города); войны или гражданские конфликты; упадок городов; сексуальное поведение; внутривенное введение лекарств; использование высокоплотного обслуживания (общественное питание и др.) | Проникновение ВИЧ; распространение лихорадки Денге; распространение ВИЧ и других заболеваний, инфицирование возбудителями которых осуществляется половым путем
Международный туризм и коммерция | Перемещение по всему миру товаров и людей; воздушный туризм | Малярия «аэропортов»; распространение москитов; хантавирусы, ввоз холеры в Южную Америку; распространение штамма V. cholerae 0139
Технология и индустрия | Глобализация продовольственного снабжения; изменения в приготовлении и упаковке продуктов питания; трансплантация органов и тканей; использование лекарств, вызывающих иммуносупрессию; широкое распространение антибиотиков | Гемолитический уремический синдром (контаминация E. coli мяса гамбургеров); бычья спондиформная энцефалопатия; трансфузионные гепатиты (В и С); оппортунистические инфекции у иммуносупрессированных пациентов; болезнь Creutzfeldt-Jakob у людей, вызванная введением контаминированного гормона роста
Микробная адаптация и изменения | Микробная эволюция в ответ на селективное давление окружающей среды | Антибиотико-резистентные бактерии, антигенный «дрейф» вируса гриппа
Разрушение общественного здравоохранения | Сокращение профилактических программ; неадекватные санитария и контроль за переносчиками | Возвращение туберкулеза в США; холера в лагерях беженцев; возвращение дифтерии в бывшем Советском Союзе
Возвращение возбудителей «старых» инфекционных болезней может быть результатом ошибок, допущенных в мерах по охране здоровья людей; изменениями, произошедшими в поведении людей; изменениями в обработке пищи и в привычках питания; изменениями во взаимодействии людей с окружающей средой [Lederberg J. et al., 1992].
Конечно, большинство инфекционных болезней у людей возникают из-за комбинации этих факторов. Далее мы рассмотрим каждый из них в отношении тех инфекционных болезней, в распространении которых в человеческих популяциях один из этих факторов играет ведущую роль.
Экологические изменения. Экологические взаимодействия могут быть сложными, ряд факторов часто взаимодействуют вместе или в какой-то последовательности друг за другом. Но они являются наиболее частыми из идентифицированных факторов, способствующих появлению той или иной инфекционной болезни. Особенно часто их отмечают при сопровождающихся большим количеством летальных исходах вспышках ранее нераспознанных инфекций, происходящих из наземного резервуара. Экологические факторы обычно ускоряют появление инфекционной болезни путем создания контакта людей с естественным резервуаром или хозяином инфекции. Последний до наступления эпидемии, может быть неизвестен [Morse S., 1995].
Формирование нового наземного резервуара может осуществляться деятельностью человека в течение столетия и более. Причем современники не способны представить себе отдаленные экологические последствия своих действий. Для их потомков инфекционная болезнь, проникшая в человеческое общество, становится неожиданностью, и они ее называют «новой». Ниже мы приведем пример необычно растянутой во времени «петли обратной связи» для событий, приведших к распространению болезни Лайма в США.
Возникновение болезни Лайма. В начале 1800-х гг. восточные районы США оказались фактически голыми, когда для развития сельского хозяйства были расчищены огромные пространства земли. С уничтожением лесов значительно уменьшилась популяция оленей. Однако в середине 1800-х гг. сельское хозяйство США начало быстро смещаться на запад к Грейт-Плейз (Большие равнины) и фермы были заброшены, в результате этого процесса огромные территории востока США вскоре снова покрылись лесами. В отличие от сравнительно открытого первичного леса, этот новый лесной массив представлял собой мелколесье, и в нем отсутствовало достаточное количество хищников, чтобы регулировать популяции оленей. Олени начали размножаться. Позже в этих лесных и сельских местностях начали останавливаться и жить люди. Данная тенденция продолжается и в настоящее время. Создавшееся в результате соседство людей, мышей, оленей и клещей открыло путь для распространения спирохеты, вызывающей болезнь Лайма, которая передается через укус клещей Ixodes. В настоящее время болезнь Лайма является в США наиболее распространенной болезнью, распространяемой переносчиками [Lederberg J. et al., 1992]. Так нынешнее поколение американцев отвечает перед природой за грехи своих праппрадедов.
Сельскохозяйственное развитие является одним из наиболее общих подходов к изменению людьми среды своего обитания.
Возникновение корейской геморрагической лихорадки. Вирус Хан-таан, ставший причиной почти 100 тыс. ежегодных случаев корейской геморрагической лихорадки в Китае, существует в Азии в течение тысячелетий. Вирус вызывает естественную инфекцию у полевой мыши Apodemus agrarius. Грызун процветает на рисовых полях, люди контактируют с больными грызунами и инфицируются во время сборки риса, т. е. эта болезнь — неизбежное следствие сельскохозяйственного развития, меняющего среду обитания людей [Morse S., 1995].
Возникновение аргентинской геморрагической лихорадки. Возбудитель этой болезни исторически никак не связан с вирусом Хантаан. Переориентация полей в Южной Америке на выращивание маиса, одновременно стимулировала размножение грызуна, который был естественным хозяином этого вируса. Случаи инфицирования людей нарастали пропорционально площади, занимаемой под выращивание маиса [Johnson К., 1993].
Большим сюрпризом для эпидемиологов стало обнаружение доказательств сельскохозяйственного происхождения пандемий гриппа (подробнее см. «микробная адаптация»).
Важную роль в появлении «новых» и возвращении побежденных инфекций, играют переносчики. Как это не покажется необычным, но в конце XX столетия их роль в возникновении вспышек и эпидемий забытых инфекций, по сравнению с первой половиной столетия, значительно повысилась. И, видимо, для этого есть серьезные причины (рис. 40).
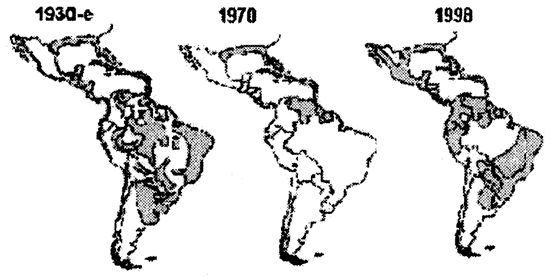
Рис. 40. Возвращение комара Aedes aegypti. Географическое распределение переносчика желтой лихорадки и лихорадки Дэнге — комара Aedes aegypti в Южной Америке в 1930-х гг., 1970-м и 1998-м гг. [Gubler D., 1998]. К сожалению, это опять пример необычно растянутой во времени «петли обратной связи». Уменьшение ареала переносчика обеих лихорадок в средине столетия, было связано не только с мерами, предпринятыми для борьбы с ним, но и с глобальным похолоданием 1940–1970 гг. (см. «Изменения климата»). Однако о похолодании стало известно только в конце 1980-х гг., уменьшение же популяций переносчиков современниками субъективно воспринималось как их «победа над врагом». «Возвращающиеся» москиты, как правило, резистентны к инсектицидам.
По мнению D. Gubler (1998) они следующие: резкое повышение устойчивости артроподов к действию инсектицидов; развитие лекарственной устойчивости у паразитов, переносимых артроподами; свертывание программ по борьбе с переносчиками; демографические и социальные изменения в окружающей среде.
Среди последних S. Morse (1995) выделяет водный фактор. Распространение москитов часто стимулирует расширение площадей водоемов со стоячей водой. Имеются многочисленные описания случаев переноса инфекционных болезней носителями, цикл размножения которых осуществляется с участием водной среды. Это вода у дамб, в системах ирригации, или хранящаяся питьевая вода для больших городов. Случаи японского энцефалита у людей исчисляются в Азии почти 30 тыс. заболевших ежегодно, из которых приблизительно 7 тыс. умирают. Количество случаев болезни находится в прямой зависимости от затапливаемых площадей для выращивания риса. Вспышки лихорадки долины Рифт в некоторых регионах Африки связаны со строительством дамб и периодами сильных ливней. Вспышка лихорадки долины Рифт, произошедшая в 1987 г. в Мавритании, имела место именно в деревнях, расположенных около дамб на реке Сенегал. Аналогичный эффект от мелиорации задокументирован и в отношении других инфекций, имеющих зависящих от воды хозяев, например, таких как шистосоматоз.
В табл. 17 приведены факторы внешней среды, способствующие повышению роли переносчиков в распространении возбудителей инфекционных болезней.
Таблица 17
Изменения внешней среды, приводящие к активизации переносчиков инфекционных болезней [9]
Урбанизация | Уничтожение лесов | Сельскохозяйственная практика
Лихорадка Денге | Лоаоз | Малярия
Малярия | Онхоциркоз | Японский энцефалит
Желтая лихорадка | Малярия | Энцефалит Сан Луи
Чикунгунья | Лейшманиоз | Восточно-Нильская лихорадка
Эпидемические полиартриты | Желтая лихорадка | Оропуш
Восточно-Нильская лихорадка | Киасанурская лесная лихорадка | Восточный лошадиный энцефалит
Энцефалит Сан Луи | Энцефалит Ла Кросс | Венесуэльский энцефалит лошадей
Болезнь Лайма | Восточный лошадиный энцефалит |
Эрлихиоз | Энцефалит Сан Луи |
Чума | Болезнь Лайма |
Изменения климата. Мировой климат, хотя и чрезвычайно изменчивый в масштабах нескольких десятилетий, в целом, за последние 100 лет, стал теплее. Неуклонное повышение температуры было нарушено кратковременным похолоданием в 1940—1970-е гг., после которого потепление возобновилось, не обнаруживая уже никакого отступления. Все разработанные климатические модели предсказывают, что в ближайшие десятилетия потепление значительно усилиться [Джоунс Ф., Уигли Т., 1990]. Кроме того, крупные города представляют собой самостоятельные «острова тепла», населенные сотнями миллионов людей. Их укрупнение неизбежно вызовет рост случаев инфекций, возбудители которых распространяются переносчиками и водой, а также изменение границ регионов, в которых эти инфекции обычно имеют место (рис. 41).
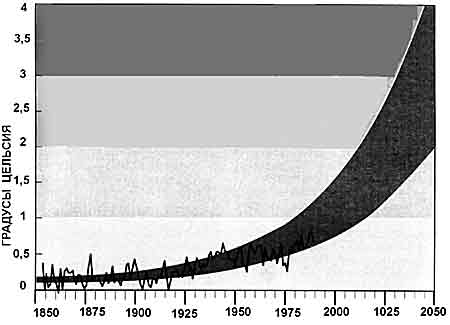
Рис. 41. Прогнозы глобального потепления. Диапазон величин глобального потепления, предсказываемый различными компьютерными моделями (выделена межпунктирными линиями), примерно соответствует тому, что дают архивные данные. Все модели говорят о том, что в ближайшие десятилетия потепление значительно усилится [Джоунс Ф.Д., Уигли Т.Л., 1990].
Перечень инфекционных болезней, на распространении которых скажется глобальное потепление, приведен в табл. 18.
Таблица 18
Инфекционные болезни, распространение которых будет увеличиваться при потеплении климата [10]
Болезнь | Популяция риска, млн | Распространенность инфекции сегодня, млн | Географический регион | Возможность климатического воздействия
Малярия | 2100 | 270 | Тропики, субтропики | Очень возможно
Шистосомиаз | 600 | 200 | То же | То же
Африканский трипаносомоз | 50 | 25000 новых случаев за год | Тропическая Африка | Возможно
Лейшманиоз | 350 | 12 млн инфицированных + 400000 новых случаев за год | Азия, Южная Европа, Африка, Северная Америка | Неизвестно
Дранкулез | 63 | 1 | Тропики (Африка, Азия) | Невозможно
Арбовирусные инфекции, Денге | — | — | Тропики, субтропики | Очень возможно
Желтая лихорадка | — | — | Африка, Латинская Америка | Возможно
Японский энцефалит | — | — | Восточная и Юго-Восточная Азия | То же
Другие арбовирусные болезни | — | — | Тропические температурные зоны | То же
Холера | — | — | Глобальное распространение морскими течениями | Очень возможно
Разумеется, перечень далеко не полный. Ниже мы остановимся на особенностях климатического воздействия на отдельные инфекции.
Малярия. Возвращение малярии было замечено еще в 1973 г. Тогда же было обнаружено более 50 видов комаров, устойчивых к инсектицидам, используемым для борьбы с ними после 1947 г. Позже выяснилось, что во многих регионах, где малярия считалась почти уничтоженной, болезнь как бы очнулась и уровень заболеваемости превысил исходный [Gilles H., 1993]. Малярия обычно поддерживается в регионах, где зимняя температурная изотерма не опускается ниже 16 °C. Температура и влажность являются важными факторами распространения паразита и управляют продолжительностью его внешнего инкубационного периода (ВИП), т. е. развитием спорогоний. Наиболее оптимальной для ВИП малярии является температура в диапазоне от 20–27 °C. Ниже 16 °C и выше 30 °C спорогония прекращается [Шувалова Е.П., 1973]. Вспышка малярии, связанная с локальными климатическими изменениями, наблюдалась в Руанде в 1987 г. Тогда высокая температура и проливные дожди привели к экспоненциальному распространению малярии на горные популяции людей, ранее никогда с ней не сталкивавшихся [Loevinsohn M., 1994].
Лихорадка Денге. Комары-переносчики возбудителя лихорадки Денге и их личинки не могут существовать в холодной воде, поэтому болезнь распространена между 30° северной широты и 20° южной. Глобальное повышение температуры способно сместить ареал переносчиков и, соответственно, природный очаг возбудителя лихорадки Денге в более высокие широты. Кроме того, обнаружена прямая связь между температурой и количеством укусов комаров, а также скоростью их инфицирования. Например, ВИП для вируса Денге II типа составляет 12 сут. при температуре 30 °C, и только 7 сут. при температуре 32 °C [Watts D. et al., 1987]. Сокращение инкубационного периода на 5 суток увеличивает трехкратно трансмиссионную способность москита, т. е. для распространения лихорадки Денге при данной температуре даже не требуется увеличения количества переносчиков.
Хантавирусный пульмонарный синдром. Вспышка произошла в юго-восточных Соединенных Штатах в 1993 г. Вероятно, в этом регионе вирус длительно поддерживался в популяциях мышей. Необычно умеренная зима и влажная весна способствовали увеличению численности грызунов весной и летом. Тем самым были созданы условия для контакта людей с инфицированными грызунами, а затем и с вирусом. Те же причины могут быть ответственны за вспышки хантавирусной инфекции примерно в это же время в Европе [Rollin P. et al., 1993].
Арбовирусные энцефалиты. Арбовирусы разносятся комарами. Эпидемии арбовирусных энцефалитов обычно возникают южнее июньской изотермы 20 °C, но во влажные годы они могут продвигаться на север [Shope R., 1980]. На Северо-Американском континенте вспышки среди людей энцефалита Сан-Луи совпадают с периодами, когда дневная температура превышает 30 °C, как, например, это имело место в США (Калифорния) в 1984 г. Повышение температуры резко активизирует переносчиков арбовирусов (рис. 42).
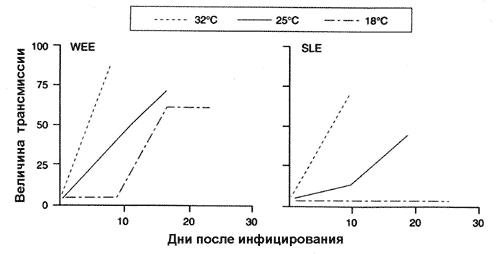
Рис. 42. Влияние температуры на скорость переноса комарами арбовирусов. Скорость трансмиссии выражается через процент укусов комаров Culex tarsalis, которые привели к передаче арбовируса. WEE — восточный энцефалит лошадей; SLE — энцефалит Сан Луи [Reeves et al., 1994].
Холера. За последнее столетие средняя температура морской поверхности возросла на 0,7 °C, что привело к размножению фитопланктона и интенсивному цветению водорослей практически во всем мире. В близи крупных городов эта ситуация усугубляется большим количеством сбросов стоков, содержащих питательные вещества, стимулирующие рост водорослей [Patz J. et al., 1996]. Рассматривая в предыдущем разделе природный резервуар холерного вибриона, мы отметили то обстоятельство, что его высокую концентрацию могут поддерживать низшие ракообразные [Голубев Б. П., 1993] и зоопланктон [Islam M. et al., 1990]. Для зоопланктона водоросли являются пищей. Это способствует формированию множества прибрежных очагов холеры во всем мире и уже получены первые экспериментальные подтверждения того, что организмы, живущие в морской среде, являются естественными резервуарами холерного вибриона. Так A. Huq и соавт. (1990), используя флюоресцирующие антитела, обнаружили V.cholerae в оболочках и экзоскелетах морских организмов, которые им затем удалось перевести в культивируемое состояние при оптимальной рН, температуре и питательной среде [Epstein P. et al., 1993]. Следовательно, крупномасштабное воздействие потепления климата на океанические течения, способно привести к увеличению организмов-резервуаров V. cholerae и спровоцировать глобальную вспышку холеры (см. «Международный туризм и коммерция»).
Изменения человеческой демографии и поведение людей. Перемещения населения, вызванные войнами и катастрофами, часто являются важными факторами в возникновении инфекционных болезней. Сложившиеся во многих частях мира экономические условия, вынуждают рабочую силу перемещаться из сельских регионов в города. По оценкам ООН, в результате таких действий до 65 % населения мира к 2000 г. будут жить в городах. Урбанизация позволяет инфекции, возникшей в изолированных сельских районах (которая могла бы остаться неизвестной и иметь ограниченное распространение), проникнуть в большие человеческие популяции городов. Попав в город, возбудитель одновременно приобретает возможность распространяться не только среди его населения, но и дальше, междугородным транспортом по шоссейным дорогам и самолетами [Morse S., 1995]. В качестве примера рассмотрим причины распространения вируса Денге в городах Юго-Восточной Азии.
Лихорадка Денге. Распространению вируса Денге в азиатских городах способствует быстрое увеличение числа открытых контейнеров на улицах и превышение численности населения над возможностями городской инфраструктуры. Как элемент городской среды, заполненная дождем тара и пустые пластиковые бутылки являются благоприятной средой для размножения москитов. «Москитный бум» дополняется высокой плотностью человеческой популяции. В этой ситуации увеличивается риск передачи возбудителя от больных людей здоровым [Morse S., 1995].
Вторжение в чужие экосистемы. Проникновение возбудителей новых инфекций в человеческую цивилизацию может быть вызвано вторжением людей в тропические леса. Среди них возбудители СПИДа, геморрагических лихорадок, оспы обезьян и др. Контакты с обитателями тропических лесов ведут к обмену патогенами по самым различным путям передачи. В обмен могут включаться переносчики-артроподы, вода, охотники за дикими животными. Например, габонская вспышка лихорадки Эбола в 1996 г., была связана с употреблением в пищу шимпанзе, которых местные охотники нашли мертвыми. Имели место случаи, когда во время лабораторных исследований случайно происходила экспозиция людей такими агентами как малярийные паразиты, вирус иммунодефицита обезьян и др. [Escalante A.A. et al., 1998].
Очень большую опасность представляет и обратный процесс — инфицирование от людей диких животных, особенно приматов. Тем самым среди близкородственных видов формируются вторичные природные очаги инфекций, которые среди людей считаются уничтоженными или контролируемыми (например, малярия, полиомиелит, туберкулез, проказа; табл. 19).
Таблица 19
Пути обмена патогенами между людьми и приматами [11]
Пути обмена | Патоген | Направление обмена
Укус животного | Герпес В, оспа обезьян | От обезьян к людям
Фекально-оральный | Полиовирус | От людей к обезьянам
То же | От шимпанзе к шимпанзе |
Охота, приготовление и поедание пищи | Вирус лихорадки Эбола | От обезьян к людям
Назальные секреты | Лепра | Между обезьянами
Воздушно-капельный | Туберкулез | От людей к обезьянам
Трансмиссивный | Малярия | Оба направления
Филярия | То же |
Водный | Дранкунлиаз | От людей к обезьянам
Шистосоматоз | От обезьян к людям |
Ксенотрансплантация | SV40 | От обезьян к людям
Биологический терроризм и диверсии. Это уже давно существующая практика человеческих отношений. Кому первому пришло в голову мысль преднамеренно инфицировать возбудителями опасных болезней людей и скот, сказать трудно, но древние книги и хроники полны упоминаний об этом. Да и Господь не пренебрегает использованием биологических агентов в своих целях. Например, в Ветхом завете можно прочитать: «И наведу на вас мстительный меч… и пошлю на вас язву, и преданы будете в руки врага» (Левит, 26, стих 25) или «Посещу живущих на земле Египетской, как Я посетил Иерусалим, мечем, голодом и моровою язвою» (Иеремия, 44, стих 13). Особенности возникновения террористических вспышек и эпидемий инфекционных болезней, мы рассмотрим в специально посвященной этой проблеме подглаве 2.3.
Другие известные примеры влияния человеческого поведения на распространение инфекционных болезней — это половая активность и внутривенное введение наркотиков.
Международный туризм и коммерция. И в еще прошлом возбудители инфекций, ранее вызывавших болезни географически изолированных популяциях людей, могли быть перенесены путешественниками, торговцами или во время военных походов. Но в XX столетии миграция людей резко ускорилась. В последние годы возможности для переноса инфекций на большие расстояния стали значительно более разнообразными и многочисленными, что отражает увеличивающиеся объёмы, скорость и возможности перемещения по всему миру. Однако появление инфицированного человека в чужой для него стране, еще не означает укоренения там его болезни. Ниже мы приведем условия, показывающие, каким образом миграция приводит к появлению новых болезней в регионах (рис. 43).
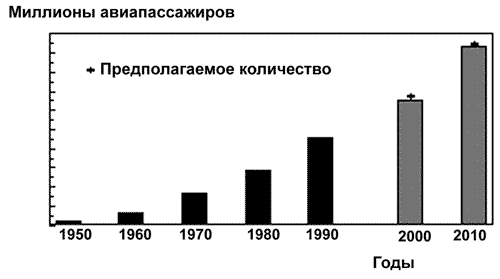
Рис. 43. Рост количества авиапассажиров в мире начиная с 1950-го года. Глобальные перевозки туристов, млн. в год [Altekruse S. et al., 1997].
Для того чтобы болезнь укоренилась в регионе посредством миграции, человек должен нести патоген, который может быть в принципе перенесен другим лицам (сразу или нет; прямо или косвенно). При этом сам возбудитель инфекционной болезни может ничем себя не проявлять (длительный инкубационный период болезни, хроническая или латентная форма инфекционного процесса). Например, вирус гепатита В, ВИЧ, возбудители туберкулеза, лепры, сальмонеллеза и др. Болезнь может приобрести особенно серьезный характер, если патоген проникает в популяцию, которой он ранее не был знаком. Завезенная в Новый Свет испанцами оспа вызвала гибель двух третей индейского населения. Необычайная по силе эпидемия «испанки» 1918 г., завезенная в США из Франции, дала исключительно высокую смертность только среди молодых людей и почти не затронула пожилое население, уже прошедшее «селективный отбор» прошлыми пандемиями гриппа, иначе и без того катастрофические последствия «испанки» были бы намного ужасней.
Критическими условиями распространения патогена в новой популяции являются продолжительность его существования в потенциально инфективной форме, а также способ и возможность его трансмиссии. Например, ВИЧ, гепатит В и малярия могут длительно передаваться с кровью. Но для первых двух инфекций это станет возможным, если здоровый человек использует иглу больного для внутривенного введения наркотика, передача же малярии станет возможной при наличии переносчика.
Кроме инфицированных людей, опасность завоза новых инфекций исходит от транспортных средств, импортируемых продуктов питания, препаратов на основе крови (см. «технологии и индустрия»), животных и растений. Животные могут переносить потенциальные человеческие патогены (возбудители чумы, оспы обезьян, лихорадки Марбург, лихорадки Эбола, туберкулеза, сибирской язвы, сапа и др.) и их переносчиков (клещи, блохи). Животные и артроподы могут путешествовать с людьми «зайцами» (грызуны, комары, клещи) и попав в новый регион, укореняться там вместе с принесенными ими патогенными микроорганизмами, либо включаться в поддержание циркуляции возбудителей инфекций уже имеющихся в регионе. В начале XVI столетия и в XVII столетии, суда, перевозившие рабов из Западной Африки в Новый Свет, перенесли на «новые земли» желтую лихорадку и ее переносчика — москита Aedes aegypti [Morse S., 1995].
Ниже мы приведем несколько примеров, иллюстрирующих многообразие существующих сегодня возможностей глобальной переброски возбудителей опасных инфекций.
Распространение инфекций кораблями. Перенос возбудителей инфекций и инфицированных ими организмов осуществляется поверхностями кораблей, балластной водой и с грузами. Например, 367 различных видов организмов было обнаружено в балластной воде судна, курсирующего между Японией и Орегоном (США) В отдельных регионах завоз чуждых организмов вызывает очень тяжелые последствия. Ввезенные в Черное и Азовское моря днищами судов медузоподробные организмы, называемые стенофорами, вызвали кризис местной рыбной отрасли [Travis J., 1993].
Предполагается, что завоз холерного вибриона в Южную Америку также был осуществлен судами. Исследователи обнаружили холерные вибрионы в пробах, взятых из балластной воды, днища и сточных вод 3 из 14 грузовых судов, стоявших в доках порта Мехико. Эти суда направлялись в Бразилию, Колумбию и Чили. V. cholerae 01, серотипа Inaba, биотипа El Tor, не отличающийся от латиноамериканского эпидемического штамма, был обнаружен в закрытых устрицах из Мобил Бея (Алабама, США) [De Paola A. et al., 19921.
Aedes albopictus (азиатский тигриный москит) был ввезен в США, Бразилию и некоторые регионы Африки в автомобильных покрышках из Азии [Craven R. et al., 1988]. В Азии он участвует в переносе возбудителя лихорадки Денге. Проникнув на территорию США в 1982 г., москит закрепился, по крайней мере, в 21 штате и активно включился в перенос местных вирусов, в том числе вируса, вызывающего восточный энцефалит лошадей [Morse S., 1995]. Москит агрессивен и способен выживать как в лесных, так и в городских ландшафтах. В лабораторных экспериментах было показано, что Aedes albopictus способен переносить вирус лихорадки Ла Кросс, вирус желтой лихорадки и ряд других опасных вирусов [Мооге С. et al., 1988].
Африканский малярийный комар был завезен в Бразилию приблизительно в 1929 г. Хотя малярийный паразит уже был в Бразилии, новый переносчик существенно расширил границы малярийных очагов и увеличил число случаев болезни. Так как он не смог приобрести необходимую в Южной Америке темно зеленую окраску, то постепенно был элиминирован. Однако, по различным оценкам, от перенесенной им малярии погибло до 20 тыс. человек [Wilson M., 1995].
Распространение инфекций самолетами. Артроподы способны перенести самые тяжелые условия воздушного путешествия. Опытным путем было установлено, что они прекрасно выживают при длительном полете при температуре — 42 °C в колесах Боинга 747В. В 12 из 67 самолетов, прилетевших в Лондон из тропических стран, были обнаружены москиты [Russell R., 1987]. По этой причине, из переносимых москитами инфекционных болезней, в неэндемических районах наиболее часто встречается «малярия аэропортов» [Morse S., 1995].
Распространение инфекций наземным транспортом. Переносчик африканского трипаносомоза Glossina palpalis, неспособен проделать путь, превышающий 21 км, однако, благодаря наземному транспорту он распространяется на значительно большие расстояния [Wilson M., 1995].
Распространение инфекций экзотическими животными. Семь человек в г. Марбург (Германия) погибли от геморрагической лихорадки, вызванной инфицированием от угандийских обезьян вирусом, в последствии, получившем название этого города. Отмечены внутри лабораторные заражения людей герпесвирусом В от обезьян и геморрагической лихорадкой с почечным синдромом от грызунов [Wilson M., 1995].
Технологии и индустрия. Быстродействие характеризует не только туризм, но и другие индустрии современного мира. Технологии, применяемые для производства продуктов питания и других продуктов биологического происхождения, как правило, эффективны и недороги, но их использование одновременно увеличивает риск случайной контаминации и приводит к многократному усилению последствий такой случайности. Медицинские назначения — также передняя линия экспозиции людей к возбудителям новых инфекционных болезней. Проблема усугубляется глобализацией, позволяющей микроорганизму распространяться на очень большие расстояния [Morse S., 1995].
Увеличению числа новых инфекционных болезней способствует и улучшение технологий их диагностики. Оказывается, что с возбудителями многих из них мы давно уже знакомы. Проблемой являются условия, при которых их эпидемическая значимость повышается. Ниже мы рассмотрим механизмы появления и распространения новых инфекций препаратами крови, в стационарах и продуктами питания.
Препараты крови. Препараты крови обычно подвергаются контролю, считается, что они не опасны. Однако насколько эффективен этот контроль? И что же, все-таки, контролируется в крови доноров? Поищем ответ на эти вопросы на примере возбудителей инфекций, использующих вторую стратегию паразитизма.
В настоящее время основным способом выявления ВИЧ-инфекции является обнаружение в периферической крови иммуноглобулинов против антигенов вируса (в основном протеинов и гликопротеидов gp 120, gp41, p24). Но так можно диагностировать ВИЧ и другие ретровирусы (например, возбудителей лейкоза HTLV 1, 2) лишь после сероконверсии. Если исследуемый донор инфицирован высокоэкспрессивным штаммом, антитела возникают относительно быстро — до 3 мес. Но «молчащая инфекция» таким способом не выявляется (Медников Б.М., 1993). Насколько эта проблема серьезна, говорят данные сравнительного исследования иммунологическими методами и ПЦР детей, родившихся от ВИЧ-инфицированных матерей.
Как следует из результатов N. Shaffer и соавт. (1992), после рождения ребенка антитела в его крови появляются через месяц у 60 % испытуемых (рис. 44). Далее, на втором месяце, число серопозитивных младенцев становится ниже 40 %. Это соответствует первой стадии иммунного ответа, когда иммуноглобулины, связываясь с вирусом, «захватываются» макрофагами и продолжают инфицировать организм. В результате после 6 месяцев жизни ребенка сероконверсия достигает только 70 %.
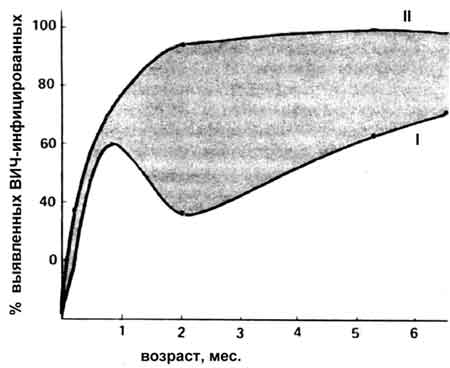
Рис. 44. Несоответствие результатов иммунной реакции данным ПЦР-анализа при обнаружении людей, инфицированных ВИЧ. Диагностика ВИЧ-инфекции у детей, родившихся от ВИЧ-инфицированных матерей. I — положительный ответ в иммунной реакции, II — в цепной полимеразной реакции [Shaffer N. et al., 1992]. Следовательно, применяемые в повседневной пра











