Не установлен
Слабость в кистях рук, затем — в ногах, параличи конечностей, затем брюшных мышц и мышц грудной клетки, спинальный тип нарушения дыхания
Поражение центральных и периферических двигательных нейронов, дегенерация и перерождение клеток передних рогов и боковых столбов спинного мозга
Медленные инфекции могут вызывать некоторые вирусы, использующие первую стратегию паразитизма (например, вирусы кори — подострый склерозирующий панэнцефалит, клещевого энцефалита — прогредиентная форма клещевого энцефалита). Но это не является всеобщей закономерностью и происходит только при определенном состоянии иммунной системы, когда эффективные иммунные реакции макроорганизма на вирус заблокированы.
Для поддержания в природе возбудителей инфекций, использующих стратегию паразитирования II типа, размер инфицированной популяции имеет значительно меньшее значение, чем для возбудителей, использующих стратегию I типа.
Теперь попробуем понять, как эти стратегии реализуются в инфекционных процессах и жизненных циклах ВНО и ВИЧ.
Особенности строения геномов ВНО и ВИЧ, предопределяющие стратегии паразитизма. Геномы вирусов сформированы различными типами нуклеиновой кислоты. У ВНО — ДНК, у ВИЧ — РНК. Уже это предопределяет различную стратегию преодоления противодействия защитных механизмов хозяина.
РНК-вирусы имеют определенный лимит генетической сложности, обусловленный небольшими размерами их геномов — от 3 до 30 кб. Однако они более эффективно, чем ДНК-вирусы используют мутационный процесс для изменения своей антигенной структуры и тропизма в организме хозяина, а также для уклонения от антител и цитотоксических лимфоцитов. Высокую частоту мутаций у РНК-вирусов обычно объясняют отсутствием механизмов корректировок в синтезе РНК. Все молекулы вирусной РНК обычно реплицируют через ассиметричную транскрипцию от одной цепи, исключающую большинство корректирующих механизмов, характерных для репликации молекул ДНК. S. Holland и соавт. (1982) экспериментально доказали, что вероятность ошибки во время копирования РНК-молекулы будет в 105—107 раз больше, чем при копировании ДНК-молекулы. Ими также была установлена средняя частота мутаций для РНК-вирусов, составляющая приблизительно 10-4,5. Это означает, что до 10 % всех молекул РНК в популяции вируса, могут содержать мутации.
Репликация ДНК-вирусов сопровождается проверочным считыванием и пострепликационной репарацией. Поэтому механизм мутационной изменчивости играет меньшую роль в их стратегиях противодействия иммунной системе хозяина. Зато эволюцией за ними были закреплены другие изощренные механизмы выживания. Например, белки ЕЗ/19К и Е1а аденовирусов, супрессируют поверхностные молекулы, необходимые для Т-клеточного распознавания [Murphy P., 1993]. Белок BCRF1 вируса Эпштейна-Барра является гомологом интерлейкина-10 (IL-10) и взаимодействует с его рецептором [Domingo E. et al., 1998]. Филогенетический анализ генов герпесвирусов, способных инфицировать широкий круг хозяев, позволил сделать вывод о совместной эволюции этих вирусов и их хозяев. Свои гены-двойники в геноме хозяина имеются и у РНК-вирусов (например, вирусы саркомы и лейкемии). Однако использование в стратегиях инвазии захватов ДНК хозяина и антигенной мимикрии белков, более характерно для ДНК-вирусов.
Различия в организации геномов ВНО и ВИЧ. В отличие от большинства ДНК-содержащих вирусов животных, жизненный цикл поксвирусов проходит в цитоплазме клетки в значительной степени автономно от ее ядра (рис. 25). Для этого они, как и бактерии (!), располагают своими ферментативными системами синтеза РНК и ДНК (рис. 26).
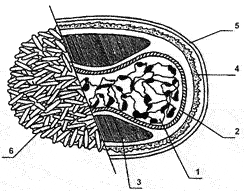
Рис. 25. Структура внеклеточного вириона ортопоксвирусов. 1 — сердцевина, 2 — мембрана сердцевины, 3 — боковые тела, 4 — поверхностная мембрана IMV, липопротеидная оболочка EEV, 6 — трубчатые структуры поверхностной мембраны IMV.
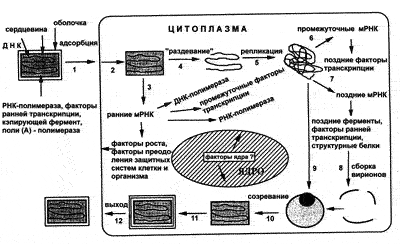
Рис. 26. Жизненный цикл осповирусов. Вирионы, содержащие двухцепочечную геномную ДНК, ферменты, факторы транскрипции, адсорбируются на клетке (1) и сливаются с плазматической мембраной клетки, высвобождая сердцевины в цитоплазму (2). Сердцевины синтезируют ранние мРНК, с которых транслируются различные белки, включая факторы роста, молекулы защиты от иммунной системы, ферменты и факторы для репликации ДНК и транскрипции промежуточных генов (3). Происходит раздевание сердцевины (4) и вирусная ДНК реплицируется, формируя конкатемерные молекулы (5). Промежуточные гены транскрибируются на дочерних молекулах ДНК и с этих мРНК транслируются факторы поздней транскрипции (6). Затем транскрибируются поздние гены. С их мРНК транслируются вирионные структурные белки, ферменты и факторы ранней транскрипции (7). Сборка вирионов начинается с образования дискретных мембранных структур (8). Конкатемерные промежуточные формы вирусной ДНК разделяются на единичные геномы и упаковываются в незрелые вирионы (9). Созревание приводит к образованию внутриклеточных зрелых вирионов (10). Эти вирионы покрываются модифицированными мембранами аппарата Гольджи и перемещаются к периферии клетки (11). Слияние таких вирионов с плазматической мембраной завершается высвобождением внеклеточных вирионов. Хотя размножение вируса происходит полностью в цитоплазме, ядерные факторы могут быть вовлечены в процессы транскрипции генов и сборки вирионов [Маренникова С.С., Щелкунов С.Н., 1998]
Инфекционные частицы поксвирусов содержат в своем составе полную ферментативную систему транскрипции, способную синтезировать функциональную мРНК в полиаденилированной, кэпированной и метилированной форме [Маренникова С.С, Щелкунов С.Н., 1998]. Это позволяет ВНО:
1) самостоятельно осуществлять эффективную защиту от ранних специфических реакций на инфекцию и противодействовать развивающимся позже специфическим реакциям;
2) размножаться до высокого уровня, обеспечивающего быструю передачу другому хозяину.
В отличие от других РНК-вирусов, ВИЧ, как и остальные ретровирусы, является примитивным «половым» организмом и способен к примитивному «половому воспроизведению» [Burke D., 1997]. Каждая вирусная частица содержит две РНК-цепи положительной полярности, полной длины и способные к репликации (рис. 27 и 28). В природе не существует других диплоидных семейств ДНК- или РНК-вирусов [Coffin J., 1992].
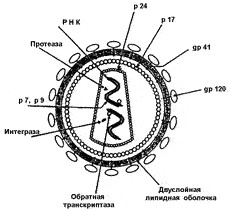
Рис. 27. Структура вириона ВИЧ. В морфологическом отношении ВИЧ-1 и ВИЧ-2 сходны с другими ретровирусами. Наружная оболочка заимствуется вирионом из мембраны клетки хозяина при отпочковывании. Она пронизана вирусными белками: трансмембранными (гликопротеин gp41) и внешним (gp120). Оба называются оболочечными (кодируются геном env) и участвуют в прикреплении к мембране клетки-хозяина, выполняя функцию иммуногенной детерминанты. С внутренней стороны липидной оболочки расположен матриксный каркас, образованный белком р17. Он окружает внутреннюю структуру вириона — нуклеотид или сердцевину (англ. — core). Собственная оболочка сердцевины образована «коровым» белком р24. Внутри нуклеотида различают геном вируса, состоящий из двух цепочек РНК, окруженных белками р7 и р9. Вблизи молекул РНК расположены различные ферменты (обратная транскриптаза или ревертаза, РНКаза Н, протеаза). Большинство изображенных на рисунке морфологических элементов являются антигенами [Лысенко А.Я. и др., 1996]
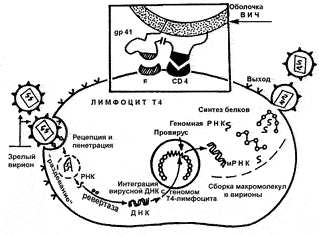
Рис. 28. Жизненный цикл ВИЧ. На врезке показано, что связывание вириона с мембраной клетки (рецепция) возможно только при слиянии вирусного gp120 со специфическим рецептором на мембране клетки хозяина (см. рис. 51). После проникновения вириона, происходит его «раздевание», когда вследствие точечного протеолиза освобождается вирусная РНК. Центральным событием является синтез ДНК на матрице РНК. Уникальный фермент ретровирусов — обратная транскриптаза или ревертаза — разрушает нити РНК и синтезирует новую нуклеиновую кислоту, ДНК. Зрелые вирионы, образовавшиеся в клетке хозяина, отпочковываются, разрушая при этом клетку. Очень существенно, что репликация вируса с образованием множества вирионов, происходит только тогда, когда инфицированная клетка хозяина находится в активированном состоянии. В неактивированной клетке ВИЧ может находиться в латентном состоянии (в стадии провируса) неопределенно долго и с этим связана его кардинальная особенность его эпидемиологии как медленного вируса [Лысенко А.Я. и др., 1996]
Обычно обе цепи РНК в ретровирусной частице являются производными от одного родительского провируса. Однако если инфицированная клетка одновременно содержит два различных провируса, то их РНК-транскрипты могут сформировать отдельный гетерозиготный вирион. После проникновения в новую клетку, под действием обратной транскриптазы, заново синтезированная ретровирусная последовательность будет рекомбинантом двух родительских. Сходство с половым процессом здесь в том, что:
1) обе цепи РНК как две родительские гаметы сливаются в одну;
2) генетическая информация потомков будет рекомбинантной
3) последующие «поколения» будут нести информацию обоих родителей [Temin Н., 1991].
«Половой процесс» дает ВИЧ ряд существенных преимуществ перед другими РНК-вирусами. Легко возникающие мутации, способствуют отбору и закреплению вариантов РНК-вируса, наиболее «удачно» использующих данного хозяина. Но для любого микроорганизма, который достиг пика на «ландшафте приспособленности», новая мутация не создает однозначных преимуществ. Более того, для него это ступенька на нижний уровень приспособленности. Генетическая рекомбинация может создать условия для регенерации геномов более «удачливых» ретровирусов из предковых геномов вирусов, менее адаптированных из-за мутаций. Однако, при смене условий существования такая консервация на высоте адаптивного пика превращается для вируса в ловушку. Рекомбинация между РНК-геномами двух высокоадаптированных ВИЧ, дает возможность рекомбинанту «сесть» на другой адаптивный пик, более соответствующий изменившимся условиям. Т. е., как заметил S. Kaufman (1993), помочь ему совершить «эволюционно широкий прыжок».
Сравнение патогенезов. Патогенез ВНО определяется необходимостью его быстрого размножения до количеств, позволяющих смену хозяина в течение короткого промежутка времени — от момента его инфицирования до его гибели или выздоровления. Выздоровление — это процесс разрешения от инфекции, осуществляемый иммунной системой хозяина.
ВНО variola maior обуславливает генерализованную инфекцию, которая в высоком проценте случаев завершается летальным исходом. Для этого вирус располагает беспрецедентным, по сравнению с вирусами других семейств, набором генов, белковые продукты которых эффективно изменяют многочисленные защитные реакции организма (рис. 29).
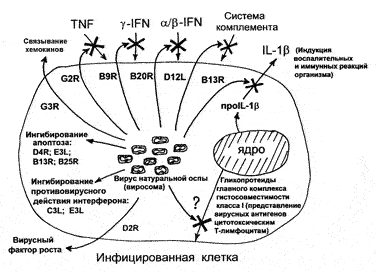
Рис. 29. Общая схема синтеза ВНО молекулярных факторов, обеспечивающих вирусу преодоление защитных барьеров человека. Вирус располагает беспрецедентным, по сравнению с вирусами других семейств, набором генов, белковые продукты которых эффективно изменяют многочисленные защитные реакции организма [Маренникова С.С., Щелкунов С.Н., 1998]
Первым неспецифическим и, возможно, самым древним барьером, который вынужден преодолевать ВНО, является программированная гибель клеток (апоптоз). Инфицирование клетки запускает механизм ее самоубийства, благодаря чему предотвращается размножение вируса и его распространение среди соседних клеток. ВНО располагает, по крайней мере, четырьмя генами, белковые продукты которых ингибируют апоптоз по альтернативным и дублирующим механизмам [Маренникова С.С., Щелкунов С.Н., 1998].
Вторым неспецифическим барьером являются местные воспалительные процессы. Они быстро индуцируются для ограничения распространения вируса в первые часы и дни после инфицирования, пока формируется полноценный иммунный ответ. ВНО несет гены не менее чем пяти белков, блокирующих различные этапы развития воспаления в участках размножения вируса (SPI-2, G3R, растворимых аналогов рецепторов фактора некроза опухолей — TNF и гамма-интерферона — гаммаlFN) и предотвращающих развитие системных реакций (растворимый рецептор интерлейкина-1бета — IL-1 бета). Как правило, все эти белки обладают одновременно несколькими активностями. Например, TNF-связывающий белок необходим еще и для развития генерализованной инфекции, столь характерной для ВНО. Поэтому эти белки считаются факторами вирулентности ВНО [Маренникова С.С., Щелкунов С.Н., 1998].
Система блокирования интерферона у ВНО также мультигенна (не менее 5 белков), поэтому он очень устойчив к его действию. Синтезируемые вирусом аналоги растворимых рецепторов IFN обоих типов, интерферируют с IFN, связывая его клеточные рецепторы. Это приводит к блокированию антивирусного состояния клетки и предотвращает лейкоцитарную инфильтрацию в участки вирусной репликации [Alcami A., Smith G., 1996].
Для облегчения распространения ВНО по тканям организма хозяина, в его геноме содержится ген C11R VAC–COP, кодирующий белок VGF, отнесенный к семейству эпидермального фактора роста. Он стимулирует рост и/или метаболическую активность неинфицированных клеток, обеспечивая тем самым распространение ВНО по организму. На эффективность диссеминации ВНО в организме человека также влияют белки оболочки внеклеточных вирионов (прежде всего, гемагглютинин) и анкиринподобные белки (определяют круг хозяев вируса). Пока не идентифицированы вирусные белки, подавляющие созревание гликопротеидов главного комплекса гастосовместимости класса I и тем самым снижающих эффективность представления на поверхности инфицированной клетки вирусных антигенов специфическим цитотоксическим Т-лимфоцитам [Маренникова С.С., Щелкунов С.Н., 1998].
Однако большое количество синтезируемых ВНО белковых структур неизбежно обнаруживаются иммунной системой хозяина, Поэтому патогенез ВНО построен на компромиссе между скоростью развития иммунного ответа хозяина (индуцируется полный спектр клеточно-опосредованных и гуморальных иммунных ответных реакций) и скоростью размножения вируса до количеств, достаточных для его передачи другому реципиенту. Например, ранее всех появляющиеся антигемагглютинины (2–3 день болезни), достигают своего максимума между 12 и 15 днями, а максимальные титры вируса в зеве определяются на 3-й и 4-й дни и держатся до 8-го дня у 95–100 % больных. Затем они начинают снижаться [Маренникова С.С., Щелкунов С.Н., 1998]. У переболевших оспа оставляет длительный, стойкий и стерильный иммунитет, что исключает возможность повторного использования вирусом для своего размножения того же хозяина. Эта та цена, которую вирус платит за сложность своего генома иммунной системе человека. Однако заболевший успевает инфицировать от 5 (в среднем) до 38 человек, из них не менее трети погибнет — это уже цена, которую платим мы за тоже самое (рис. 30).
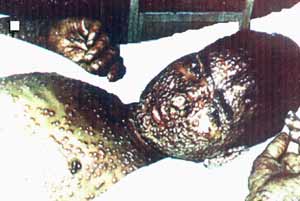
Рис. 30. Внешний вид больного натуральной оспой. Оспенные папулы. Возбудитель максимально накапливается на ранней стадии инфекции, стремясь успеть сменить хозяина до развития у него иммунитета. Используемый ВНО воздушно-капельный механизм передачи позволяет одному больному инфицировать десятки людей. Но эта цепочка рано или поздно прервется либо из-за гибели инфицированных либо из-за приобретения иммунитета чувствительной популяцией. Рисунок из книги Е.П. Шуваловой (1974)
Патогенез ВИЧ определяется его стратегией, заключающейся, прежде всего, в необычайной длительности персистирования в организме человека, не сопровождаемое специфическими клиническими, проявлениями. Но длительность этого состояния, это ничто иное, как наше субъективное восприятие процесса, протекающего в иных временных измерениях. Патогенность для ВИЧ означает «захват власти» над геномом хозяина [Лем С., 1989], где он становится одним из его оперонов и наследуется в цикле деления клеток. Однако для того, что бы быть не узнанным иммунной системой человека, ВИЧ должен хорошо укрыться.
Укрытие ВИЧ осуществляется, по меньшей мере, на двух уровнях — генетическом и клеточном. Генетическая маскировка вируса заключается в том, что его ДНК-форма (провирус), встроенная в геном хозяина, не имеет антигенов и для иммуноглобулинов недоступна [Медников Б.М., 1990].
На клеточном уровне ВИЧ не распознается иммунной системой благодаря тому, что:
1) зрелый вирион ВИЧ покрыт мембраной и гликопротеидной оболочкой из организма хозяина (на собственную оболочку у него не хватает «средств», т. е. генов), а поэтому они не могут быть антигенами;
2) те немногие участки аминокислотных последовательностей гликопротеидов ВИЧ — gp120 и gp 41, которые не экранированы и могут быть антигенами, сильно вариабельны (петлеобразный участок gp120);
3) кроме Т-хэлперов ВИЧ проникает и в другие клетки — как содержащие на своей поверхности рецепторы CD4 (глиальные клетки мозга), так и способные к фагоцитозу, в первую очередь моноциты в макрофаги. Именно последние захватывают комплексы ВИЧ — антитело. Поэтому иммуноглобулины, в конечном итоге, не подавляют инфекцию, а способствуют ей [Медников Б.М., 1990].
Если для существования ВИЧ в хозяине ему достаточно интегрироваться с его геномом, то для смены хозяина он должен воспроизвести свое потомство и найти наиболее эффективный для своей стратегии паразитизма механизм передачи. Т. е. он неизбежно должен воспользоваться ресурсами своего хозяина, а, следовательно, повредить его, не обладая теми мощными арсеналами генов, которыми располагают возбудители быстрых инфекций. Клинически повреждения при СПИДе проявляется столь большим количеством патологических симптомов, что объяснить их только действием малочисленных продуктов генов ВИЧ (как это мы делали в отношений ВНО), не удается. Также трудно свести всю обнаруживаемую патологию к последствиям паразитизма многочисленных возбудители сопутствующих инфекций.
Наиболее ярким показателем патогенного воздействия вируса является прогрессивное уменьшение числа CD4+ Т-лимфоцитов крови — основная причина постепенного угнетения иммунной системы [Лысенко А.Я. и др., 1996]. ВИЧ разрушает Т-клетки непосредственно, когда размножается в них, и когда размножившиеся частицы вируса покидают клетку, разрушая клеточную мембрану. Нo ВИЧ может уничтожать CD4+ Т-лимфоциты и опосредовано. На поверхности зараженной клетки располагается вирусный белок gр120, обладающий высоким сродством к рецепторному белку поверхности CD4+ Т-лимфоцитов (CD4). Из-за этого нормальные CD4+ Т-лимфоциты присоединяются к инфицированным клетками и сливаются с ними, образуя нежизнеспособную многоклеточную структуру — синтиций. Вместе с пораженными Т-лимфоцитами гибнут все здоровые, включившиеся в синтиций. Также ВИЧ вызывает нормальный клеточный иммунный ответ. При этом цитотоксические клетки (с помощью антител или сами по себе) уничтожаютинфицированные CD4+ Т-лимфоциты, на поверхности которых имеются вирусные белки. При ВИЧ-инфекции в крови может циркулировать свободный белок gp120. Он способен связываться с молекулами CD4 нормальных клеток, в результате иммунная система принимает их за инфицированные клетки и атакует [Редфитд Р., Берке Д., 1988]. Кроме того, gp120 сходен со многими другими рецепторами человека (гормонов, регуляторов роста тканей и др.). Поэтому, антитела к нему атакуют большое количество тканей, подавляя биосинтез самых различных веществ, и, в результате, вызывают полное истощение организма больного (рис. 31).
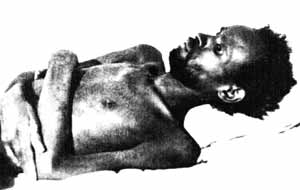
Рис. 31. Внешний вид больного СПИДом. Вирусный gp120 сходен со многими рецепторами человека (гормонов, регуляторов роста тканей и др.). Поэтому антитела к нему атакуют большое количество тканей, подавляя биосинтез самых различных веществ, и, в конце концов, вызывают полное истощение организма больного [Кульберг А.Я., 1988], Для смены хозяина вирус использует половой путь передачи, одновременно необходимый для сохранения вида хозяина — разорвать такую эпидемическую цепочку невозможно. Рисунок книги В.И. Покровского и В.В. Покровского (1988)
Любопытно проявление феномена апоптоза при взаимодействии клетки и паразита II типа. Оно полностью противоположно тому, которое демонстрирует ВНО и другие возбудители, использующие первую стратегию паразитизма. ВИЧ не располагает собственными генами, кодирующими белки, которые бы каким-либо образом участвовали в этом процессе. Однако инфицированные им CD4+ Т-лимфоциты при контакте способны быстро уничтожать такие же, но не инфицированные соседние клетки. Причем в условиях in vitro, этот процесс наблюдается до образования синтициев. Интересно, что цитолизу при явлениях апоптоза, подвергались как активированные, так и покоящиеся CD4+ Т-лимфоциты [Nardelli В. et al., 1995].
У ВИЧ совершенно противоположное, чем у ВНО взаимодействие с цитокиновым комплексом. Он не подавляет их, синтезируя растворимые рецепторы, а наоборот, индуцирует в ЦНС человека синтез самих цитокинов (TNF, интерлейкины) инфицированными макрофагами, клетками микроглии и астроцитами, тем самым, вызывая сильное нейротоксическое действие [Levy J.A., 1989]. В норме цитокины действуют в основном в месте локализации антигена. Их действие на уровне центральных органов иммунитета является быстротечным и импульсным. При ВИЧ-инфекции они продуцируются непрерывно, постоянно оказывая токсическое действие на организм человека [Лысенко А.Я. и др., 1996].
И уж почти мистически выглядит обоснованное предположение А.Я. Лысенко (1990) о преимущественной элиминации ВИЧ тех клонов Т-клеток, которые до инфицирования вирусом длительно накапливались в большом количестве как противодействие патогенному потенциалу популяций микроорганизмов-оппортунистов. Первоочередная селективная деструкция ВИЧ именно таких клонов Т-клеток, создает необходимые благоприятные условия для проявления оппортунистами своих патогенных потенций.
Эти примеры наглядно показывают, что «захват власти над геномом хозяина» позволяет паразитическому микроорганизму изощренно и разнообразно противодействовать хозяину.
Элиминация же CD4+ Т-лимфоцитов ведет к потере контроля над проникающими в организм возбудителями грибковых, протозойных и других инфекций, а также за трансформированными вирусом злокачественными клетками. По мере исчерпания резерва CD4+ Т-лимфоцитов и снижения концентрации вируснейтрализующих антител, у всех ВИЧ-инфицированных лиц формируется манифестная, четко диагностируемая по наличию характерных оппортунистических заболеваний, стадия — собственно СПИД (рис. 32).

Рис. 32. Исход контакта с ВИЧ.
Схема течения ВИЧ-инфекции: ± — стадия, развивающаяся не у всех инфицированных; ПГЛП — прогрессирующая генерализованная лимфаденопатия [Лысенко А.Я. и др., 1996]
У кого же способ смены хозяина эффективнее — у ВНО или ВИЧ? Выше мы отметили, что используемый ВНО воздушно-капельный механизм передачи позволяет одному больному инфицировать десятки людей. Но эта цепочка либо из-за гибели инфицированных, либо из-за приобретения чувствительной популяцией иммунитета, рано или поздно прервется. Однако наиболее распространенный механизм передачи ВИЧ — половой, одновременно необходим для сохранения вида-хозяина. Поэтому, если в природе отсутствует механизм ограничения численности ВИЧ-инфицированных людей, то один больной способен инфицировать все человечество. Растянутость этого процесса во времени не имеет значения за пределами человеческих ощущений.
Эволюционная цена, уплаченная обоими паразитами демону Дарвина. Выше мы уже отметили, что осповирусы по ряду свойств аналогичны бактериям. Если рассматривать их в ряду бактерий, то, по мнению В.М. Жданова (1988), последовательность эволюционных событий будет выглядеть следующим образом: риккетсии — хламидии — вирусы оспы, т. е. налицо дегенеративная эволюция, когда большая адаптация к конкретному хозяину сопровождается упрощением строения паразита. Для большинства риккетсии внутриклеточный паразитизм обязателен, у хламидий он неизбежен, поскольку они не имеют митохондрий и потому являются энергетическими паразитами. Вирусы оспы с их сложной структурой и автономной репликацией ДНК (практически ничем не отличающейся от бактериальной), можно представить как дальнейший этап дегенеративной эволюции, сопровождающейся потерей синтезирующего белок аппарата.
Далее это упрощение происходит уже на межвидовом и межштаммовом уровне. Особенно наглядно дегенеративная эволюция наблюдается при сравнении геномов ВНО с геномами других осповирусов, имеющих более широкий круг хозяев. И здесь для исследователя, привыкшего считать, что патогенность микроорганизмов случайна, временна и обусловлена наличием каких-то дополнительных факторов патогенности, может возникнуть необходимость преодоления психологического барьера. Оказывается, совсем не обязательно, что геномы более вирулентных видов организованы более сложно и имеют больше генов, ответственных за синтез и регуляцию «факторов патогенности», чем менее патогенные виды этого семейства.
Например, у ВНО разрушена открытая рамка считывания (ОРТ) гена белка, обладающего IL-1бета-связывающей активностью. Однако вирус вакцины синтезирует этот белок, считающийся фактором патогенности. Тогда почему ВНО вирулентней для человека? С.С. Маренникова и С.Н. Щелкунов (1998) считают, что из-за блокирования у ВНО IL-1бета-связывающего белка не ингибируются системные реакции организма, в то время как снижение местных воспалительных реакций белком SPI-2, приводит к более активному размножению вируса. Неконтролируемое же развитие системных реакций ослабляет общую устойчивость организма, и патогенное действие вируса усиливается. У ВНО утратил свое значение и ген Збета-гидро-ксистероиддегидрогеназы (Збета-HSD), играющий важную роль в биосинтезе стероидных гормонов. Зачем? Стероидные гормоны так же обуславливают столь необходимые ВНО имуносупрессию и противовоспалительное действие! Оказывается, это вызвано различиями гормонального регулирования у грызунов и человека. Поэтому рассматриваемый ген утратил свое значение у такого строго антропоноза, каким является ВНО [Маренникова С.С., Щелкунов С.Н., 1998]. В отличие от вируса вакцины и вируса оспы коров, у ВНО разрушены ОРТ всех белков межклеточных каналов (всего семейства!). С.С. Маренникова и С.Н. Щелкунов (1998) обратили внимание и на то, что по сравнению с вирусом вакцины, у ВНО за счет мутационных изменений разрушено значительное число других ОРТ.
У ВНО существует механизм, ограничивающий возможность его генетической рекомбинационной изменчивости по сравнению с другими видами ортопоксвирусов, характеризующимися относительно высоким уровнем перестроек геномов. У него необычайно маленького размера инвертированные терминальные повторы (TIR) — от 518 до 1051 пн, у вируса вакцины на порядок больше: 10–12 тпн. Кроме того, у штаммов вируса вакцины они содержат различающиеся наборы генов. У ВНО TIR — это минимальный теломерный элемент, необходимый для репликации поксвирусной ДНК. С.С. Маренникова и С.Н. Щелкунов (1998) считают, что столь малый размер TIR существенно ограничивает возможность генетической рекомбинации ВНО. Такая консервативность свидетельствует о необычайно глубокой адаптации ВНО к организму человека. Разрушение же рамок считывания ряда генов, это такой же процесс, как и утрата внутренними паразитами органов чувств, упрощение до предела нервной системы и исчезновение пищеварительной у ленточных червей — они им больше не нужны, т. е. отбор перестал следить за формированием структуры, и этого оказалось достаточно, что бы она исчезла.
Определить цену, заплаченную ВИЧ демону Дарвина за столь совершенный механизм паразитизма, гораздо труднее, так как мы вообще еще плохо знаем, что такое ретровирусы в эволюционном аспекте.
Есть основания полагать, что РНК, как более просто построенная и менее устойчивая полимерная структура, предшествовала ДНК и белкам в эволюции. В любой клетке существует самостоятельный «мир РНК», который занимает центральное положение в процессах жизнедеятельности, а остальные структуры клетки оказываются как бы эволюционной надстройкой [Гладилин К.Л., Суворов А. Н., 1995]. Позже образовавшаяся обратная транскриптаза, видимо, стала одним из тех инструментов, которым демон Дарвина пользовался на ранних этапах биологической эволюции. Три уникальные ферментативные активности обратной транскриптазы (результат влияния трех генов, образовавшихся в разные геологические эпохи белков), позволили ей сыграть важную роль при переходе из царства РНК к царству ДНК:
1) ДНК-полимеразная — синтезирует одноцепочечную ДНК, комплементарную РНК;
2) рибонуклеазная — расщепляет исходную РНК;
3) интегразная — позволяет интегрироваться синтезированной на матрице РНК новой ДНК, с ДНК, уже закрепленной естественным отбором.
Своим появлением живые системы обязаны ретроэлементам, составляющим значительную часть геномов позвоночных [Leilb M.C., Seilarth W., 1996]. Следы древних процессов, в которых участвовали ретроэлементы и ретровирусы, запечатлены и в нашем геноме (табл. 7). В ДНК 19-й хромосомы человека содержится около 700 nef-подобных элементов (nef — это ген негативного регуляторного фактора ВИЧ, определяющего его способность прекращать размножение и переходить в состояние покоя), а также 16 участков, где с nef соседствует область, гомологичная env ВИЧ [Несмеянов Х.М. и Тарантул В.З., 1997]. По данным L. Roswitha и соавт. (1996), на долю последовательностей эндогенных ретровирусов HERV приходится около 1 % генома человека и они необходимы для поддержания его пластичности. Ретропозиция считается главным регулятором темпа эволюции, включая видообразование [Jurgen В., Henri Т., 1996]. Поэтому, можно предположить, что ретровирусы являются древнейшими паразитами, появившимися одновременно с геномами, имеющими интрон-экзонную структуру (древнейшие из известных — архебактерии: 3,8 млрд. лет). Что они потеряли, а что приобрели за этот период, судить трудно. Эти древние формы жизни, хотя и являются облигатными паразитами, более адаптированы к существованию на планете чем человек и, даже, позвоночные. Но для частного случая — механизма передачи, определить уплаченную ими цену, видимо, можно. Это касается различных предположений о том, что бы было, если бы ретровирусы передавались воздушно-капельным путем [Лем С., 1989].
Таблица 7














