СТЕКЛООБРАЗНОЕ СОСТОЯНИЕ
Вещества в твердом состоянии при обычной температуре и давлении могут иметь кристаллическое или аморфное строение. В природе наиболее распространены кристаллические твердые вещества, для структуры которых характерен геометрически строгий порядок расположения частиц (атомов, ионов) в трехмерном пространстве. Кристаллическое состояние является стабильным при обычных условиях и характеризуется наиболее низкой внутренней энергией. Твердые кристаллические вещества имеют четкие геометрические формы, определенные температуры плавления, в большинстве случаев проявляют анизотропию, т.е. их физические свойства (показатель преломления, теплопроводность, скорости растворения и роста кристаллов и др.) неодинаковы при измерении в различных направлениях.
Стеклообразное состояние вещества представляет собой аморфную разновидность твердого состояния. Стеклообразное состояние является метастабильным, т. е. характеризуется избытком внутренней энергии. Пространственное расположение частиц вещества, находящегося в стеклообразном состоянии, является неупорядоченным, что подтверждается результатами рентгеноструктурных исследований.
Согласно законам химической термодинамики переход веществ из стеклообразного состояния в кристаллическое должен осуществляться самопроизвольно, однако высокая вязкость твердых веществ делает невозможным поступательное движение частиц, направленное на перестройку структуры. В твердых телах частицы совершают только колебательные движения относительно положения равновесия.
2. СТРОЕНИЕ СТЕКЛА
Физические свойства веществ зависят от их состава и строения. Строение стекол является одним из разделов единой проблемы строения вещества. В связи с этим необходимо подчеркнуть, что современные представления о строении стекла базируются на фундаментальных положениях теоретических разделов неорганической и физической химии, кристаллохимии, химии и физики твердого состояния, и, кроме того, включают идеи и обобщенные положения отдельных гипотез строения стекла, основу которых составляют эмпирические зависимости свойств от состава и строения.
Отсутствие прямых методов исследования аморфных веществ, отсутствие способов плоскостного изображения объемно неупорядоченных структур пока не позволяют создать завершенную теорию строения стекла.
Существует несколько теоретических направлений решения проблемы строения стекла, среди которых наиболее широкое распространение получили кристаллохимическое и валентно-химическое. Они рассматривают строение стекла на электронном, атомном или молекулярном уровнях, базируясь на основных положениях кристаллохимии, теорий химической связи, зонного строения твердых тел. Преимущественное развитие этих направлений обусловлено в первую очередь прогрессом в области изучения структуры веществ, находящихся в кристаллическом состоянии. Следует отметить, что основополагающие гипотезы строения стекла А. А. Лебедева (1921) и Захариасена (1931) появились вскоре после открытия прямого метода изучения структуры кристаллов—метода рентгеноструктурного анализа (Лауэ, 1912). Менее распространены представления о полимерном строении стекол, кинетический подход к процессам твердения расплавов в виде стекла, а также представления о строении стекол на основе концепций о строении жидкостей или расплавов.
Учитывая сложность и многоплановость вопроса строения стекла, ограничимся рассмотрением основных положений кристаллохимического и валентно-химического направлений, иллюстрируя их конкретными примерами строения силикатных стекол по мере усложнения их состава — от простейшего по составу однокомпонентного кварцевого стекла до двух-, трех- и многокомпонентных составов промышленных стекол.
Кварцевое стекло
Структурной основной единицей кварцевого стекла является кремнекислородный тетраэдр. Атом кремния окружен четырьмя атомами кислорода, расположенными симметрично в вершинах тетраэдра.
Структура кварцевого стекла выполнена из тетраэдров SiО4, соединенных друг с другом вершинами через атомы кислорода. В результате образуется непрерывный пространственный каркас, отличающийся от геометрически правильных решеток кристаллических модификаций кварца отсутствием дальнего порядка в расположении и ориентации тетраэдров. Тетраэдры SiО4 не образуют в пространстве геометрически правильных сочленений в виде шести членных колец, характерных для структуры высокотемпературного кристобалита.
Структурная сетка стекла выглядит как искаженная кристаллическая решетка. Искажение заключается в произвольном варьировании значений угла связи Si—О—Si между соседними тетраэдрами в структуре стекла.
Группировка [SiО4]4- имеет избыточный отрицательный заряд (-4), но каркасная сетка из тетраэдров SiО4 в целом электронейтральна, так как каждый атом кислорода связан с двумя атомами кремния. В структуре кварцевого стекла все атомы кислорода мостиковые.
Структуры кристаллических и стеклообразной форм диоксида кремния не являются плотноупакованными, так как тетраэдры соединяются вершинами, а не ребрами и не гранями. В кварцевом стекле имеются свободные структурные полости, ограниченные в пространстве мостиковыми атомами кислорода.
Именно благодаря наличию в структуре свободных полостей, кварцевое стекло обладает наиболее высокой газопроницаемостью (гелий, водород, неон) по сравнению с другими силикатными стеклами, в составе которых кроме диоксида кремния присутствуют оксиды щелочных и щелочноземельных металлов.
Фосфатные стекла
Фосфатные стекла построены из тетраэдров [PО4]3. Один из атомов кислорода тетраэдра не может участвовать в образовании связи с другими компонентами структуры из-за наличия двойной связи фосфор — кислород. В структуре фосфатных стекол мостиковыми могут быть только три атома кислорода фосфор кислородного тетраэдра.
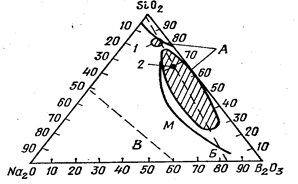
Рис. 2.1. Область стеклообразования и область ликвации в системе Na2O—B2O5— SiO2
А— область ликвации; Б—линия, по которой наиболее полно проявляется борная аномалия;
В— граница стеклообразования; М— граница опалесцирующих стекол по О. С. Молчановой;
/ — стекло пирекс; 2 — стекло викор
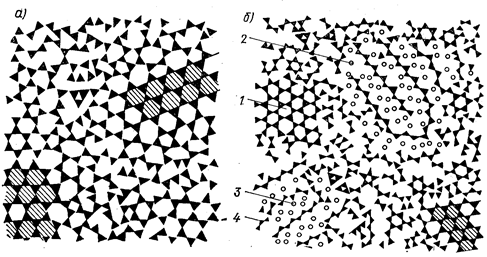
Рис. 2.2. Схемы кристаллитного строения кварцевого (а) и натриево-силикатного (б) стекол (по Порай-Кошицу)
1 —кристаллы кварца; 2— кристаллы силиката натрия; 3— ионы натрия; 4—тетраэдры Si0.
По данным рентгеноструктурного анализа расстояние Р—О в стеклах равно 0,157 нм, угол Р—О—Р—1400.
В этом отношении структура Р203 отличается от структур других стеклообразователей, у которых все атомы кислорода мостиковые. Пространственная структура фосфатных стекол может состоять из колец различного размера, образованных чередующимися атомами фосфора и кислорода, лент или цепочек из тетраэдров РО4.
Результаты рентгеноструктурного анализа показывают, что структура двойных фосфатных стекол подобна структуре двойных силикатных стекол по следующим двум параметрам: структурной основной единицей являются тетраэдрические элементокислородные группировки; с добавлением модифицирующих оксидов растет число не мостиковых атомов кислорода.
Свойства стекол.
Все типы стекол, независимо от их химического состава и температурной области затвердевания, обладают специфическими свойствами, которые отличают их от кристаллов и жидкостей.
Стекла рентгеноаморфны вследствие неупорядоченного атомного строения. В структуре стекла отсутствует дальний порядок, т. е. систематическая повторяемость элементарных объемов структуры, характерная для кристаллических веществ.
Если ориентировочно определить межплоскостное расстояние, соответствующее максимуму аморфного гало, то оно оказывается близким основному дифракционному максимуму кристобалита—0,415 нм. Однако в структуре стекла частицы находятся не на строго определенных расстояниях, как в кристобалите или других кристаллических модификациях кварца, а на расстояниях больших и меньших относительно некоторого среднестатистического значения.
Стекла изотропны, если они однородны по составу, свободны от напряжений и дефектов. Изотропия свойств стекол, как и других аморфных сред, обусловлена отсутствием направленной в пространстве ориентации частиц. Оптическая анизотропия может возникнуть в стекле в результате действия растягивающих или сжимающих напряжений (явления оптической анизотропии).
Температурный интервал стеклования. Стекла не имеют определенной температуры затвердевания или плавления. Оба эти процесса происходят постепенно в некотором температурном интервале. При охлаждении расплав переходит из жидкого в пластическое состояние, и только затем—в твердое (процесс стеклования). Наоборот, при нагревании стекло переходит из твердого в пластическое состояние, при более высоких температурах—в жидкое (размягчение стекла).
Температурный интервал, в котором происходит процесс стеклования или обратный ему процесс размягчения, называется интервалом стеклования и ограничен двумя температурами: со стороны высоких температур Т f, со стороны низких температур Tg (температура стеклования) (рис. 3.1).
При температуре Tg стекло обладает свойствами твердого упругого тела с хрупким разрушением. Температура Tf является границей пластического и жидкого состояний. При температуре Тf из стекломассы уже удается вытягивать тонкие нити.
Понятия о Tg и Tf были введены Тамманом. Подстрочные индексы «g» и «f» являются первыми буквами слов «Glass» — стекло и «Flissigkeit» — жидкость.

Рис. 3.1. Зависимость свойства Р и его производных в интервале стеклования (по Тамману)
/— твердое состояние; // — пластическое; III — жидкое (расплав)

Рис. 3.2. Влияние условий переохлаждения на мольный объем вещества в расплавленном, кристаллическом и стеклообразном состояниях.
Процессы размягчения стекла или затвердевания стекломассы являются однофазными в отличие от плавления кристаллических веществ или кристаллизации расплавов. При размягчении стекла в интервале стеклования отсутствует жидкая фаза.
Свойства стекол по характеру изменения в интервале стеклования делят на три группы. К первой группе относятся свойства Р, характеризующие функцию состояния веществ (внутренняя энергия Е, мольный объем V, энтальпия Н, энтропия S) и кинетические свойства (вязкость), удельное сопротивление r). Свойства первой группы с повышением температуры изменяются постепенно. В интервале стеклования кривая имеет закругленный перегиб (рис. 3.1, кривая 1 ), соответствующий наиболее резкому изменению свойств первой группы. Свойства второй группы представляют собой первую производную по температуре dP/dT от свойств первой группы (коэффициенты термического расширения—линейный и объемный, теплоемкость). Кривая 2 характеризует температурный ход зависимости свойств второй группы. Можно видеть, что в интервале стеклования первая производная dP/dT имеет точку перегиба Tg. Третья группа включает свойства (теплопроводность, диэлектрические потери), которые являются вторыми производными по температуре от функций состояния (кривая 3). Температурная зависимость d2P/dT2 имеет максимум или минимум в точке Tw.
Характер изменения свойств стекол при нагревании резко отличается от температурной зависимости свойств кристаллических веществ. Для последних нет деления свойств на группы, характер температурных кривых однотипен: незначительное линейное изменение свойств до температуры плавления, резкое скачкообразное изменение свойств при температуре плавления. Температуры Tg, Tw, Tf лежат всегда ниже температуры плавления соответствующего кристалла.
Значения температур Tg, Tf, а также интервал стеклования (Tg— Tf) зависят от состава стекла.
Температуры Tg и Tf принадлежат к числу характеристических точек на температурной кривой вязкости. Температуре стеклования Tg соответствует вязкость стекломассы, равная 10123 Па-с, а температуре Tf— вязкость 108 Па-с.
Из (рис. 3.2) можно видеть, что объем стекла в отличие от объема кристаллического вещества не является константой для данного состава. Он зависит от температурно-временных условий получения стекла.
Изотермическая выдержка закаленного стекла при температуре (T<Tg) будет сопровождаться уменьшением объема по прямой l т в связи со стремлением структуры достичь равновесного состояния при температуре Т (см. рис. 3.2). Время структурных перестроек в области низких температур исключительно велико
Неравновесное состояние структуры стекла находит свое выражение в явлениях термического последействия (так называемое, «вековое повышение точки нуля» и «депрессия точки нуля»), широко известных при эксплуатации точных стеклянных шкал и термометров.
ЭМАЛИ И ПОКРЫТИЯ
Составы и свойства эмалей
В процессе формирования эмалевого покрытия эмалевая фритта, первоначально резко закаленная от температуры варки грануляцией в воду или прокаткой между водоохлаждаемыми валиками, претерпевает многократный нагрев от твердого до вязкого состояния при температуре обжига и последующее охлаждение. Так, при эмалировании крупногабаритной химической аппаратуры цикл нанесения и обжига каждого слоя длится часами. В подавляющем большинстве случаев эмаль на поверхность изделия наносят шликерным способом. Шликер — суспензия, включающая эмаль, иногда — кристаллические наполнители, глинистые минералы, электролиты, вводимые для обеспечения седиментационной устойчивости, и воду. Приготовляют шликер мокрым помолом эмали в шаровых мельницах, в процессе которого эмаль взаимодействует с компонентами шликера.
Таким образом, процесс эмалирования следует рассматривать как вторичную термическую обработку эмали в нестационарных температурных полях, осложненную разнообразными химическими взаимодействиями при изготовлении и хранении шликера. Несколько проще обстоит дело при нанесении эмали на горячее металлическое изделие
пудровым способом, при котором эмаль подвергают сухому помолу, но этот метод применяют лишь для чугунных изделий.
В промышленности эмали варят в периодических вращающихся печах при 1250—1350°С, не позволяющих для многих типов эмали достаточно полно провести гомогенизацию и осветление расплава. Практически эмаль не достигает равновесной структуры и подвержена структурным преобразованиям в процессе нанесения. Вместе с тем следует отметить, что для достижения максимальной химической устойчивости обязательным условием является обеспечение однородности микро- и макроструктуры эмалевого покрытия. Это достигается как подбором состава эмали, так и соответствующей технологией нанесения.
Однако неоднородность эмалевого покрытия не всегда является его недостатком. Многие изделия, полученные литьем чугуна или алюминиевых сплавов, являются чрезвычайно газонасыщенными. В таких случаях для получения бездефектных покрытий используют неоднородный и пористый грунтовый слой, который затем перекрывают соответствующими покровными эмалями. Именно по этой причине для чугунных изделий используют, как и прежде, фриттование, то есть не полностью проплавленные эмали, в простейшем случае — на основе смеси из кварцевого стекла, полевых шпатов, буры, плавикового шпата и соды. Для этой же цели иногда применяют «сырые» эмали, которые, как и некоторые глазури, представляют собой суспензию сырьевых компонентов.
Создавая тем или иным путем неоднородность структуры эмалевого покрытия, стремятся обеспечить достаточно высокий уровень термических и механических характеристик. Микронеоднородная структура эмалевого покрытия в этом случае создается либо методом направленной кристаллизации стекла (ситаллизацией), либо введением в покрытие 10—15 % дисперсных кристаллических наполнителей.
Наиболее прост технологический процесс эмалирования золота, серебра, меди и их сплавов. Основной функцией эмали является создание декоративного эффекта вследствие окраски и интенсивного блеска покрытия. Эмалирование производят при 600—650°С с использованием легкоплавких окрашенных прозрачных щелочно-свинцовосиликатных эмалей или заглушенных (непрозрачных) эмалей с добавлением необходимого количества керамических пигментов. Например, используют исходную фритту состава, мол.,%: 40 КдО, 15 РЬО, 30 SiО2 и 15 SnО2.
Хотя чугун стали эмалировать раньше, чем многие другие металлы, до настоящего времени эмалирование чугуна наиболее сложно из-за его газонасыщенности и непостоянства структуры и свойств металла, которые подвержены в том числе и сезонным колебаниям. Первый слой в этом случае формируют с использованием плавленых и фриттованных грунтовых эмалей. Сцепление обеспечивается в основном взаимным прониканием эмали и пористого металла в переходном слое, применять оксиды сцепления во многих случаях не требуется.
В том случае, когда в составе эмали содержание фтора указывается в частях по массе сверх 100 %, соответствующее его количество вводят криолитом NasAlFg или кремнефтористым натрием NaaSiFe. В расчете шихты при этом должно быть учтено соответствующее этим соединениям количество оксидов натрия, алюминия и кремния.
Грунты для чугуна изготовляют фриттованием. Фриттование следует проводить при невысоких температурах во избежание образования кристобалита, которое ведет к скалыванию эмали с поверхности изделий. Обычный мельничный состав при изготовлении шликера содержит, ч. по массе: 100 эмали, 10 глины, 10 кварца, 1 буры, 50—60 воды.
Чтобы увеличить интервал температур, в котором формируется доброкачественное покрытие, обычно используют шликер следующего состава, ч. по массе: 70 фритта эмали 2015, 30 фритта эмали 3132, 10—30 кварцевого песка, 5—6 глины, 1—2 буры и 50—55 воды. Такие грунты применяют при эмалировании стальной посуды.
Эмали для кислых сред
Для защиты оборудования, работающего в кислых растворах, по В.В.Варгину следует использовать эмали состава, % по массе: 64—69 SiO2, 5—6 TiO2, 3—4 В2О3, 0—5 CaO, 19—22 Na2O и 3—4 фтора на 100 ч. по массе эмали. Выбор подобного состава обусловлен необходимостью обеспечить не только антикоррозионные свойства, но и бездефектность покрытия, при этом решающим фактором является низкая вязкость при температуре обжига. При исследовании коррозии эмалевых покрытий, в том числе в автоклавных условиях, было установлено, что определяющим фактором является содержание кремнезема. Максимальная устойчивость эмали в кислых растворах достигается при содержании SiO2 70—75 % по массе и подавлении структурных преобразований — кристаллизации и ликвации путем использования полищелочного эффекта и целенаправленного выбора соотношения других компонентов, обеспечивающих низкую вязкость эмали при температуре обжига покрытия. В этом случае можно обеспечить работоспособность покрытия в кислых средах при температурах до 250°С и соответствующих давлениях. В последние годы особенно актуально создание покрытий, работоспособных в средах со значениями рН от 1 до 14, так называемых кислотощелочестойких эмалей.
Достаточные термомеханические свойства покрытия обеспечиваются при введении 10—15 % кристаллических наполнителей при формировании покрытия. Во многих случаях эмалевое покрытие должно работать при высоких механических, абразивных и термических нагрузках. В таких случаях применяют стеклокристаллические — ситаллизи-рованные—покрытия, термомеханические характеристики которых в 1,5—2,5 раза выше, чем у стекловидных эмалей.
Сопоставление составов стекловидных и стеклокристаллических эмалей для химической аппаратуры позволяет заметить существенные различия. В случае стекловидных эмалей выбор компонентов и их соотношения обеспечивает, возможно, более однородную структуру покрытия. Характерно использование как высококремнеземистых, так и многоциркониевых составов. В стеклокристаллических эмалях соотношение компонентов и введение инициаторов кристаллизации (P2О5 и др.) вызывает процессы ликвации и объемной кристаллизации при формировании покрытия или дополнительной термической обработке. Составы стекловидных эмалей и технология их нанесения обеспечивают низкую скорость коррозии покрытия в водных растворах—0,1—0,2 мм/год. Стеклокристаллические покрытия имеют микронеоднородную структуру, обеспечивающую торможение разрушения на границе раздела фаз, что определяет повышение термомеханических свойств, но в то же время и увеличение скорости коррозии. В большинстве случаев в этих эмалях кристаллизуются несколько фаз: модификации кремнезема, мета- и дисиликат лития, рутил и др. Кристаллизация идет во время обжига, поэтому структура покрытия зависит от скорости нагрева и охлаждения. Исключением являются эмали: содержание, % по массе 55-58 SiO2, 0-3 MgO, и др. Во время обжига в эмали протекает лишь процесс ликвации, а при дополнительной термической обработке одна из фаз кристаллизуется в форме неупорядоченного твердого раствора со структурой кварца. Такое течение структурных преобразований обеспечивает однородную микрогетерогенную структуру покрытий с размером кристаллов менее 0,1 мкм. Во многих случаях устойчивость к коррозии материала с такой микронеоднородностью мало отличается от устойчивости стекловидных покрытий, уступая им в щелочных средах, но превосходя в солевых расплавах.
Жаростойкие покрытия
При формировании жаростойких покрытий на легированных сталях и сплавах в основном используют малощелочные или бесщелочные бариевосиликатные эмали. В покрытие стремятся ввести возможно большее количество тонкодисперсных огнеупорных наполнителей. Это требует очень тонкого измельчения эмали при изготовлении шликера и проведения высокотемпературного обжига в защитной газовой среде. Подобная технология приемлема лишь для очень ответственных изделий. То же относится и к формированию защитных покрытий жаростойких металлов, для которых наиболее перспективно формирование покрытий с заданными свойствами на основе процессов диффузии.
Эмали для легких сплавов
Для эмалирования легких сплавов необходимо использовать легкоплавкие эмали.
Свинецсодержащие и фосфатные эмали для легких сплавов широкого распространения в настоящее время не имеют. В качестве примеров титаносиликатных эмалей приведены составы: наиболее легкоплавкой 0.5-1.5 LiO, 20-25 К2О; и наиболее химически стойкой 20.8 Al2O3, 20.8 Na2O эмалей. Различное соотношение компонентов при достаточно близком составе отражает возможность управлять свойствами покрытия путем изменения структурных преобразований в эмали при ее обжиге на металлическом изделии. Таким образом, как и в технологии стекла, управление структурными преобразованиями в эмали является наиболее рациональным путем совершенствование эмалевых покрытий.
СТЕКЛООБРАЗНОЕ СОСТОЯНИЕ
Вещества в твердом состоянии при обычной температуре и давлении могут иметь кристаллическое или аморфное строение. В природе наиболее распространены кристаллические твердые вещества, для структуры которых характерен геометрически строгий порядок расположения частиц (атомов, ионов) в трехмерном пространстве. Кристаллическое состояние является стабильным при обычных условиях и характеризуется наиболее низкой внутренней энергией. Твердые кристаллические вещества имеют четкие геометрические формы, определенные температуры плавления, в большинстве случаев проявляют анизотропию, т.е. их физические свойства (показатель преломления, теплопроводность, скорости растворения и роста кристаллов и др.) неодинаковы при измерении в различных направлениях.
Стеклообразное состояние вещества представляет собой аморфную разновидность твердого состояния. Стеклообразное состояние является метастабильным, т. е. характеризуется избытком внутренней энергии. Пространственное расположение частиц вещества, находящегося в стеклообразном состоянии, является неупорядоченным, что подтверждается результатами рентгеноструктурных исследований.
Согласно законам химической термодинамики переход веществ из стеклообразного состояния в кристаллическое должен осуществляться самопроизвольно, однако высокая вязкость твердых веществ делает невозможным поступательное движение частиц, направленное на перестройку структуры. В твердых телах частицы совершают только колебательные движения относительно положения равновесия.
2. СТРОЕНИЕ СТЕКЛА
Физические свойства веществ зависят от их состава и строения. Строение стекол является одним из разделов единой проблемы строения вещества. В связи с этим необходимо подчеркнуть, что современные представления о строении стекла базируются на фундаментальных положениях теоретических разделов неорганической и физической химии, кристаллохимии, химии и физики твердого состояния, и, кроме того, включают идеи и обобщенные положения отдельных гипотез строения стекла, основу которых составляют эмпирические зависимости свойств от состава и строения.
Отсутствие прямых методов исследования аморфных веществ, отсутствие способов плоскостного изображения объемно неупорядоченных структур пока не позволяют создать завершенную теорию строения стекла.
Существует несколько теоретических направлений решения проблемы строения стекла, среди которых наиболее широкое распространение получили кристаллохимическое и валентно-химическое. Они рассматривают строение стекла на электронном, атомном или молекулярном уровнях, базируясь на основных положениях кристаллохимии, теорий химической связи, зонного строения твердых тел. Преимущественное развитие этих направлений обусловлено в первую очередь прогрессом в области изучения структуры веществ, находящихся в кристаллическом состоянии. Следует отметить, что основополагающие гипотезы строения стекла А. А. Лебедева (1921) и Захариасена (1931) появились вскоре после открытия прямого метода изучения структуры кристаллов—метода рентгеноструктурного анализа (Лауэ, 1912). Менее распространены представления о полимерном строении стекол, кинетический подход к процессам твердения расплавов в виде стекла, а также представления о строении стекол на основе концепций о строении жидкостей или расплавов.
Учитывая сложность и многоплановость вопроса строения стекла, ограничимся рассмотрением основных положений кристаллохимического и валентно-химического направлений, иллюстрируя их конкретными примерами строения силикатных стекол по мере усложнения их состава — от простейшего по составу однокомпонентного кварцевого стекла до двух-, трех- и многокомпонентных составов промышленных стекол.
Кристаллохимическое описание строения стекол
В основе данного описания лежат понятия ближнего и дальнего порядка в структуре веществ. Ближний порядок в общем случае, означает правильное расположение отдельных атомов относительно некоторого фиксированного атома. Для оксидных стекол ближний порядок характеризует расположение атомов кислорода относительно катионов. Например, атомы кремния всегда окружены четырьмя атомами кислорода. Координационные группировки [SiО2]4 сохраняются в расплавленном, кристаллическом или стеклообразном состояниях диоксида кремния. Это означает, что в структуре стекла сохраняется ближний порядок в расположении анионов относительно катионов кремния, характерный для координационной структуры кристаллов.
Дальним порядком называется строго периодическое и последовательное расположение атомов или группировок из атомов в пространстве, которое обусловливает образование единой трехмерной решетки.
Если для кристаллических структур характерно наличие ближнего и дальнего порядков, то особенность строения стекол состоит в том, что в их структуре имеется ближний порядок, но отсутствует дальний порядок в расположении координационных групп атомов. Отсутствие дальнего порядка в структуре характерно для жидкостей и аморфных тел.
Основными элементами структуры силикатных стекол являются тетраэдры [SiО4]4, которые, соединяясь, друг с другом вершинами, способны образовывать непрерывную в одном, двух, или трех измерениях пространственную структуру (структурную сетку по Захариасену).
Протяженность сетки определяется содержанием в составе стекла диоксида кремния. Апериодическую сетку, образующуюся путем сочленения координационных полиэдров вершинами, можно рассматривать как анион сложного состава. Компоненты стекла, способные самостоятельно образовывать структурную непрерывную сетку, такие, как SiO2, и другие, принадлежат к группе стеклообразователей. Компоненты стекла, не способные самостоятельно образовывать структурную непрерывную сетку, называются модификаторами. К группе модификаторов, как правило, принадлежат оксиды элементов первой и второй групп периодической системы, а также некоторых элементов других групп.
Катионы модификаторов располагаются в свободных полостях структурной сетки, компенсируя избыточный отрицательный заряд сложного аниона. Кислородное окружение катионов модификаторов формируется в соответствии с их координационными требованиями. Прочность связи модификатор — кислород значительно ниже прочности связи стеклообразователь — кислород, поэтому модификаторы не образуют прочных координационных групп.
Координационное число катиона модификатора в стекле представляет собой некоторое среднестатистическое число атомов кислорода, приходящееся на один атом модификатора. В отличие от геометрически правильных группировок координационных полиэдров стеклообразователей координационные группировки модификаторов могут не иметь геометрически правильной фигуры.
В структуре стекла различают два возможных состояния атомов кислорода: атомы, соединяющие соседние полиэдры, называют мостиковыми, а соединяющие катионы модификаторов со сложным анионом, называют немостиковыми.
Кварцевое стекло
Структурной основной единицей кварцевого стекла является кремнекислородный тетраэдр. Атом кремния окружен четырьмя атомами кислорода, расположенными симметрично в вершинах тетраэдра.
Структура кварцевого стекла выполнена из тетраэдров SiО4, соединенных друг с другом вершинами через атомы кислорода. В результате образуется непрерывный пространственный каркас, отличающийся от геометрически правильных решеток кристаллических модификаций кварца отсутствием дальнего порядка в расположении и ориентации тетраэдров. Тетраэдры SiО4 не образуют в пространстве геометрически правильных сочленений в виде шести членных колец, характерных для структуры высокотемпературного кристобалита.
Структурная сетка стекла выглядит как искаженная кристаллическая решетка. Искажение заключается в произвольном варьировании значений угла связи Si—О—Si между соседними тетраэдрами в структуре стекла.
Группировка [SiО4]4- имеет избыточный отрицательный заряд (-4), но каркасная сетка из тетраэдров SiО4 в целом электронейтральна, так как каждый атом кислорода связан с двумя атомами кремния. В структуре кварцевого стекла все атомы кислорода мостиковые.
Структуры кристаллических и стеклообразной форм диоксида кремния не являются плотноупакованными, так как тетраэдры соединяются вершинами, а не ребрами и не гранями. В кварцевом стекле имеются свободные структурные полости, ограниченные в пространстве мостиковыми атомами кислорода.
Именно благодаря наличию в структуре свободных полостей, кварцевое стекло обладает наиболее высокой газопроницаемостью (гелий, водород, неон) по сравнению с другими силикатными стеклами, в составе которых кроме диоксида кремния присутствуют оксиды щелочных и щелочноземельных металлов.










