Цифры таблицы получены при температуре 25 С. С изменением температуры они мало изменяются, поэтому ими можно пользоваться для определения направления реакции в обычных условиях. Цифры таблицы действительны для случаев, когда концентрация (или, точнее активность) растворов в гальванической цепи равна единице (т. е. 1 моль/л).
Необходимо иметь в виду следующее:
1. Увеличение концентрации ионов, в которые переходит окисляющийся атом или ион, понижает э. д. с. реакции, а уменьшение – повышает.
2. Увеличение концентрации окисляющихся атомов или ионов повышает э. д. с. реакции, а уменьшение понижает.
3. Правила пользования таблицами для определения направления окисления – восстановления.
В таблицах реакций представлены величины нормальных потенциалов окисления (Еокисл) и восстановления (Евосст) важнейших процессов. Таблицы соответственно разделены на две группы: “ Окисление “ и “ Восстановление “.
Знак “ + “ у Еокисл (или Евосст) и у соответствующего lgKокисл (или lgKвосст) показывает, что процесс идёт преимущественно слева направо, а знак “ – “ у этих же величин – справа налево.
Для определения направления той или иной реакции окисления-восстановления берут данные разделов “ Окисление “ и “ Восстановление “, распологая в одну строку уравнение рассматриваемого процесса окисления с уравнением заданного процесса восстановления. При этом получают несбалансированное общее ионное уравнение возможной окислительно-восстановительной реакции.
Алгебраическая сумма Еокисл + Евосст рассматриваемых процессов может быть величиной положительной, и тогда данная реакция (при условии аокисл = авосст = 1 и определённом значении рН) идёт, а если эта величина окажется отрицательной, то реаакция (при тех же условиях) невозможна.
Пример. Пойдёт ли реакция между I - ионами и Fe ионами с образованием свободного йода?
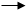
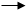 Решение. На таблице “Окисление “ (в группе реакций “Йод“) находят уравнение 2I – 2e I2, по таблице “Восстановление “ (в группе реакций “Железо”) находят уравнение Fe + e Fe и записывают их в одну строчку, складывая величины Еокисл + Евосст;
Решение. На таблице “Окисление “ (в группе реакций “Йод“) находят уравнение 2I – 2e I2, по таблице “Восстановление “ (в группе реакций “Железо”) находят уравнение Fe + e Fe и записывают их в одну строчку, складывая величины Еокисл + Евосст;

 :lgKокисл :Еокисл :Евосст :lgKвосст:
:lgKокисл :Еокисл :Евосст :lgKвосст:
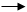 2I - 2e = I2 -18,07 -0,5345 +0,771 +13,04 Fe +e Fe
2I - 2e = I2 -18,07 -0,5345 +0,771 +13,04 Fe +e Fe
Алгебраическая сумма (- 0,5345) + (+0,771) = + 0,2365 –величина положительная: следовательно, реакция 2 I + 2 Fe ----- I2 + 2Fe будет протекать при определённых условиях.
С помощью указанных в этих же монограммах логарифмов констант равновесия можно также вычислить константы равновесия разнообразных реакций окисления-восстановления.
Анализируя таблицу определения направления реакции окисления-восстановления, можно сделать следующие выводы:
1. Ионы “ благородных “ металлов – сильные окислители.
Например: Cr + Ag----- Cr + Ag э. д. с. = + 0,7995- - 0,4 = 1,209 в.
Fe + Au---- Fe + Au э. д. с. = + 1,68- + 0,77 = 0,91 в.
2. Наиболее сильные восстановители – атомы щелочных и щелочно –земельных металлов. Наиболее слабые восстановители – “благородные” металлы и ионы галогенов (за исключением иона йода).
3. Наиболее сильные окислители – нейтральные атомы галогенов, высокоположительные ионы металлов, а также ионы “благородных” металлов. Наиболее слабые окислители – ионы щелочных и щелочноземельных металлов.




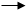

 :lgKокисл :Еокисл :Евосст :lgKвосст:
:lgKокисл :Еокисл :Евосст :lgKвосст: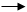 2I - 2e = I2 -18,07 -0,5345 +0,771 +13,04 Fe +e Fe
2I - 2e = I2 -18,07 -0,5345 +0,771 +13,04 Fe +e Fe



