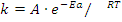Скорость химических реакций сильно зависит от температуры. Согласно эмпирическому правилу Вант-Гоффа (1884) при повышении температуры на 10 градусов скорость большинства реакций возрастает в 2—4 раза. Число, показывающее, во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов, называется температурным коэффициентом (γ) скорости данной реакции.
V2=V1∙γ 
где γ- tтемпературный коэффициент, принимающий значения от 2 до 4.
Однако, расчеты, выполненные в соответствии с молекулярно-кинетической теорией газов и жидкостей показывают, что число столкновений реагирующих молекул очень велико и нагрев на 100С увеличивает его незначительно. Если бы каждое соударение завершалось химическим взаимодействием, то практически все реакции заканчивались бы мгновенно, подобно взрыву. Однако этого не происходит. Значит не любое столкновение молекул реагирующих веществ приводит к образованию продуктов реакции.
Шведский химик Сванте Аррениус в 1889 высказал мысль, что в реакцию вступают лишь те столкнувшиеся молекулы, у которых кинетическая энергия превышает некоторую минимальную величину, характерную для данной реакции, называемую энергией активации. Такие молекулы получили называние активных.
Та дополнительная энергия, которую надо придать молекулам реагирующих веществ для того, чтобы сделать их активными, называется энергией активации Еа. Она определяется природой реагирующих веществ и служит важной кинетической характеристикой любой химической реакции.
Уравнение Аррениуса связывает константу скорости реакции с ее энергией активации:
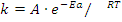
где: k - константа скорости реакции;
A —предэкспоненциальный множитель (множитель Аррениуса), постоянный для данной реакции;
e— основание натурального логарифма;
Ea- энергия активации, Дж/моль;
Т – температура, K;
R – универсальная газовая постоянная, 8,314 Дж/моль K.
Из приведенного уравнения очевидно, что чем выше энергия активации, тем меньше будет константа скорости реакции. Поэтому реакции с очень малыми значениями Еа (меньше 40 кДж/моль), протекают практически мгновенно. Если Еа очень велика (превышает 120 кДж/моль), например, в случае окисления молекулярного азота или диоксида серы кислородом, то ход реакции при обычных температурах заметить невозможно.
Влияние концентрации реагирующих веществ на скорость химической реакции. Закон действующих масс.
Чтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись.
В середине XIX в. (1865 г. - Н.Н.Бекетов, 1867 г. - К.Гульдберг, П.Вааге) был сформулирован основной постулат химической кинетики, называемый также законом действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени:
v = k[A]n[B]m, для реакции aA + bB =...
Числа n, m в выражении закона действующих масс называются порядками реакции по соответствующим веществам. Это экспериментально определяемые величины. Сумма показателей степеней n, m называется общим порядком реакции.
Обратите внимание, что степени при концентрациях А и В в общем случае не равны стехиометрическим коэффициентам в реакции! Они становятся численно равными только в том случае, если реакция протекает именно так, как записывается (такие реакции называются простыми или элементарными и достаточно редки). В большинстве случаев уравнение реакции отражает лишь суммарный результат химического процесса, а не его механизм.
Коэффициент пропорциональности k называется константой скорости реакции. Значение константы скорости реакции постоянно для данной реакции при данной температуре.
*В закон действующих масс не входят концентрации твердых веществ, т.к. реакции с твердыми веществами протекают на их поверхности, где "концентрация" вещества постоянна.
Cтв+O2=CO2,
v=k[C]m[O2]n=k'[O2]n; k'=k[C]m
Из уравнения нетрудно установить физический смысл константы скорости: она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/дм3 или когда их произведение равно единице. Константа скорости реакции зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
Уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ.