Современная формулировка Периодического закона звучит так:
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
Период – это последовательность элементов, расположенных в порядке возрастания заряда ядра атома, начинающаяся щелочным металлом и заканчивающаяся инертным газом.
В периоде, с увеличением заряда ядра, растет электроотрицательность элемента, ослабевают металлические (восстановительные) свойства и растут неметаллические (окислительные) свойства простых веществ. Группы – это вертикальные столбцы элементов, имеющих, как правило, валентность в высшем оксиде равную номеру группы. Группу делят на две подгруппы:
Главные подгруппы содержат элементы малых и больших периодов, образуют семейства со сходными свойствами (щелочные металлы – I А, галогены – VII A, инертные газы – VIII A).(химические знаки элементов главных подгрупп в периодической системе располагаются под буквой «А» или, в очень старых таблицах, где нет букв А и Б – под элементом второго периода)
Побочные подгруппы содержат элементы только больших периодов, их называют переходные металлы.(под буквой «Б» или «B»)
В главных подгруппах с увеличением заряда ядра (атомного номера) растут металлические (восстановительные) свойства.
Электроотрицательность атома – условная величина, характеризующая его способность в химических соединениях смещать к себе электроны от других атомов. С увеличен атомного номера в пределах каждого периода электроотрицательность возрастает, а в группе уменьшается, т.е. металлические свойства атомов элементов в периоде ослабевают, а в группе усиливаются.
Периодическое изменение св-в атомов хим-их элементов при увеличении положит-го заряда ядер объясняется тем, что периодически повторяется строение внешних электронных слоев атомов.
Основные законы химии: стехиометрические законы, закон сохранения массы в химических реакциях, закон постоянства состава, закон эквивалентов. Газовые химические законы. Закон объемных отношений. Закон Авогадро. Объединенный газовый закон. Закон парциальных давлений.
Закон сохранения массы веществ
(М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи.
Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава
Впервые сформулировал Ж.Пруст (1808 г).
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
Массовая доля элемента w(Э) показывает, какую часть составляет масса данного элемента от всей массы вещества: где n - число атомов; Ar(Э) - относительная атомная масса элемента; Mr - относительная молекулярная масса вещества.
Закон объемных отношений
(Гей-Люссак, 1808 г.)
"Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа".
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
Закон Авогадро ди Кваренья
(1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул.
Закон справедлив только для газообразных веществ.
Следствия.
1. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
2. При нормальных условиях (0°C = 273°К, 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
Объединенный газовый закон - объединение трех независимых частных газовых законов: Гей-Люссака, Шарля, Бойля-Мариотта, уравнение, которое можно записать так:
P1V1 / T1 = P2V2 / T2
И наоборот, из объединенного газового закона
при P = const (P1 = P2) можно получить
V1 / T1 = V2 / T2
(закон Гей-Люссака);
при Т= const (T1 = T2):
P1V1 = P2V2
(закон Бойля-Мариотта);
при V = const
P1 / T1 = P2 / T2
(закон Шарля).
Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клайперона-Менделеева:
pV= (m / M) RT
где m - масса газа; M - молекулярная масса; p - давление; V - объем; T - абсолютная температура (°К); R - универсальная газовая постоянная (8,314 Дж/(моль • К) или 0,082 л атм/(моль • К)).
Для данной массы конкретного газа отношение m / M постоянно, поэтому из уравнения Клайперона-Менделеева получается объединенный газовый закон.
Закон парциальных давлений
На практике часто приходится встречаться со смесью различных газов (например, воздух), В этом случае необходимо применять вышерассмотренные газовые законы для каждого газа в отдельности и затем суммировать полученные величины. При этом пользуются также законом парциальных давлений: общее давление газовой смеси равно сумме парциальных давлений отдельных газов, составляющих данную смесь, то есть
| Робщ = Р1 + Р2 +.. + Рп
| (1.5)
|
Из формулировки закона следует, что парциальное давление представляет собой частичное давление, создаваемое отдельным газом. И действительно, парциальное давление - это такое давление, которое бы создавал данный газ, если бы он один занимал весь объем.
Величина парциального давления определяется несколькими способами, но наиболее часто встречающийся практически способ основан на использовании формулы
Р 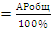
| |
где А - содержание данного газа в газовой смеси в объемных %.
Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях.
Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Рассмотрим реакцию взаимодействия гидроксида алюминия с серной кислотой:
2 Al(OH)3+ 3 H2SO4= Al2(SO4)3+ 6 H2O.
Из уравнения следует, что 2 моль Al(OH)3 взаимодействует с 3 моль H2SO4, при этом образуется 1 моль Al2(SO4)3 и 6 моль H2O. Таким образом, количество моль реагентов и продуктов (пропорциональное стехиометрическим коэффициентам в уравнении) обычно неодинаково.
Теперь рассмотрим число моль эквивалентов веществ, участвующих в данной реакции. 6 Моль эквивалентов Al(OH)3 взаимодействует с 6 моль эквивалентов H2SO4, при
этом образуется 6 моль эквивалентов Al2(SO4)3 и 6 Моль эквивалентов H2O. Таким образом, количество моль эквивалентов реагентов и продуктов всегда одинаково.