Компартментализация метаболизма является ключевым фактором взаимоотношений между глутаматом, глутамином и ГАМК, Впервые это явление было открыто в лаборатории Вэлша в конце 50-х - начале 60-х годов и известно под названием эффекта Вэлша. При определенных условиях в опытах с использованием меченых предшественников специфическая радиоактивность продукта, образованного в короткий промежуток времени, превышает специфическую активность предшественника иногда в несколько раз. Эти наблюдения позволяют сделать заключение, что метаболизм имеет место в малом, высокоактивном пуле, а меченый предшественник разбавляется при выделении большим количеством немеченого предшественника из другого, малоактивного пула.
Инъекция меченого глутамата, аммония, бикарбоната, ацетата, бутирата, цитрата и других, как правило, приводила к тому, что специфическая радиоактивность глутамина была выше предшественника, изолированного вскоре после инъекции. Этот эффект не был обнаружен после инъекции меченой глюкозы, пирувата, лактата, глицерина. Данные позволили заключить, что глюкогенные субстраты метаболируют до аминокислот в компартментах, отличных от тех, в которых обмениваются кетогенные субстраты.
Эффект Вэлша - специфическое свойство нервной системы и демонстрируется в опытах как in vitro, так и in vivo. В дальнейшем кинетическими исследованиями с различными метаболическими предшественниками было показано наличие в головном мозге различных метаболических компартментов цикла трикарбоновых кислот и аминокислот, связанных с этим циклом. Некоторые исследователи ограничивают число компартментов двумя - большим и малым, другие описывают до шести метаболических компартментов. Очевидным является факт, что каждый компартмент является суммой большого числа микрокомпартментов с более или менее сходными метаболическими свойствами.
"Большой" компартмент включает в себя относительно большие пулы промежуточных соединений, которые быстро обменивается с большим пулом глутамата и малым пулом глутамина. Глюкоза используется во всех компартментах, но в большой компартмент включается до 90% гликолитического потока и большая часть общего потока через ЦТК. Глюкогенные предшественники метаболируют преимущественно в этом ком-партменте, и глюкоза может рассматриваться как предпочтительный метаболит большого компартмента. Этот же компартмент содержит основную часть общего глутамата и аспартата. Однако скорость синтеза глутамина в нем относительно низка.
Полагают, что "большой" компартмент расположен главным образом в нейронах и участвует преимущественно в энергетических процессах. Предположение о нейрональной локализации "большого" метаболического компартмента подтверждается, например, исследованиями на животных с различным ти-реоидным статусом. Так, удаление щитовидной железы при рождении животного выливается в недоразвитие нейрональных систем. Одновременно наблюдается недоразвитие "большого" метаболического компартмента. Напротив, обработка тиреоид-ными гормонами ускоряет созревание мозга и развитие метаболической компартментации.
"Малый" метаболический компартмент включает в себя ЦТК, но с малыми пулами его компонентов, которые быстро обмениваются с малым пулом глутамата, находящимся, в свою очередь, в равновесии с большим пулом глутамина. "Малый" компартмент является главным источником глутамина. Окислительная способность "малого" компартмента низка; вероятно, он не богат структурами, вовлекаемыми в синтез белка, и митохондриями. Морфологическая характеристика астроглии соответствует биохимическим свойствам "малого" метаболического компартмента. Пул глутамата, связанный с синтезом глутамина, составляющий малую долю общего пула глутамата, находится в астропи-тах. Последние составляют лишь около четверти от общего объема ткани мозга, причем концентрация глутамата в них ниже, чем в ткани ЦНС в целом. Коммуникация между "малым" и "большими" компартментами осуществляется через транспорт глутамина и ГАМК, а также путем аксонального тока белков из нейронального перикариона к нервным окончаниям.
Значение метаболических компартментов состоит в пространственном отделении биосинтетических процессов от тех метаболических путей, которые строго контролируются энергетическими нуждами. Это явление характерно именно для нервной ткани, которая отличается большой функциональной гетерогенностью составляющих ее элементов, большой долей крупных и средних клеток с разнообразными системами органелл и, наконец, большой протяженностью отростков нервных клеток, что затрудняет возможность смешивания метаболитов.
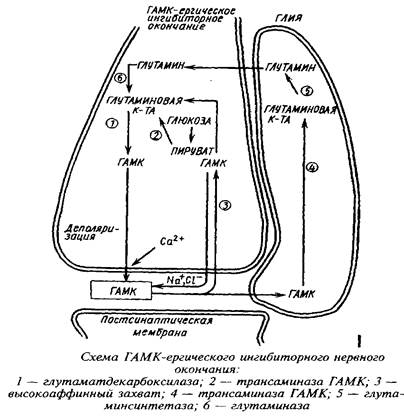
Метаболическая компартментализация аминокислот, в частности аминокислот глутаминовой группы, особенно ярко проявляется в субклеточной локализации ферментов в ГАМК-ергическом нейроне и в астроцитах. Так, пируваткар-боксилаза локализована преимущественно в астроцитах, в то время как пируватдегидрогеназный комплекс более активен в нейронах, чем в астроцитах. Преимущественная локализация пируватдегидрогеназы в нейронах ответственна в конечном счете за низкое включение углерода глюкозы, лактата и глицерина в глутамин. Глутамин-синтетаза преимущественно локализована в астроцитах, а глутаминаза - в нейронах. Глутамат, поглощаясь астроцитами, превращается в глутамин в глутамин-синтетазной реакции. Глутамин, выйдя из астроцитов и входя в нейроны, образует глутамат и далее ГАМК. Таким образом, глутамин и ГАМК осуществляют коммуникацию между большим и малым метаболическими компартментами.
Помимо нейронально-глиального транспорта аминокислот в последние годы установлена возможность перемещения свободных аминокислот от проксимального к дистальному концу нейрона. Так, глутамат, введенный в мозг, передвигается вдоль аксонов двигательных нейронов и оказывается в мышечных нервных окончаниях.
Глицин и пути его обмена
Глицин участвует не только в биосинтезе белков, но и в других многочисленных биосинтетических процессах, таких, как образование пуринов, порфиринов, креатина, этаноламина, холина, глутатиона и др. Глицин функционирует также в качестве ингибиторного трансмиттера главным образом в спинном мозге.
Так как потребление глицина в нервной ткани относительно велико, а поступление его из крови происходит медленно, значительная часть глицина синтезируется в мозге de novo. Глюкоза и серии являются главными источниками глицина в ЦНС. Серии может образовываться из глюкозы через 3-фосфоглице-риновую кислоту. Кроме того, серии сравнительно быстро поступает из циркулирующей крови. Синтез глицина de novo происходит в нервной ткани из серина путем обратимой N, W-метилентетрагидрофолат-тет-рагидрофолатзависимой трансформации при участии фермента серингидроксил1етилтрансферазы. Реакция катализируется серингидроксиметилтрансферазой и протекает следующим образом:


Этот фермент относится к пиридоксальзависимым при оптимальной активности в нем содержится 6 молекул пиридоксальфосфата. Активность фермента в метаболических пулах головного мозга относительно постоянна, высокая активность его обнаружена в спинном мозге и в мозжечке. Активность в сером веществе спинного мозга больше, чем в белом, причем в вентральном сером веществе она значительно выше, чем в дорзальном. Это коррелирует с содержанием глицина.
Другим источником синтеза глицина в нервной системе является глиоксиловая кислота, однако вклад ее в синтез глицина в головном мозге in vivo не может быть значительным, так как ее уровень в мозге низок.
В нервной ткани существует по крайней мере три пути катаболизма глицина. Первый состоит в том, что реакция превращения серина в глицин легко обратима в ткани мозга и серин-гидроксиметилтрансфераза может выступать в качестве энзима деградации глицина. Кроме того, в ЦНС представлены оксидазы аминокислот, которые могут использовать в качестве субстрата наряду с другими аминокислотами глицин:

Третья система распада глицина локализована исключительно в митохондриях и является нетипичной декарбоксилазой аминокислот, так как зависит и от НАД+, и от тетрагидрофолата. Расщепление глицина на одноуглеродные фрагменты протекает по схеме:

Важно отметить образование в этих реакциях метилентетра-гидрофолата, который может быть использован в мозге как источник одноуглеродных фрагментов. То же следует подчеркнуть применительно к описанной серингидроксиметилтрансферазной реакции.
При участии глицин-расщепляющей системы глицин распадается на метилентетрагидрофолат, диоксид углерода и аммиак, затем происходит окисление метилен-ТГФ с образованием СОз - окончательного продукта распада глицина.
Как уже упоминалось, глицин является ингибиторным трансмиттером в спинном мозге. В других районах депрессорное действие глицина проявляется слабо. Поэтому спинной мозг имеет высокоаффинную и низкоаффинную систему захвата глицина, в то время как кора головного мозга содержит только низкоаффинную систему.
Интересно отметить, что повышенный уровень глинина обнаружен в эпилептогенных районах мозга человека, удаленных хирургическим путем. Он накапливается также в эпилептогенных районах мозга у животных с вызванными кобальтом припадками, причем тяжесть припадков пропорциональна накоплению глицина. Возможно, это - компенсаторные процессы.
Высокий уровень глицина в плазме крови или в моче обычно свидетельствует о нарушении мозговых функций. Гиперглицинемия развивается в раннем возрасте и сопровождается эпизодическими рвотами, подавлением двигательной активности, нарушением ЭЭГ и часто кончается смертью. Известны два типа гиперглииинемии - кетотическая и некетотическая, которая в большинстве случаев тоже летальна. Кетотическая гиперглицинемия сопровождается губчатой дегенерацией белого вещества мозга и задержкой миелинизации.
Серосодержащие аминокислоты
Метионин представляет особый интерес как источник метильных групп. Полученный с пищей, а также образованный в других тканях, метионин поступает в мозг через систему активного транспорта больших нейтральных аминокислот. Концентрация метионина в целом мозге сравнительно низка - от 10 до 100 нмоль/г сырой массы у различных видов животных. Региональные различия в концентрации метионина невелики. Влияние диеты на концентрацию метионина в мозге также незначительно из-за конкурентных отношений с нейтральными аминокислотами за транспортные системы. Метионин в пуле свободных аминокислот утилизируется на 80% для синтеза белка.
Метаболизм свободного метионина до цистеина начинается с образования S-аденозилметионина, реакция катализируется метионин-аденозилтрансферазой. S-Аденозилметионин является главным донором метальных групп в мозге, необходимых для метилирования катехоламинов, гистамина, фосфатидилэтаноламина, нуклеиновых кислот.
Процессам метилирования отводится важная роль: в проведении сигнала через мембрану, в регулировании жидкостно-сти мембраны и, наконец, в процессах метилирования ДНК. Последние считают вероятными участниками механизмов долговременной памяти. В то время как первая половина цикла превращения метионина связана главным образом с метилированием, вторая часть его ассоциирована в основном с нейротрансмиттерной и нейромо-дуляторной функцией. Оказалось, что 20% серусодержащих аминокислот локализовано в синаптосомах.

Цистатиония - продукт конденсации гомоцистеина и серина. Фермент, участвующий в этом процессе, - цистатионин-синтаза. Цистатионин является промежуточным продуктом метаболизма таких серусодержащих аминокислот, как метионин, цистеин и таурин. Будучи промежуточным метаболитом в обмене серы, он важен для синтеза сульфатидов и сульфатированных мукополисахаридов. Содержание цистатионина выше в белом веществе, чем в сером.
У человека высокие концентрации цистатионина обнаружены в мозге и гораздо меньшие - в других тканях. Интересно отметить, что мозг человека содержит значительно более высокие концентрации цистатионина, чем мозг животных. Концентрация цистатионина в мозге человека повышается в процессе развития, а в мозге крысы, напротив, снижается. Биологическая роль цистатионина не выяснена. При некоторых психических заболеваниях, а также при действии нейротоксинов содержание цистатионина в мозге резко возрастает. В то же время у некоторых умственно отсталых больных с врожденными нарушениями обмена серусодержащих аминокислот содержание цистатионина в мозге было чрезвычайно низким.
Генетическая потеря цистатионинсинтазы ведет к болезни - гомоцистинурии, которая сопровождается экскрецией гомоцистеина с мочой, повышением содержания гомоцистеина и метионина в крови и дефицитом цистатионина и цистатионинсинтазы в мозге и печени. Гомоцистинурия является второй по распространенности аминоацидурией после фенилкетонурии с ярко выраженным действием на ЦНС. Одной из характеристик болезни является фиброз и утончение кровеносных сосудов. Терапевтическое средство - снижение в диете метионина и доноров метильных групп - таких, как холин. Для таких больных необходимо включение цистина в диету, так как они не могут образовывать его из метионина. Клиническая картина у детей выражается в эпизодических судорожных припадках, тяжелом физическом и умственном отставании.
Таурин образуется в мозге посредством окисления цистеина до цистеинсульфоновой кислоты, которая декарбоксилируется с образованием гипотаурина с последующим окислением его до таурина. Он обнаружен в высоких концентрациях в нервной системе беспозвоночных и позвоночных животных. Высокие концентрации таурина найдены в мозге эмбрионов, а также в ранний период постэмбрионального развития. Так, у мышей в первые дни жизни концентрация таурина выше, чем концентрация аминокислот глутаминовой группы, в 3 раза, а у взрослых это отношение уменьшается.
Региональное распределение таурина неравномерно. Он содержится в нейронах и в глии, причем большая часть его обнаружена в растворимой фракции. В мозге крыс синаптосомальные фракции полосатого тела, коры мозга и мозжечка содержат наиболее высокое количество таурина. Интересно, что таурин - наиболее распространенная аминокислота сетчатки некоторых видов животных.
Подобно другим короткоцепочечным омега-аминокислотам таурин подавляет нейрональную возбудимость, вызывая гиперполяризацию. Таурин - предполагаемый трансмиттер в коре и стволе мозга. По последним сведениям, он может быть нейротрансмиттером в некоторых районах гиппокампа. Инактивация таурина в мозговых синапсах осуществляется с помощью высокоаффинного обратного захвата. Описан также захват таурина глиальными клетками, что указывает на роль глии в модуляции его синаптической функции.
Таурин связан с регуляцией транспорта кальция в нервной ткани. Многие авторы склонны объяснять высокую концентрацию таурина в мозге именно участием его в контроле уровня Са+. Модуляция таурином внутриклеточной концентрации Са+, в свою очередь, регулирует нейрональную возбудимость. Таурин подавляет захват и освобождение Са+ синаптосомами мозга. Более того, он подавляет связывание Са+ микросомами мозга в условиях, стимулирующих деполяризацию. Хотя молекулярный механизм взаимодействия таурина с кальций-регулирующими системами еще не ясен, приведенные данные свидетельствуют о том, что роль таурина в организме не ограничивается только нейромедиаторной функцией.
Интересен факт обнаружения нейропептидов, содержащих таурин, которые оказывают гормоноподобные эффекты.
Таурин является слабым $-адренергическим агонистом, он активирует К+-стимулированное освобождение норадреналина из коры мозга, не влияя на спонтанное освобождение. Интравентрикулярное введение таурина повышает синтез дофамина и норадреналина во всех изученных районах мозга. Влияние его на двигательную активность и регуляцию температуры животного подтверждает медиацию этих эффектов через катехоламинерги-ческую систему. Таурин оказывает антиконвульсивное действие при эпилепсии, блокирует агрессивные реакции у крыс-киллеров. Однако следует иметь в виду, что содержание таурина в мозге трудно корректировать - он плохо проникает через ГЭБ.
Клинически тауриновый дефицит может выражаться в эпилептических припадках, наследственной атаксии Фридрейха, куриной слепоте и др.












