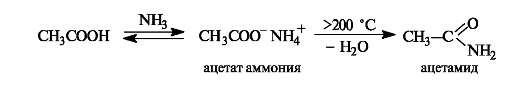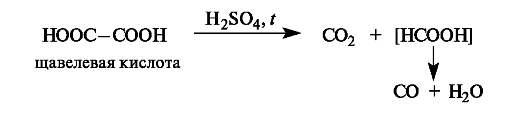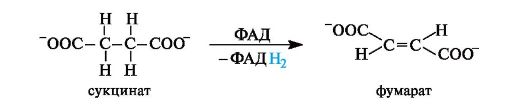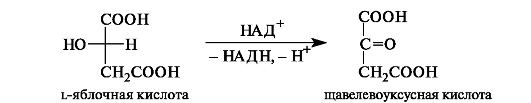Конденсацией называют реакцию, приводящую к возникновению новой углерод-углеродной связи, причем из двух или нескольких относительно простых молекул образуется новая, более сложная молекула.
Продукт реакции, содержащий гидроксильную и альдегидную группы, называется альдолем (от слов альдегид и алкоголь), а сама реакция получила название альдольной конденсации, или альдольного присоединения.
Механизм альдольной конденсации

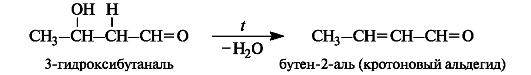
Продукт конденсации - альдоль - способен к отщеплению воды с образованием α,β-ненасыщенного карбонильного соединения. Обычно это происходит при повышенной температуре. В этом случае реакция в целом называется кротоновой конденсацией.
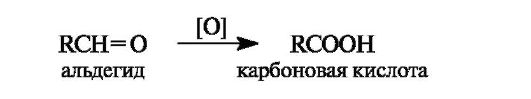
Окисление альдегидов в карбоновые кислоты осуществляется под действием большинства окислителей, включая кислород воздуха. Кетоны в мягких условиях не окисляются.
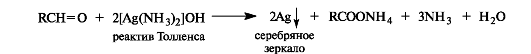
Оксид серебра в виде аммиачного комплекса [Ag(NH3]2OH (реактив Толленса) окисляет альдегиды в карбоновые кислоты, при этом выделяется металлическое серебро. Отсюда происходит название - реакция «серебряного зеркала».
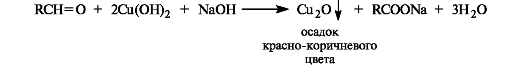
Так же легко альдегиды окисляются гидроксидом меди(II) в щелочной среде.


12. Карбоновые кислоты: строение, классификация. Тип гибридизации атомных орбиталей карбоксильного атома углерода. Электронное строение карбоновых кислот: р,п-сопряжение, +М-эффект ОН-группы, +I-эффект бокового радикала.

Карбоновые кислоты благодаря карбоксильной группе полярны и могут участвовать в образовании межмолекулярных водородных связей (см. 2.2.3). Такими связями с молекулами воды объясняется неограниченная растворимость низших кислот (C1-C4). В молекулах карбоновых кислот можно выделить гидрофильную часть (карбоксильную группу СООН) и гидрофобную часть (органический радикал R). По мере возрастания доли гидрофобной части снижается растворимость в воде.
В зависимости от природы органического радикала карбоновые кислоты могут быть алифатическими (насыщенными или ненасыщенными) RCOOH и ароматическими ArCOOH. По числу карбоксильных групп они подразделяются на монокарбоновые, дикарбоновые и трикарбоновые.


Карбон карбоксильной группы находится в состоянии sp2-гибридизации, угол O-C-O в различных кислотах составляет 118-122,5°
П-электроны взаимодействуют с р-электронами кислорода гидро-ксигруппы, а это приводит к сопряжению. Поляризация связи С=0 резко возрастает за счет дополнительного стягивания неподеленной пары электронов (р-электронов) атома кислорода ОН-группы. Вследствие такого смещения электронной плотности связь О—Н в гид-роксигруппе ослабляется, и атом водорода легко отщепляется в виде иона Н-. Поэтому именно гидроксигруппа участвует почти во всех реакциях: она или замещается, или диссоциирует по кислотному типу.
В карбоксилат-ионе происходит перераспределение электронной плотности между двумя атомами кислорода и углеродом. В результате двойная связь практически отсутствует в растворах кислот:

Так как влияние атомов взаимно, карбоксильная группа оказывает влияние на радикал. В результате этого атомы водорода соседнего с функциональной группой отличаются большей подвижностью от других атомов водорода р 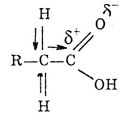 адикала и могут замещат
адикала и могут замещат
Реакционные центры в молекулах карбоновых кислот:ОН-кислотный, СН-кислотный, электрофильный. Изменение кислотных свойств в гомологическом ряду карбоновых кислот и при введении в боковой радикал электроноакцепторного заместителя..
Особенности электронного строения карбоновых кислот обусловливают существование нескольких реакционных центров:
ОН-кислотный центр, обусловленный сильной поляризацией связи О-Н;
• электрофильный центр - атом углерода карбоксильной группы;
• n- основный центр - атом кислорода карбонильной группы с неподеленной парой электронов;
• слабый СН-кислотный центр, проявляющийся только в производных кислот, так как в самих кислотах имеется несравненно более сильный ОН-кислотный центр.

Кислотные свойства карбоновых кислот проявляются в их способности отщеплять протон. Повышенная подвижность водорода обусловлена полярностью связи О-Н за счет р,п-сопряжения.
Длина и разветвленность насыщенного алкильного радикала не оказывает существенного влияния на кислотные свойства карбоновых кислот. В целом алифатические монокарбоновые кислоты обладают практически одинаковой кислотностью (pKa 4,8-5,0), за исключением муравьиной кислоты, у которой кислотность на порядок выше. На кислотность карбоновых кислот значительно влияют заместители, введенные в углеводородный радикал. Независимо от механизма передачи электронного влияния заместителя в радикале (индуктивного или мезомерного), электроноакцепторные заместители способствуют делокализации отрицательного заряда, стабилизируют анионы и тем самым увеличивают кислотность. Электронодонорные заместители, напротив, ее понижают.
14.Образование сложных эфиров, тиоэфиров, амидов, ангидридов, галогенгидридов карбоновых кислот. Ацетилкофермент А invivo как переносчик ацильных групп на нуклеофильные субстраты.

Образование амидов. При действии на карбоновые кислоты аммиака (газообразного или в растворе) непосредственно замещения группы ОН не происходит, а образуется аммониевая соль. Лишь при значительном нагревании сухие аммониевые соли теряют воду и превращаются в амиды
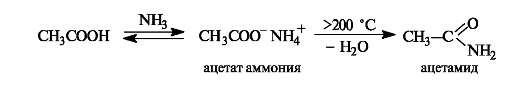
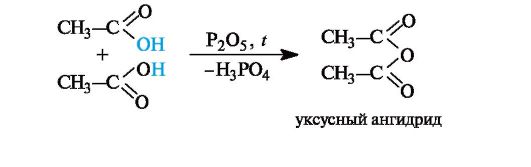
Образование ангидридов кислот. Нагревание карбоновых кислот с оксидом фосфора(V) приводит к образованию ангидридов кислот
Образование тиоэфиров. конденсация карбоновых кислот в присутствии водоотнимающих реагентов[2] (например, N,N'-дициклогексилкарбодиимида[3] (DCC, ДЦК):
RSH + R’CO2H →RSC(O)R' + H2O
При всей сложности строения молекулы ацетилкофермента А с позиций химического подхода можно определить, что этот кофермент функционирует как тиоэфир. 
В качестве тиола, участвующего в его образовании, выступает кофермент А (сокращенно обозначаемый CoASH), молекула которого построена из остатков трех компонентов - 2-аминоэтантиола, пантотеновой кислоты и аденозиндифосфата (дополнительно фосфорилированного по положению 3 в рибозном фрагменте). Аденозиндифосфат (АДФ) рассмотрен в дальнейшем как представитель другой важной группы коферментов - нуклеозидполифосфатов (см. 14.3.1). Пантотеновая кислота образует, с одной стороны, амидную связь с 2-аминоэтанти-олом, а с другой - сложноэфирную связь с остатком АДФ.
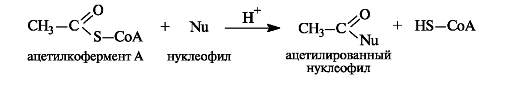
Ацетилкофермент Аinvivo является переносчиком ацетильных групп на нуклеофильные субстраты.
Двухосновные карбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Оксалаты. Декарбоксилированиещавелевой и малоновой кислот. Превращение янтарной кислоты в фумаровую. Биологическое значение.



| Название кислоты
| Формула
| Название аниона или основы сложного эфира
|
| Щавелевая (этандиовая) Малоновая (пропандиовая) Янтарная (бутандиовая) Глутаровая (пентандиовая)
| НООС-СООН НООССН2СООН НООС(СН2)2СООН НООС(СН2)3СООН
| Оксалат МалонатСукцинатГлутарат
|
Щавелевая кислота - простейшая двухосновная кислота. Некоторые ее соли, например оксалат кальция, трудно растворимы и часто образуют камни в почках и мочевом пузыре (оксалатные камни).
Янтарная кислота в заметном количестве была обнаружена в янтаре, откуда получила название сама кислота и ее производные сукцинаты (от лат. succinium - янтарь).
Малеиновая и фумаровая кислоты - представители ненасыщенных дикарбоновых кислот с одной двойной связью. Фумаровая кислота участвует в обменных процессах, протекающих в организме.

Кислотные свойства. С накоплением кислотных групп увеличиваются кислотные свойства соединений. Кислотность дикарбоновых кислот больше, чем монокарбоновых. Так, щавелевая кислота (pKa 1,23) значительно сильнее уксусной (pKa 4,76), что связано с -/- эффектом группы СООН, и благодаря этому более полной делокализации отрицательного заряда в сопряженном основании.
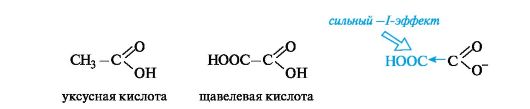
Влияние заместителя наиболее отчетливо проявляется при его близком расположении к кислотному центру.
Декарбоксилирование. При нагревании с серной кислотой щавелевая кислота декарбоксилируется, а образовавшаяся муравьиная кислота разлагается далее.
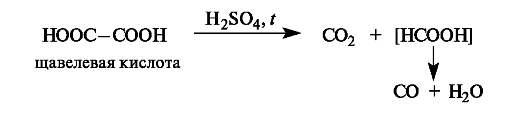
Малоновая кислота легко декарбоксилируется при нагревании выше 100?С
Малеиновая и фумаровая кислоты проявляют сходные химические свойства: вступают в реакции, свойственные соединениям с двойной связью (обесцвечивание бромной воды, водного раствора перманганата калия) и соединениям с карбоксильными группами (образуют два ряда производных - кислые и средние соли, эфиры и т. п.). Однако только одна из кислот, а именно малеиновая, в относительно мягких условиях претерпевает внутримолекулярную циклизацию с образованием циклического ангидрида. В фумаровой кислоте вследствие удаленности карбоксильных групп друг от друга в пространстве образование циклического ангидрида невозможно.
Окисление янтарной кислоты invivo. Дегидрирование (окисление) янтарной кислоты в фумаровую, катализируемое в организме ферментом, осуществляется с участием кофермента ФАД. Реакция протекает стереоспецифично с образованием фумаровой кислоты (в ионной форме - фумарат).
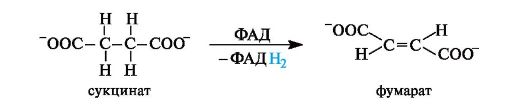
Сукцинатдегидрогеназа(КФ 1.3.99.2) катализирует превращение янтарной кислоты в фумаровую. Кофактором фермента является ФАД. Фермент прочно связан с внутренней мембраной митохондрий.
Малоновая кислота в малых концентрациях (0 01 М) является высокоспецифичным ингибитором одной из стадий постулированной схемы реакций, а именно стадии превращения янтарной кислоты в фумаровую. Введение малоновой кислоты в дышащую дыхательную систему приводит к уничтожению отмеченного каталитического эффекта и накоплению янтарной кислоты
16.Гетерофункциональные органические соединения (кетокислоты, гидроксикислоты, аминокислоты, аминофенолы, аминоспирты. Привести примеры.
Гетерофункциональными называют соединения, в молекулах которых имеются различные функциональные группы.
Аминоспиртами называют соединения, содержащие в молекуле одновременно амино- и гидроксигруппы.
Эти две функциональные группы непрочно удерживаются у одного атома углерода, в результате чего происходит отщепление аммиака или воды. Простейшим представителем аминоспиртов является 2-аминоэтанол - соединение, в котором обе группы расположены у соседних атомов углерода. 2-Аминоэтанол (тривиальное название коламин) является структурным компонентом сложных липидов - фосфатидилэтаноламинов (см. 10.4.1).
С сильными кислотами 2-аминоэтанол образует устойчивые соли.

Важная роль в организме принадлежит аминоспиртам, содержащим в качестве структурного фрагмента остаток пирокатехина. Они носят общее название катехоламинов. К этой группе относятся представители образующихся в организме биогенных аминов. К катехоламинам принадлежат дофамин, норадреналин и адреналин, выполняющие, как и ацетилхолин, роль нейромедиаторов. Адреналин участвует в регуляции сердечной деятельности, при физиологических стрессах он выделяется в кровь («гормон страха»).
Гидроксикислотами называют соединения, содержащие в молекуле одновременно гидроксильную и карбоксильную группы. Аминокислоты содержат в молекуле аминогруппу и карбоксильную группу.
В алифатическом ряду по взаимному расположению функциональных групп различают α-, β-, γ- и т. д. гидрокси- и аминокислоты. Буквой греческого алфавита указывают положение другой функциональной группы относительно карбоксильной, при этом отсчет ведется от ближайшего к карбоксильной группе атома углерода, т. е. от атома С-2. Отметим, что в заместительной номенклатуре для замещенных карбоновых кислот локанты α-, β-, γ- и т. д. не употребляются.
Кислотно-основные свойства. В гетерофункциональных соединениях в зависимости от природы функциональных групп и их местоположения в молекуле возможно усиление или, наоборот, ослабление некоторых свойств, характерных для монофункциональных соединений. Например, кислотность гидроксикислот выше, чем незамещенных кислот. Аминокислоты, содержащие одновременно кислотные и основные фунциональные группы, проявляют амфотерные свойства, т. е. способность взаимодействовать как с кислотами, так и с основаниями. В нейтральных водных растворах или кристаллическом состоянии аминокислоты существуют преимущественно в форме внутренних солей (диполярных ионов), как показано на примере γ-аминомасляной кислоты.

α-Гидрокси- и α-аминокислоты. У α-гидроксикислот и α-аминокислот функциональные группы близки, но внутримолекулярного взаимодействия между ними не происходит из-за неустойчивости трехчленных циклов, которые могли бы при этом образоваться. При нагревании α-гидрокси- и α-аминокислоты претерпевают межмоле- кулярную циклизацию с образованием продуктов, называемых соответственно лактидами и дикетопиперазинами (последнее - от названия шестичленного гетероцикла с двумя атомами азота - пиразина).
Лактиды содержат две сложноэфирные группы, дикетопиперазины - две амидные группы.
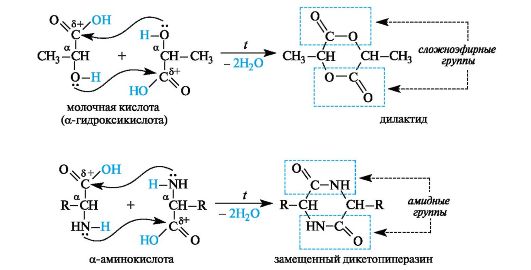
Лактиды и дикетопиперазины, являясь сложными эфирами или амидами соответственно, в условиях кислотного или основного ката-лиза способны гидролизоваться с образованием исходных α-гидрокси- или α-аминокислот.
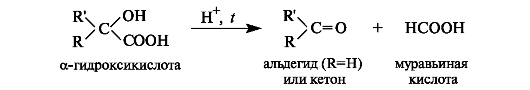
Особое свойство α-гидроксикислот заключается в их способности разлагаться при нагревании в присутствии минеральных кислот с образованием карбонильных соединений и муравьиной кислоты.
Молочная кислота известна как продукт молочнокислого брожения лактозы, содержащейся в молоке, и других углеводов, входящих в состав овощей и плодов.
В организме L-(+)-молочная кислота является одним из продуктов превращения глюкозы (гликолиза). Она накапливается в мыш-цах при интенсивной работе, вследствие чего в них возникает характерная боль. Причина накопления молочной кислоты - недостаток
кислорода, что вызывает восстановление пировиноградной кислоты с участием НАДН в молочную.
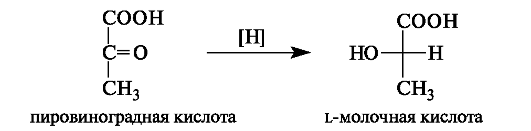
Во время отдыха запасы кислорода возобновляются, и молочная кислота окисляется снова в пировиноградную кислоту.

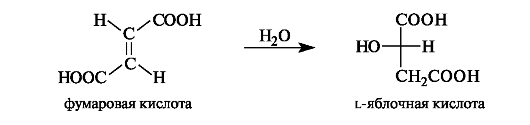
Яблочная кислота в значительных количествах содержится в незрелых яблоках, рябине, фруктовых соках. В организме l-яблочная кислота образуется путем гидратации фумаровой кислоты.
Лимонная кислота содержится в плодах цитрусовых (лимоны, апельсины), винограде, крыжовнике, а также в листьях табака.
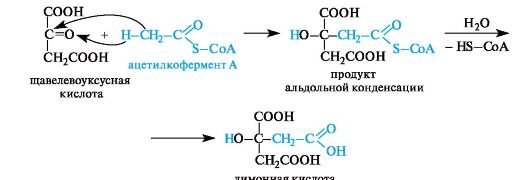
Биосинтез лимонной кислоты происходит по типу альдольной конденсации из щавелевоуксусной кислоты и ацетилкофермента А
Оксокислотами называют соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную) группы.
В соответствии с этим различают альдегидокислоты и кетонокислоты.
Важную роль в биохимических процессах играют кетонокислоты - пировиноградная, ацетоуксусная и щавелевоуксусная
Пировиноградная кислота является одним из промежуточных продуктов молочнокислого и спиртового брожения углеводов. Своим названием пировиноградная кислота обязана тому, что впервые была выделена при пиролизе виноградной кислоты.
Пировиноградная кислота декарбоксилируется при нагревании с разбавленной и декарбонилируется (отщепляет СО) - с концент-рированной серной кислотой

Щавелевоуксусная кислота одновременно является α- и β-оксокислотой. Она образуется при окислении яблочной кислоты.
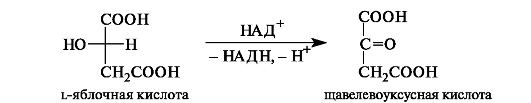
Бензойная кислота. Применяется в виде натриевой соли как отхаркивающее средство. В свободном виде бензойная кислота встречается в некоторых смолах и бальзамах, а также в клюкве, бруснике, но чаще
содержится в связанном виде, например в виде N-бензоильногопроизводного аминоуксусной кислоты, называемого гиппуровой кислотой. Эта кислота образуется в печени из бензойной и аминоуксусной (глицин) кислот и выводится с мочой. В клинической практике по количеству гиппуровой кислоты в моче больных (после приема бензоата натрия) судят об эффективности обезвреживающей функции печени.

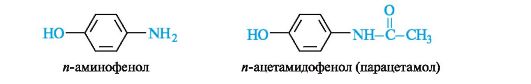
и-Аминофенол и его производные. Как гетерофункциональное соединение п-аминофенол может образовывать производные по каждой функциональной группе в отдельности и одновременно по двум функциональным группам. Сам п-аминофенол ядовит; интерес для медицины представляет его производное - парацетамол, оказывающий анальгетическое (обезболивающее) и жаропонижающее действие.
Салициловая кислота и ее производные. Салициловая кислота (см. 8.1) относится к группе фенолокислот. Как соединение с орто- расположением функциональных групп она декарбоксилируется при нагревании с образованием фенола.
Салициловая кислота умеренно растворима в воде, дает интенсивное окрашивание с хлоридом железа(Ш), на чем основано качественное обнаружение фенольной гидроксильной группы. Салициловая кислота проявляет антиревматическое, жаропонижающее и антигрибковое действие, но как сильная кислота (рKа 3,0) вызывает раздражение желудочно-кишечного тракта и поэтому применяется только наружно. Внутрь применяют ее производные - соли или эфиры.
Салициловая кислота способна образовывать производные по каждой функциональной группе. Практическое значение имеют салицилат натрия, сложные эфиры по карбоксильной группе - метилсалицилат, фенилсалицилат (салол), а также по гидроксильной группе - ацетилсалициловая кислота (аспирин
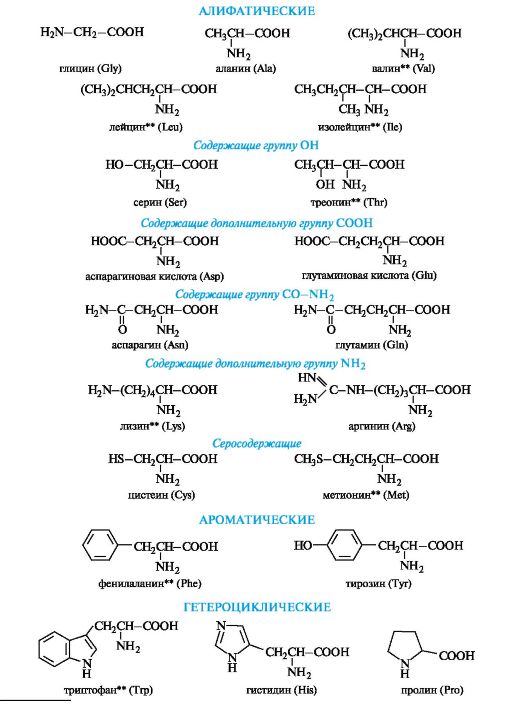
17. α-Аминокислоты. Строение, классификация α-Аминокислот по природе радикала: алифатические, ароматические, гетероциклические. Заменимые и незаменимые α-Аминокислоты. Привести примеры.
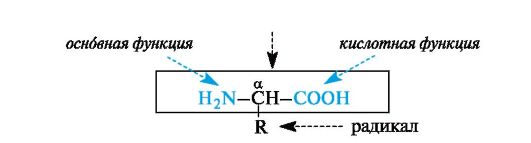
α-Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
Многие α-аминокислоты синтезируются в организме. Некоторые аминокислоты, необходимые для синтеза белков, в организме не образуются и должны поступать извне. Такие аминокислоты называют незаменимыми
К незаменимым α-аминокислотам относятся:
валин изолейцин метионин триптофан
лейцин лизин треонинфенилаланин
Алифатические α-аминокислоты. Это наиболее многочисленная группа. Внутри нее аминокислоты подразделяют с привлечением дополнительных классификационных признаков.
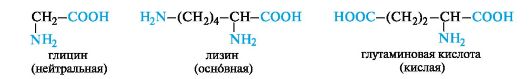
В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют:
• нейтральные аминокислоты - по одной группе NH2 и СООН;
• основные аминокислоты - две группы NH2 и одна группа
СООН;
• кислые аминокислоты - одна группа NH2 и две группы СООН.
Можно отметить, что в группе алифатических нейтральных аминокислот число атомов углерода в цепи не бывает больше шести. При этом не существует аминокислоты с четырьмя атомами углерода в цепи, а аминокисоты с пятью и шестью атомами углерода имеют только разветвленное строение (валин, лейцин, изолейцин).
В алифатическом радикале могут содержаться «дополнительные» функциональные группы:
• гидроксильная - серин, треонин;
• карбоксильная - аспарагиновая и глутаминовая кислоты;
• тиольная - цистеин;
• амидная - аспарагин, глутамин.
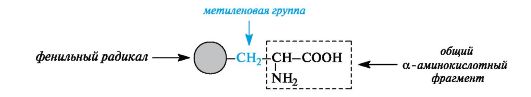
Ароматические α-аминокислоты. К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -СН2-.
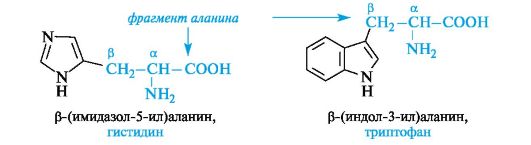
Гетероциклические α-аминокислоты. Относящиеся к этой группе гистидин и триптофан содержат гетероциклы - имидазол и индол соответственно. Строение и свойства этих гетероциклов рассмотрены ниже (см. 13.3.1; 13.3.2). Общий принцип построения гетероциклических аминокислот такой же, как и ароматических.
Гетероциклические и ароматические α-аминокислоты можно рассматривать как β-замещенные производные аланина.
К героциклическим относится также аминокислота пролин, в которой вторичная аминогруппа включена в состав пирролидинового
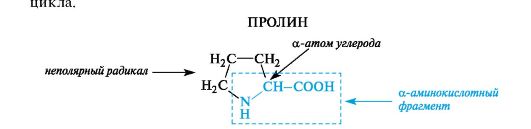
18. Свойства α-Аминокислот. Кислотно-основные свойства. Понятие об изоэлектрической точке (рI).
Пояснить на конкретном примере.
Амфотерность аминокислот обусловлена кислотными (СООН) и основными (NH2) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.

В кристаллическом состоянии α-аминокислоты существуют как диполярные ионы H3N+ - CHR-COO- (обычно используемая запись
строения аминокислоты в неионизированной форме служит лишь для удобства).
В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.

Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН 1-2) и анион-ные - в сильнощелочных (рН >11) средах.
Ионное строение обусловливает ряд специфических свойств аминокислот: высокую температуру плавления (выше 200?С), растворимость в воде и нерастворимость в неполярных органических растворителях. Способность большинства аминокислот хорошо растворяться в воде является важным фактором обеспечения их биологического функционирования, с нею связаны всасывание аминокислот, их транспорт в организме и т. п.
Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определенных значениях рН существенно зависит от строения радикала, главным образом от присутствия в нем ионогенных групп, играющих роль дополнительных кислотных и основных центров.
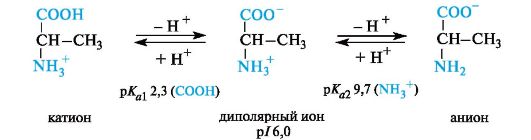
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой (p/).
Нейтральные α-аминокислоты. Эти аминокислоты имеют значения рI несколько ниже 7 (5,5-6,3) вследствие большей способности к ионизации карбоксильной группы под влиянием -/-эффекта группы NH2. Например, у аланина изоэлектрическая точка находится при рН 6,0.
Кислые α-аминокислоты. Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными (по Брёндстеду) с тремя значениями рКа, как это видно на примере аспарагиновой кислоты (р/ 3,0).
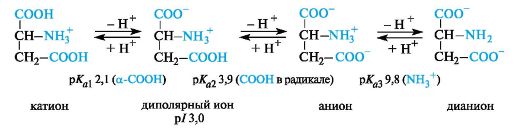
У кислых аминокислот (аспарагиновой и глутаминовой) изоэлектрическая точка находится при рН много ниже 7 (см. табл. 12.1). В организме при физиологических значениях рН (например, рН крови 7,3-7,5) эти кислоты находятся в анионной форме, так как у них ионизированы обе карбоксильные группы.
Основные α-аминокислоты. В случае основных аминокислот изоэлектрические точки находятся в области рН выше 7. В сильно- кислой среде эти соединения также представляют собой трехосновные кислоты, этапы ионизации которых показаны на примере лизина (р/ 9,8).
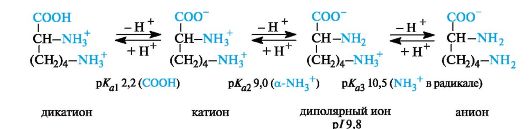
В организме основные аминокислоты находятся в виде катионов, т. е. у них протонированы обе аминогруппы.
В целом ни одна α-аминокислота invivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
19. Биологически важные реакции α-Аминокислот: а) трансаминирование; б) декарбоксилирование; в) дезаминирование: окислительное, восстановительное, внутримолекулярное, гидролитическое; г) образование пептидов.
В организме под действием различных ферментов осуществляется ряд важных химических превращений аминокислот. К таким пре- вращениям относятся трансаминирование, декарбоксилирование, элиминирование, альдольное расщепление, окислительное дезаминирование, окисление тиольных групп.
Трансаминирование является основным путем биосинтеза α-ами- нокислот из α-оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором - α-оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота - в аминокислоту с соответствующим строением радикалов. В итоге трансаминирование представляет обратимый процесс взаимообмена амино- и оксо- групп. Пример такой реакции - получение l-глутаминовой кислоты из 2-оксоглутаровой кислоты. Донорной аминокислотой может служить, например, l-аспарагиновая кислота.
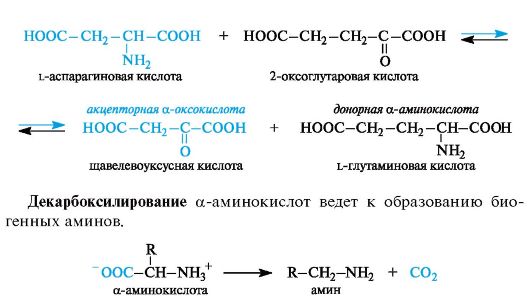
α-Аминокислоты содержат в α-положении к карбоксильной группе электроноакцепторную аминогруппу (точнее, протонированную аминогруппу NH3+), в связи с чем способны к декарбоксилированию.
Окислительное дезаминирование может осуществляться с участием ферментов и кофермента НАД+ или НАДФ+. α-Аминокислоты могут превращаться в α-оксокислоты не только через трансаминирование, но и путем окислительного дезаминирования. Например, из l-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии реакции осуществляется дегид-рирование (окисление) глутаминовой кислоты до α-иминоглутаровой
кислоты. На второй стадии происходит гидролиз, в результате которого получаются α-оксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента.
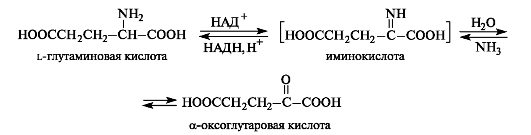
В обратном направлении протекает реакция восстановительного аминированияα-оксокислот. Всегда содержащаяся в клетках α-оксоглутаровая кислота (как продукт метаболизма углеводов) превращается этим путем в L-глутаминовую кислоту.












 адикала и могут замещат
адикала и могут замещат