Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
Zn | ZnSO4 || CuSO4 | Cu,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || - солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления, поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu2+ + 2e = Cu
Левый электрод: Zn2+ + 2e = Zn
Общая реакция: Cu2+ + Zn = Cu + Zn2+
Потенциал E электрода рассчитывается по формуле Нернста:
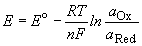 ,
,
где a Ox и a Red - активности окисленной и восстановленной форм вещества, участвующего в полуреакции; Eo - стандартный потенциал электрода (при a Ox = a Red =1); n - число электронов, участвующих в полуреакции; R - газовая постоянная; T - абсолютная температура; F - постоянная Фарадея. При 25o C

Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов:
E = E П - E Л.
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов:
 .
.
Для элемента Даниэля стандартная ЭДС равна
Eo = Eo (Cu2+/Cu) - Eo (Zn2+/Zn) = +0.337 - (-0.763) = +1.100 В.
ЭДС элемента связана с  G протекающей в элементе реакции:
G протекающей в элементе реакции:
 G = - nFE.
G = - nFE.
18. Растворимость. Условия образования осадка. Условия растворения осадка.
Способность вещества переходить в раствор называется растворимостью.
Если при проведении обменной реакции в растворе окажутся вместе катионы и анионы, образующие малорастворимое соединение, то мы можем ожидать, что из раствора выпадет осадок, равновесие сместится в сторону его образования и реакция пойдёт до конца. Такой характер носят реакции образования многих солей.

Произведение растворимости малорастворимого сильного электролита – это произведение молярных концентраций составляющих его катионов и анионов в насыщенном растворе. Концентрации катионов и анионов входят в произведение растворимости в степенях, равных их стехиометрическим коэффициентам.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе произведение концентраций ионов электролита становится больше ПР. При этом равновесие между фазой и раствором смещается в сторону образования осадка.
Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. В результате образования осадка концентрация другого иона, входящего в состав электролита тоже изменяется. Устанавливаемое новое равновесие, при котором произведение концентраций ионов электролита вновь становится равным ПР.
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов, произведение концентраций ионов будет меньше значения ПР, раствор станет ненасыщенным, а равновесие между жидкой фазой и осадком сместится в сторону растворения осадка. Следовательно, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР.



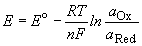 ,
,
 .
. G протекающей в элементе реакции:
G протекающей в элементе реакции:


