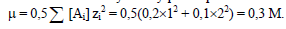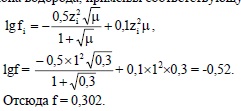Так как вода относится к слабым электролитам, то для реакции диссоциации в состоянии равновесия справедливо выражение:

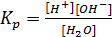 - константа равновесия
- константа равновесия
Так как 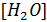 =55,0 моль/л при температуре 22 C, постоянная величина
=55,0 моль/л при температуре 22 C, постоянная величина
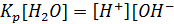 ]
]
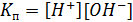 – ионное произведение воды, =10-7 при температуре 22С.
– ионное произведение воды, =10-7 при температуре 22С.
В чистой воде или нейтральном растворе
[H+] = [OH–] = 10–7 моль/л
В кислой среде
[H+] > 10–7, [OH–] < 10–7
В щелочной среде
[H+] < 10–7, [OH–] > 10–7
Для расчета концентрации ионов Н+ или ОН– используют значение отрицательного логарифма, который называется водородным или гидроксильным показателем соответственно
рН = –lg[H+] pOH = –lg[OH–]
Так как [H+] × [OH–] = 10–14, то для водных растворов выполняется соотношение
рН + рОН = 14
pH=-lg[H+]. От 1 до 7 – кислая среда, равное 7 – нейтральная, от 7 до 14 – щелочная.
21. Структура комплексных соединений. Ступенчатое комплексообразование.
Комплексные соединения – это определённые химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так ив растворённом состоянии.
В молекуле комплексного соединения один из атомов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем, или центральным атомом. В непосредственной близости к нему расположены (координированы) противоположно заряженные ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения. Общее число σ-связей, образуемых комплексообразователем с лигандами, называется координационным числом центрального иона. По числу σ-связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно-, ди- и более дентатные лиганды.
За пределами внутренней сферы комплексного соединения находится его внешняя сфера, содержащая положительно заряженные ионы (если внутренняя сфера комплексного соединения заряжена отрицательно) или отрицательно заряженные ионы (если наоборот); в случае незаряженной внутренней сферы внешняя сфера отсутствует.
Ионы, находящиеся во внешней сфере, связаны с комплексным ионом силами электростатического взаимодействия и в растворах легко отщепляются подобно ионам сильных электролитов. Лиганды, находящиеся во внутренней сфере комплекса, связаны с комплексообразователем ковалентными связями, и их диссоциация в растворе осуществляется в незначительной степени. С помощью качественных реакций обнаруживаются только ионы внешней сферы.
22. Расчет рН в растворах сильных кислот и оснований (на примерах).
1) Расчет рН растворов сильных кислот и оснований без учета коэффициентов активности ионов
Расчет рН проводится с учетом того, что сильные кисло-ты и основания в водных растворах полностью диссоциируют на ионы.
Пример 3. Рассчитать рН 0,01 М раствора соляной ки-слоты.
Решение. Записываем процесс диссоциации соляной ки-слоты:
HCl ⇒ H+ + Cl-.
Так как HCl является сильным электролитом и полно-стью диссоциирует на ионы, то из 0,01 М раствора HCl обра-зуется 0,01 моль-ион/л Н+ и 0,01 моль-ион/л ионов Cl-. Кроме того, в водных растворах в результате диссоциации воды об-разуется, согласно ионному произведению воды, 10-7 моль-ион/л ионов Н+. Так как 10-7<<0,01, то в данном случае рН раствора будет определяться только концентрацией ионов во-дорода, образующихся в результате диссоциации кислоты:
рН = - lg[Н+] = - lg0,01 = - lg10-2 = 2.
Пример 4. Рассчитать рН 0,001 М раствора гидроксида натрия.
Решение. Записываем процесс диссоциации гидроксида натрия:
NaOH.⇒ Na+ + OH-.
Так как NaOH является сильным электролитом и полно-стью диссоциирует на ионы, то из 0,01 М раствора NaOH об-разуется 0,01 моль-ион/л ионов ОН- и 0,001 моль-ион/л ионов Na+. Кроме того, в водных растворах в результате диссоциа-ции воды образуется, согласно ионному произведению, 10-7 моль-ион/л ионов ОН-. Так как, 10-7<<0,001, то в данном случае рН раствора будет определяться только концентрацией ионов гидроксида, образующихся в результате диссоциации основания:
рОН = - lg[ОН-] = - lg0,001 = - lg10-3 = 3.
Отсюда рН раствора:
рН = 14 – рОН = 14 – 3 = 11.
2) Расчет рН растворов сильных кислот и оснований с учетом коэффициентов активности ионов
Пример 5. Рассчитать рН 0,1 М раствора серной кисло-ты.
Решение. Записываем уравнение, соответствующее про-цессу диссоциации серной кислоты:
H2SO4 ⇔ 2H+ + SO4-2.
Так как в результате диссоциации 1 молекулы H2SO4 об-разуется 2 иона водорода, то [Н+] = 2×0,1=0,2 моль-ион/л, а концентрация [SO4-2] = 0,1 моль-ион/л.
Рассчитываем ионную силу раствора:
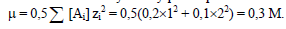
Так как μ = 0,1 – 0,5 М, находим коэффициент активно-сти иона водорода, применяя соответствующую формулу:
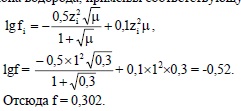
Вычисляем активность ионов водорода:
а = f×[H+] = 0,302×0,2 = 0,0604 моль-ион/л.
В данном случае, так же как в примерах 3 и 4, рН рас-твора будет определяться концентрацией ионов водорода, об-разующихся в результате диссоциации кислоты:
Вычисляем рН = - lga = - lg 0,0604 = 1,22.




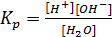 - константа равновесия
- константа равновесия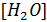 =55,0 моль/л при температуре 22 C, постоянная величина
=55,0 моль/л при температуре 22 C, постоянная величина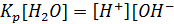 ]
]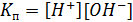 – ионное произведение воды, =10-7 при температуре 22С.
– ионное произведение воды, =10-7 при температуре 22С.