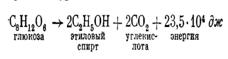Активность воды. Понятие о свободной и связанной влаге в пищевых продуктах.
Вода-важная составляющая пищевых продуктов. Она не является питательным веществом, но вода жизненно необходима как стабилизатор температуры тела, переносчик питательных веществ, реагент и реакционная среда во многих биохимических превращениях, стабилизатор биополимеров. Вода присутствует в растительных и животных продуктах как клеточный и внеклеточный компонент, как диспергирующая среда и растворитель, влияет на консистенцию, структуру, внешний вид, устойчивость продукта при хранении.
Обеспечение устойчивости при хранении продуктов определяется в большей мере соотношением свободной и связанной влаги.
Свободная влага- это влага не связанная полимером и доступная для протекания биохимических, микробиологических, химических процессов.
Свободная влага является непрерывной средой, в которой растворены компоненты пищи: органические кислоты, минеральные вещества, углеводы, ароматические вещества. Количество свободной воды можно значительно уменьшить высушиванием, замораживанием, сгущением. Свободная влага находится на поверхности продуктов, в крупных порах и макрокапиллярах, она легко удаляется механическим путем (отжатием, прессованием).
Связанная влага - это ассоциированная вода, прочно связанная с компонентами пищи- белками, углеводами, липидами за счет химических и физических связей.
Связывание воды и гидратация-это способность воды к ассоциации с различной степенью прочности с гидрофильными веществами. Размер и сила связывания воды или гидратации зависит от таких факторов, как природа неводного компонента, его солевой состав, рН, температура.
Активность воды (аw)-это отношение давления паров воды над продуктом(Рw) к давлению паров чистой воды (Р0) при той же температуре. Т.е. аw=Pw/P0
Активность воды равна относительной влажности в состоянии равновесия при которой продукт не впитывает влагу и не теряет ее в атмосферу, уменьшенной в 100 раз, т.е. активность воды определяется по формуле: аw=ф/100, где аw-активность воды в продукте; ф-относительная влажность; 100-коэффициент.
По величине активности воды выделяют: продукты с высокой влажностью(фрукты, овощи, молоко…); продукты с промежуточной влажностью(сыры, хлебобулочные изделия..); продукты с низкой влажностью(молоко сухое, мука, злаковые и крупяные). Зависимостью между содержанием влаги в пищевом продукте и активностью воды в нем при постоянной температуре, называется изотермой сорбции. В продуктах с высоким содержанием влаги «активность воды» выше, чем в продуктах с низким содержанием влаги.
Свойства
1. АК взаимодействуют с кислотами и щелочами:NH2-CH2-COOH+HCl=HCl* NH2-CH2-COOH
NH2-CH2-COOH+NaOH=H2O+ NH2-CH2-COOH
2.растворы АК в воде благодаря этому обладают свойствами буферных растворов: NH2-CH2-COOH=N+H3-CH2COO-
3.Ак могут вступать во все реакции, характерные для карбоновых кислот и аминов: NH2-CH2-COOH+CH3OH=H2O+ NH2-CH2-COOCH3
4.способность АК к поликонденсации, приводящей к образованию полиамидов: NH2-CH2-COOH+ NH2-CH2-COOH-HOOC-CH2-NH-CO-CH2NH2+H2O
Окисление липидов.
Окисление липидов. Липиды подвергаются окислению кислородом воздуха. Первыми продуктами окисления являются гидропероксиды, которые внедряются в радикал карбоновой кислоты. Быстрее всего воздействие оказывается на углерод, ближайший к кратной связи, а у насыщенных жирных кислот атакуется кислородом середина цепочки жирных кислот. Образовавшиеся гидропероксиды неустойчивы, в результате их превращения разрывается цепочка атомов углерода, образуются вторичные продукты окисления: эпоксисоединения, спирты, альдегиды, реже кетоны, карбоновые кислоты с углеродной цепочкой короче, чем у жирной кислоты.
Процесс окисления липида можно представить в виде схемы:
^ ЖИРНАЯ КИСЛОТА → ГИДРОПЕРОКСИД → ЭПОКСИСОЕДИНЕНИЯ→
→ СПИРТЫ → АЛЬДЕГИДЫ (КЕТОНЫ) → КАРБОНОВАЯ КИСЛОТА
Окисление липидов кислородом воздуха является автокаталитическим процессом. Окисление идет по цепному пути, продукты окисления способны реагировать друг с другом и образовывать полимеры. Направление и глубина окисления зависят от состава жирных кислот. С увеличением степени непредельности жирных кислот возрастает скорость их окисления.
Скорость окисления составляет:
СН³ 18: СН² 18 : СН¹18 как 77: 27: 1
линоленовая линолевая олеиновая
кислота кислота кислота
Окисление насыщенных жирных кислот происходит значительно медленнее, чем ненасыщенных.
На скорость окисления липидов оказывает влияние присутствие влаги, свет, металлов переменной валентности (Pb, Cu, Co, Mn, Fe), антиокислителей. К антиокислителям относят вещества, присутствие которых приводит к обрыву цепей окисления. Вместо активных радикалов, которые бы инициировали процесс окисления, образуются стабильные радикалы, которые не участвуют в этом процессе. Из природных антиокислителей часто применяют текоферол (витамин Е), из синтетических - соединения фенольной природы: ионол, Бутилгидрокситолуол (БОТ), Бутилгидроксианизол (БОА), пропилгаллаты. При внесении антиоксидантов в количестве 0,01 % стойкость жиров к окислению увеличивается в 10 – 15 раз. Подробнее различные антиокислители рассматриваются в дисциплине «Пищевые и биологически активные добавки».
Окисление липидов может проходить при действии биологических катализаторов – ферментов. В процессе ферментативного окисления липидов совместно участвуют ферменты липаза и липоксигеназа. На первом этапе окисления липаза осуществляет гидролиз тириацилглицеридов. Этот этап еще называют ферментативное прогоркание. Затем липоксигеназа катализирует образование гидропероксидов ненасыщенных жирных кислот (чаще это линолевая и линоленовая кислоты). Свободные жирные кислоты окисляются быстрее, чем их остатки, входящие в состав молекулы липида. При распаде гидропероксида образуются вещества, аналогичные продуктам окисления кислородом - образуются вторичные продукты окисления: эпоксисоединения, спирты, альдегиды, реже кетоны, карбоновые кислоты с углеродной цепочкой короче, чем у жирной кислоты.
В процессе окисления липидов образуются различные вещества, которые имеют неприятный вкус и запах (появляется «осаливание», «прогорклость», «запах олифы»), изменяется цвет продукта. В результате снижается пищевая и физиологическая ценность, а продукты могут оказаться непригодными в пищу (пищевая порча жиров). Наименее стойки при хранении сливочное масло, маргарин, кулинарный жир.
10. Гидролиз крахмала. Промежуточные и конечные продукты гидролиза. Влияние различных факторов среды на гидролиз крахмала
Крахмал состоит из остатков α -D-глюкопиранозы. Связь 1,4 у линейной структуры крахмала, которая называется амилоза и связи 1,4 и 1,6 у разветвленной структуры крахмала, которая называется амилопектин. Крахмал является основной углеводной составляющей пищи человека. Это главный энергетический ресурс человека.

Гидролиз крахмала осуществляют амилолитические ферменты. Фермент α-амилаза гидролизует крахмал действуя хаотично, разрывает 1,4 связь с образованием декстринов и небольшого количества мальтозы. Фермент α-амилаза действуя на крахмальное зерно образует каналы, раскалывая полисахарид на части. Схема гидролиза крахмала приведена на рисунке 3.1.
α-амилаза
КРАХМАЛ (ГЛИКОГЕН) → ДЕКСТРИНЫ + МАЛЬТОЗА + ГЛЮКОЗА
(много) (мало) (мало)

Рис. 3.1- Схема гидролиза крахмала ферментом α-амилаза
Фермент ß-амилаза гидролизует крахмал действуя с конца цепочки, разравыет связь 1,4 и образует мальтозу, в местах разветвления амилопектина действие ß -амилазы прекращается, в этом случае остается небольшое количество декстринов. Схема гидролиза крахмала ферментом ß –амилаза представлена на рисунке 3.2.
β-амилаза
КРАХМАЛ (ГЛИКОГЕН) → МАЛЬТОЗА + ДЕКСТРИНЫ
(много) (мало)

Рис. 3.2- Схема гидролиза крахмала ферментом ß –амилаза
Фермент глюкоамилаза действует с конца цепочки, отщепляет одну молекулу глюкозы, разрывает 1,4 связь, в местах разветвления амилопектина действие глюкоамилазы прекращается и остается небольшое количество непрогидролизовавшихся декстринов. Фермент олиго- 1,6- гликозидаза расщепляет 1,6 связь с образованием декстринов. Фермент изомальтаза гидролизует дисахарид изомальтоза до глюкозы. Гидролиз крахмала является важнейшей реакцией, происходящей при технологической переработке сырья в производстве пива, спирта.
Гидролиз гликогена осуществляют амилолитические ферменты.
Гидролиз пектина осуществляют пектолитические ферменты.
Растворимый пектин переходит из нерастворимого пектина в растворимое состояние при действии фермента протопектиназа или в присутствии разбавленных кислот. При этом пектин отщепляется от гемицеллюлозы или других связывающих компонентов. Растворимый пектин способен в кислой среде и в присутствии сахара образовывать желе и гели;
Пектовые кислоты образуются из растворимого пектина при действии фермента пектаза (пектинэстереза) или в присутствии разбавленных щелочей, при этом пектовая кислота теряет способность образовывать желе и гели. В результате действия фермента пектаза от растворимого пектина отщепляется метиловый спирт. Ферментативный гидролиз пектина можно представить в виде схемы:
протопектиназа пектинэстераза
НЕРАСТВОРИМЫЙ ПЕКТИН → РАСТВОРИМЫЙ ПЕКТИН →
→ ПЕКТОВАЯ КИСЛОТА + МЕТИЛОВЫЙ СПИРТ
Особенности гидролиза:
1) при гидролизе сначала образуется растворимый крахмал, далее сложные вещества – декстрины, мальтоза;
2) конечным продуктом гидролиза является глюкоза;
3) суммарное уравнение можно записать следующим образом:
(С6H10O5)n + nН2О = nС6Н12O6;
4) гидролиз крахмала – это его важное химическое свойство;
5) крахмал не дает реакции «серебряного зеркала», но ее дают продукты его гидролиза.
Пищевая ценность белковку
Биологическая ценность белков определяется сбалансированностью аминокислотного состава по содержанию незаменимых аминокислот. В эту группу входят аминокислоты, которые не синтезируются в организме человека. К незаменимым аминокислотам относят аминокислоты: валин, лейцин, изолейцин, фенилаланин, лизин, треонин, метионин, триптофан. Аминокислоты аргинин и гистидин относятся к частично заменимым, так как они медленно синтезируются организмом человека. Отсутствие в пище одной или нескольких незаменимых аминокислот приводит к нарушению деятельности центральной нервной системы, останавливают рост и развитие организма, к неполному усвоению других аминокислот. Биологическая ценность белков рассчитывается по аминокислотному скору (а.с.). Аминокислотный скор выражается в процентах, представляющих отношение содержания незаменимой аминокислоты в исследуемом белке продукта к ее количеству в эталонном белке. Аминокислотный состав эталонного белка сбалансирован и идеально соответствует потребностям человека в каждой незаменимой аминокислоте. Аминокислота, скор которой имеет самое низкое значение, называется первой лимитирующей аминокислотой. Например, в белке пшеницы лимитирующей является аминокислота лизин, в кукурузе – метионин, в картофеле и бобовых культурах лимитирующими являются метионин и цистин – это серосодержащие аминокислоты.
Животные и растительные белки отличаются по биологической ценности. Аминокислотный состав животных белков близок к аминокислотному составу белков человека, поэтому животные белки являются полноценными. Белки растительные содержат пониженное содержание лизина, триптофана, треонина, метионина, цистина.
Биологическая ценность белков определяется степенью их усвоения в организме человека. Животные белки имеют белее высокую степень усвояемости, чем растительные. Из животных белков в кишечнике всасывается 90 % аминокислот, а из растительных 60 - 80 %. В порядке убывания скорости усвоения белков продукты располагаются в последовательности:
рыба > молочные продукты > мясо > хлеб > крупы
Одной из причин низкой усвояемости растительных белков является их взаимодействие с полисахаридами, которые затрудняют доступ пищеварительных ферментов к полипептидам.
При недостатке в пище углеводов и липидов требования к белку несколько изменяется. Наряду с биологической ролью белок начинает выполнять энергетическую функцию. При усвоении 1 грамма белка выделяется 4 ккал энергии. При избыточном потреблении белка возникает опасность синтеза липидов и ожирения организма.
Суточная потребность взрослого человека в белках составляет 5 г на 1 кг массы тела или 70 - 100 г в сутки. На долю белков животного происхождения должно приходиться 55 % и растительного происхождения 45 % от суточного рациона человека.
29. Распад углеводов в аэробных условиях может идти прямым (aпотомическим или пентозным) путем и непрямым (дихотомическим) путем.
Дихотомическое (греч. dicha - на две части, tome-сечение)окисление углеводов идет по уравнению:
C6H12O6+6O2 ® 6 СО2+б Н2О+686 ккал
Этот путь является основным в образовании энергии. Первые этапы этого пути совпадают с анаэробным окислением глюкозы. Расхождение путей начинается на стадии образования пировиноградной кислоты, которая в животных тканях декарбоксилируется окислительным путем.
Первоначально предполагали, что пировиноградная кислота подвергается окислительному декарбоксилированию с образованием уксусной кислоты по уравнению: СН3—СО—СООН + 1/2 O2 СН3СООН+СО2. Потом было установлено, что уксусная кислота не является промежуточным продуктом при.декарбоксилировании пировиноградной кислоты, и возникло представление, что уксусная кислота существует в «активной» форме. Вскоре было показано, что для утилизации пирувата необходим коэнизм А (КоА). В химическом отношении КоА представляет нуклеотид, в состав которого входит аденозин-31, 51-дифосфат, фосфат, пантотеновая кислота и тиоэтиламин. Коэнзим А участвует в переносе остатка уксусной кислоты — ацетильного радикала (CH3CO-) также и других кислотных (ацильных) радикалов.
Окислительное декарбоксилирование пирувата — процеcc многоступенчатый, осуществляется сложной ферментативной системой, в состав которой помимо пируватдекарбоксилазы, тиаминдифосфата и коэнзима А входят дегидрогеназы с коферментом НАД+, и ФАД, липоевая кислота и ионы магния. В результате окисления пировиноградной кислоты образуются молекула aцетил-КоА («активной» формы уксусной кислоты), два атома водорода (в виде НАДН+Н+) и молекула СО2.
O
÷½
СН3-СО-СООН+НS-КоА+НАД+®СН3--С~S-~КоА+С02+НАДН+ H
Ацетил-КоА
Следующий этап непрямого аэробного окисления глюкозы характеризуется полным окислением ацетил-КоА в цикле Кребса до СО2 и Н2О.
ЦИКЛ ДИ- и ТРИКАРБОНОВЫХ КИСЛОТ (КРЕБСА).
Исследования показали, что дальнейшее окисление ацетил-КоА возможно лишь в присутствии небольших количеств какой-либо ди-карбоновой кислоты. Оказалось, что в начале ацетил-коэнзима А конденсируется с щавелевоуксусной кислотой (СООН—СН2— СО—СООН) с образованием лимонной (трикарбоновой) кислоты. Лимонная кислота является первым продуктом цикла Кребса, поэтому этот цикл иногда называют лимоннокислым.
Образовавшаяся лимонная кислота подвергается далее ряду сложных превращений. И прежде всего, дегидратированию с образованием цис-аконитовой кислоты. Последняя присоединяет молекулу воды и переходит в изолимонную кислоту. Изолимонная кислота подвергается дегидрированию и превращается в щавелево-янтарную, которая декарбоксилируется с образованием µ-кетоглютаровой. µ-Кетоглютаровая кислота подвергается окислительному декарбоксилированию и одновременно дегидрируется, переходя в сукцинил-КоА. Затем сукцинил-КоА превращается в янтарную кислоту. Янтарная кислота дегидрируется, превращаясь в фумаровую. Фумаровая переходит в яблочную, а из яблочной при ее дегидрировании образуется щавелевоуксусная. На этом цикл замыкается. Многие реакции цикла Кребса легко обратимы. Ферменты, катализирующие реакции цикла Кребса

сосредоточены в митохондриях. Последовательность реакций цикла Кребса последовательно изображена на суммарной схеме (рис. 7.3).
Из приведенной схемы видно, что в цикле Кребса в результате реакций дегидрирования образуется 4 пары водородных атомов и 2 молекулы СО 2. Освободившийся в ходе процесса окисления водород поступает в цепь биологического окисления и в конечном итоге окисляется молекулярным кислородом с образованием воды и выделением энергии.
При окислении в цикле ди- и трикарбоновых кислот одной молекулы ацетил-КоА образуется 12 молекул АТФ, из которых одиннадцать возникает путем окислительного фосфорилирования, а одна при субстратном фосфорилировании (при превращении сукцинил-КоА в янтарную кислоту).При окислении большинства субстратов в цепи биологического окисления происходит образование 3-х молекул АТФ, тогда как окисление некоторых из них (например, в случае янтарной кислоты) дает 2 молекулы АТФ. Энергетический баланс анаэробного и аэробного окисления глюкозы представляет следующую картину.
1. Две молекулы АТФ — это чистый прирост АТФ при превращениях глюкозы до пировиноградной кислоты в анаэробной фазе.
Глюкоза+2 НАД+ +2 АДФ+2 Фн-® 2 Пируват+2 НАДН+2 АТФ
2. Четыре молекулы АТФ образуются в результате окисления двух молекул НАДН, возникших при дегидрировании двух молекул 3-фосфоглицеринового альдегида (рис. 13). В связи с тем, что эти две молекулы НАДН являются цитоплазматическими, то отдаваемые ими электроны могут включиться в митохондриальную цепь биологического окисления не прямым путем, а с помощью так называемого челночного механизма. Суть этого механизма состоит в том, что сначала цитоплазматический НАДН реагирует с фосфодиоксиацетоном и образует глицерол-3-фосфат.
Фосфодиоксиацетон+НАДН ¾ Глицерол-3-фосфат+НАД+
¾®
Г'лицерол-3-фосфат легко проникает через митохондриальную мембрану и окисляется с участием флавинзависимой дегидрогеназы в фосфодиоксиацетон, причем простетическая флавиновая группа восстанавливается.
Глицерол-3-фосфат+Фл. пр. ¾¾® Фосфодиоксиацетон+
4-фл. пр. Н2. Фосфодиоксиацетон выходит из митохондрий, а восстановленный флавопротеид (Фл. пр. Н2) передает приобретенные электроны в цепь биологического окисления, обеспечивая окислительное фосфорилирование только двух молекул АДФ.
3. Шесть молекул АТФ возникают в процессе окислительного де-карбоксилирования двух молекул пировиноградной кислоты, образовавшихся в анаэробной.фазе из одной молекулы глюкозы.
4. При полном окислении двух молекул ацетил-КоА в цикле Кребса возникает 24 молекулы АТФ. В итоге полного аэробного окисления одной молекулы глюкозы синтезируется 36 молекул ЛТФ. При анаэробном гликолизе (брожении) на одну молекулу глюкозы образуется всего 2 молекулы АТФ. Таким образом, «выход» энергии, запасаемой в виде АТФ при кислородном распаде глюкозы, в 18 раз больше, чем при анаэробном.
Молочнокислое брожение — процесс анаэробного окисления углеводов, конечным продуктом при котором выступает молочная кислота. Название получило по характерному продукту — молочной кислоте. Для молочнокислых бактерий является основным путем катаболизма углеводов и основным источником энергии в виде АТФ. Также молочнокислое брожение происходит в тканях животных в отсутствие кислорода при больших нагрузках.
Различают т. н. гомоферментативное и гетероферментативное молочнокислое брожение, в зависимости от выделяющихся продуктов помимо молочной кислоты и их процентного соотношения. Отличие также заключается и в разных путях получения пирувата при деградации углеводов гомо- и гетероферментативными молочнокислыми бактериями.
Молочнокислое брожение используется для консервации продуктов питания (за счет ингибирования роста микроорганизмов молочной кислотой и понижения рН) с целью длительного сохранения (пример- квашение овощей, сырокопчение), приготовлении кисломолочных продуктов (кефира, ряженки, йогурта, сметаны), силосовании растительной массы, а также биотехнологического способа производства молочной кислоты.
30. Липиды с учетом особенностей своего строения вступают в разнообразные превращения. Рассмотрим наиболее важные из них.
Для глицеридов, составляющих основную массу масел и жиров, характерны следующие превращения: гидролиз, обмен остатков жирных кислот, входящих в их молекулы, окисление, гидрирование ненасыщенных ацилглицеринов.
Гидролиз ацилглицеринов. Под влиянием фермента липазы, кислот или щелочей триацилглицерины гидролизуются с образованием ди-, затем моноглицеридов и в конечном итоге - жирных кислот и глицерина.
Щелочной гидролиз ацилглицеринов получил название омыления, так как в результате его образуются соли жирных кислот - мыла.
Гидролитический распад жиров и масел, липидов зерна и продуктов его переработки (крупы, муки), мяса, рыбы, некоторых других видов пищевого сырья и готовых пищевых продуктов является одной из причин ухудшения их качества и, в конечном итоге, порчи. Этот процесс ускоряется с повышением влажности хранящихся продуктов, температуры, активности липазы. Гидролитический распад липидов и липидсодержащих продуктов протекает в ходе многих процессов пищевой технологии и при кулинарной обработке пищевых продуктов.
Количество свободных жирных кислот, содержащихся в жировых продуктах (в том числе и образовавшиеся в результате гидролиза липидов), может быть охарактеризовано с\ помощью кислотного числа.
Кислотное число - это масса (мг) гидроксида калия, необходимая для нейтрализации свободных жирных кислот, содержащихся в 1 г жира. Кислотное число жира для ряда пищевых продуктов нормируется стандартами и является одним из показателей, характеризующих их качество.
Переэтерификация. Ацилглицерины в присутствии кaтaлизaторов (метилат и этилат натрия, гидроксид натрия, ферменты способны к обмену (миграции) остатков жирных кислот. Этот процесс получил название переэтерификации. В результате переэтерификации меняется ацилглицериновый состав жира, а следовательно, меняются и их физико-химические свойства.
Обмен кислотных остатков может происходить между молекулами ацилглицеринов (межмолекулярная переэтерификация) и пределах одной молекулы (внутримолекулярная переэтерификация).
Переэтерификация открывает большие возможности для изменения свойств жира (температуры его плавления, затвердевания, пластичности), т. е. позволяют получать жиры с заданными для пищевой технологии физико-химическими свойствами без изменения их жирокислотного состава.
31. Процессы окисления углеводов. Брожение.
I этап — распад глюкозы или гликогена до пировиноградной кислоты; II этап — превращение пировиноградной кислоты в аце-тил-КоА; III этап — окисление ацетил-КоА в цикле Кребса. Реакции I этапа аналогичны процессу анаэробного распада углеводов, но имеют две особенности: 1) этап заканчивается образованием двух молекул пировиноградной кислоты; 2) при этом образуются 6—7 молекул АТФ вместо 2—3 молекул при анаэробных условиях.
На II этапе пировиноградная кислота подвергается окислительному декарбоксилированию с образованием двух молекул ацетил-КоА с накоплением молекул АТФ.
III этап характеризуется полным окислением двух молекул ацетилкофермента А в цикле Кребса до углекислого газа и воды, пр этом накапливается 24 молекулы АТФ.
В итоге непрямое аэробное окисление одной молекулы глюкозы обеспечивает выход 36 молекул АТФ, а если процесс начинается с распада гликогена, то 37 молекул. Остальная часть образовавшейся энергии рассеивается в виде тепла. Такой путь преобладает в печени, почках.
Спиртовое брожение — это процесс окисления углеводов, в результате которого образуются этиловый спирт, углекислота и выделяется энергия. Сбраживаться могут лишь углеводы, и притом весьма избирательно. Дрожжи сбраживают только некоторые 6-углеродные сахара (глюкозу, фруктозу, маннозу)
Схематично спиртовое брожение может быть изображено уравнением
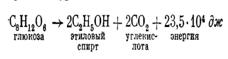
При спиртовом брожении пировиноградная кислота превращается в конечном итоге в спирт и углекислоту. Эти реакции протекают в две стадии. Сначала от пирувата отщепляется СО2 и образуется уксусный альдегид; затем уксусный альдегид присоединяет водород, восстанавливаясь в этиловый спирт. Все реакции катализируются ферментами. В восстановлении альдегида участвует НАД-H2. Биологический смысл спиртового брожения заключается в том, что образуется определенное количество энергии, которая запасается в форме АТФ, а затем расходуется на все жизненно необходимые процессы клетки.
Молочнокислое брожение. При молочнокислом брожении конечным продуктом является молочная кислота. Этот вид брожения осуществляется с помощью молочнокислых бактерий, которые подразделяются на две большие группы (в зависимости от характера брожения): гомоферментативные, образующие из сахара только молочную кислоту, и гетероферментативные, образующие, кроме молочной кислоты, спирт, уксусную кислоту, углекислый газ. У молочнокислых бактерий нет ферментативного аппарата для использования кислорода воздуха Молочнокислое брожение может быть описано уравнением

Гомоферментативное молочнокислое брожение вызывают бактерии рода Lactobacillus и стрептококки. Они могут сбраживать различные сахара с 6-ю (гексозы) или 5-ю (пентозы) углеродными атомами, некоторые кислоты. Однако круг сбраживаемых ими продуктов ограничен.
Гетероферментативное молочнокислое брожение — процесс более сложный, чем гомоферментативное: сбраживание углеводов приводит к образованию ряда соединений, накапливающихся в зависимости от условий процесса брожения. Одни бактерии образуют, помимо молочной кислоты, этиловый спирт и углекислоту, другие — уксусную кислоту; некоторые гетероферментативные молочнокислые бактерии могут образовывать различные спирты, глицерин, маннит. Гетероферментативное молочнокислое брожение вызывают бактерии рода Lactobacterium и рода Streptococcus. Молочнокислое брожение широко используется при выработке молочных продуктов: простокваши, ацидофилина, творога, сметаны.
Маслянокислое брожение.
Возбудителями брожения являются маслянокислые бактерии, получающие энергию для жизнедеятельности путем сбраживания углеводов. Они могут сбраживать разнообразные вещества — углеводы, спирты и кислоты, способны разлагать и сбраживать даже высокомолекулярные углеводы — крахмал, гликоген, декстрины.
Маслянокислое брожение в общем виде описывается уравнением

При этом брожении накапливаются различные побочные продукты. Наряду с масляной кислотой,, углекислым газом и водородом образуются этиловый спирт, молочная и уксусная кислоты.
Некоторые маслянокислые бактерии, кроме того, образуют ацетон, бутанол и изопропиловый спирт. Брожение начинается с процесса фосфорилирования глюкозы и далее идет по гликолитическому пути до стадии образования пировиноградной кислоты. Затем образуется уксусная кислота, которая активируется ферментом. После чего при конденсации (соединении) из двууглеродного соединения получается четырехуглеродная масляная кислота. Таким образом, при маслянокислом брожений происходит не только разложение веществ, но и синтез. Маслянокислое брожение происходит в природных условиях в гигантских масштабах: на дне болот, в заболоченных почвах, илах и всех тех местах, куда ограничен доступ кислорода. Благодаря деятельности маслянокислых бактерий разлагаются огромные количества органического вещества.
32. Реакции автоокисления жиров. Антиоксиданты.
Жирные кислоты при комнатной температуре подвергаются автоокислению и прогорканию. При этом они разлагаются на углеводороды, кетоны, альдегиды и небольшое количество эпоксидов и спиртов. Тяжёлые металлы, содержащиеся в небольших количествах в жирах и маслах, ускоряют автоокисление. Чтобы избежать этого, жиры и масла часто обрабатываются хелатирующими агентами, такими как лимонная кислота.
Различают автоокисление и термическое окисление жиров. Автоокисление жиров протекает при низких температурах вприсутствии газообразного кислорода. Термическое окисление протекает при температуре 140-200 0С. Между термическим и автоокислением есть много общего, но, однако, состав образующихся продуктов несколько различается. Процесс автоокисления жиров значительно ускоряется в присутствии влаги, света и катализаторов. Такими катализаторами могут быть легкоокисляющиеся металлы (окислы или соли железа, меди, свинца, олова), а также органические соединения, содержащие железо, белки, гемоглобин, цитохромы и другие. Продукты, образующиеся при автоокислении и термоокислении подразделяются на три группы:1. Продукты окислительной деструкции жирных кислот, в результате которой образуются вещества с укороченной цепью.2. Продукты изомеризации, а также окисленные триглицериды, которые содержат то ж количество углеродных атомов, что и исходные триглицериды, но отличаются от последних наличием в углеводородных частях молекул жирных кислот новых функциональных групп, содержащих кислород.3. Продукты окисления, содержащие полимеризованные или конденсированные жирные кислоты, в которых могут находиться и новые функциональные группы, имеющие в своем составе кислород.
Автоокисление – условие при котором проходит порча жиров. В основном жирные кислоты окисляются в присутствии кислорода. Окисление жиров происходит как серия цепных реакций, катализируемых собственными продуктами реакции(радикалы, гидропероксиды, пероксиды), Автоокисление – НЕОБРАТИМЫЙ процесс. Он может быть только замедлен. (а замедляются с помощью антиоксидантов)
Антиоксиданты (антиокислители, консерванты) — ингибиторы окисления, природные или синтетические вещества, способные замедлять окисление. В процессе переработки и хранение пищевые продукты подвергаются окислению кислородом воздуха, что приводит к снижению их биологической ценности, уменьшению сроков хранения. Антиоксиданты препятствуют окислению и химическим реакциям с кислородом. Антиоксиданты защищают жиры, масла и жиросодержащие продукты от прогоркания, улучшают потребительские свойства фруктовыъ и овощных соков, безалкогольных напитков, пива и вина, а также консервированных, замороженных или упакованных в вакуумную фруктов, овощей, рыбы, грибов. Антиоксиданты – Аскорбиновая кислота, аскорбил пальмитат, витамин Е(альфа-токоферол), смесь токоферолов.
Антиоксиданты препятствуют дальнейшему автоокислению жиров. Механизм действия наиболее распространённых антиоксидантов (ароматические амины, фенолы, нафтолы и др.) состоит в обрыве реакционных цепей: молекулы антиоксиданта взаимодействуют с активными радикалами с образованием малоактивных радикалов. Окисление замедляется также в присутствии веществ, разрушающих гидроперекиси (диалкилсульфиды и др.). В этом случае падает скорость образования свободных радикалов. Даже в небольшом количестве (0,01—0,001 %) антиоксиданты уменьшают скорость окисления, поэтому в течение некоторого периода времени (период торможения, индукции) продукты окисления не обнаруживаются. В практике торможения окислительных процессов большое значение имеет явление синергизма — взаимного усиления эффективности антиоксидантов в смеси, либо в присутствии других веществ.
33. Реакции дегидратации и термической деградации липидов
Кстати, в жареных продуктах значительно выше содержание веществ, образующихся во время термической деградации липидов - формальдегид, ацетальдегид, акролеин, глиоксаль, метилглиоксаль, малоновый альдегид, полиароматические углеводы, гетероциклические амины (Все что нашел L)
Гидролиз. С помощью данной реакции определяют строение липидов, а также получают ценные продукты. Гидролиз – первая стадия утилизации и метаболизма пищевых жиров в организме, проходящий под действием ферментов липаз. В промышленности реакция идёт под действием перегретого пара или при нагревании с водой в кислой или щелочной (омыление) среде.
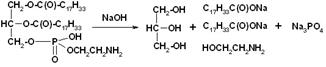
Не нашел не дегидратации ни термической деградации липидов, только вот этот бред.
34. Реакции образования коричневых продуктов
Потемнение пищевых продуктов может иметь место в результате окислительных или неокислительных реакций. Неокислительное или неферментативное потемнение связано с реакциями углеводов и включает явление карамелизации и взаимодействие углеводов с белками или аминами (реакция Майяра).
Карамелизация. Прямой нагрев углеводов, особенно сахаров и сахарных сиропов, способствует протеканию комплекса реакций, называемых карамелизацией. Реакции катализируются небольшими концентрациями кислот, щелочей и некоторых солей. При этом образуются коричневые продукты с типичным карамельным ароматом. При этом основными являются реакция дегидратации с образованием ангидроколец или включение двойных связей в кольца углеводов. В результате образуются соединения, имеющие коричневый цвет.
Реакция Майяра (меланоидинобразование). Реакция Майяра является первой стадией реакции неферментативного потемнения пищевых продуктов. Для протекания реакции требуется наличие редуцирующего сахара, аминного соединения (аминокислоты, белки) и немного воды.
На начальной стадии реакции Майяра карбонильный углерод редуцирующего сахара в открытой цепи подвергается нуклеофильной атаке свободной электронной парой аминного азота. Это сопровождается потерей воды и замыканием кольца с образованием глюкозоамина (рис. 2). Глюкозоамин подвергается перегруппировке по Амадори и переходит в аминокислоту (фруктозоамин). Продукты реакции, полученные при перегруппировке по Амадори, могут далее превращаться по двум путям: один – через дикарбонильные промежуточные соединения (дифруктозоамин), другой – через образование промежуточных дезоксигексозулоз. В обоих случаях образуются меланоидиновые пигменты.
Поскольку в реакции Майяра участвуют белки и аминокислоты, очевидно, что имеет место определенная их потеря, как нутриента питания и снижение пищевой ценности продукта.
Протекание реакции меланоидинообразования можно ингибировать снижением рН ниже 6 ед., обеспечением в продукте очень низкой или высокой «активности воды», снижением температуры технологического процесса, снижением концентрации сахара (разведением) или его полным удалением, например, путём окисления.
Типы гидролиза углеводов
Гидролиз углеводов
Углеводы пищи в пищеварительном тракте распадаются на мономеры при действии гликозид - ферментов, катализирующих гидролиз гликозидных связей в полисахаридах. По числу входящих в их молекулы структурных единиц (остатков простейших углеводов) и способности к гидрол