

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Ионная связь – связь между ионами. Её образуют атомы, сильно отличающиеся по электроотрицательности – типичные металлы и типочные неметаллы (щелочные, щелочноземельные металлы, галогены). Электроны от атома металла полностью переходят к атому неметалла. Связь образуется за счет электростатического притяжения разноименно заряженных ионов. Ионная связь – предельно смещенная ковалентная полярная связь.
Она является ненаправленной, т.к. электоростатическое поле действует по всем направлениям. Например, в кристалле NaCI ион натрия наиболее сильно притягивает шесть близлежащих ионов хлора.

Соединения с ионной связью образуют кристаллические решетки, в узлах которых находятся ионы.
Ионная связь имеется в солях.
Металлы первой группы периодической системы элементов Менделеева образуют однозарядные ионы и, как принято говорить, имеют ионную валентность +1; металлы второй группы образуют двухзарядные ионы и имеют ионную валентность +2, и т.д. Аналогично галогены, элементы седьмой группы, присоединяют электрон и образуют однозарядные отрицательные ионы, т. е. имеют ионную валентность -1; кислород и его аналоги могут присоединять два электрона с образованием двухзарядных отрицательных ионов со структурой инертных газов и обладают ионной валентностью -2, и т.д. Состав солей определяется ионными валентностями их катионов и анионов при соблюдении условия электронейтральности образующегося соединения.
Кулоновские силы, действующие между ионами, например Na+ и Cl-, приводят к тому, что каждый ион притягивает соседние ионы противоположного знака и создаёт из них окружение. В случае хлорида натрия это приводит к устойчивому упорядоченному расположению, отвечающему кристаллической структуре, при которой каждый ион имеет шесть ближайших соседей противоположного знака и двенадцать соседей того же знака, находящихся на расстоянии в 21/2 раза большем. Общая кулоновская энергия для такого расположения находится суммированием по парам ионов, и она равна -1,7476 e2/R для пары ионов Na+CI-, где R - расстояние между центрами ионов ближайших соседей, е - заряд иона. Следовательно, кристалл стабилизирован кулоновским притяжением, энергия такой системы на 75% превышает энергию системы положительных и отрицательных зарядов, находящихся на тех же расстояниях R друг от друга. Кулоновская энергия кристалла NaCI большая - она составляет около 860 кдж×моль-1, с учётом сродства хлора к электрону затраты такой энергии более чем достаточно для сублимации металлического натрия, ионизации его атомов и диссоциации молекул хлора на атомы, а остальная энергия (410 кдж×моль-1) соответствует энергии образования хлорида натрия из элементов.
Силы притяжения ионов противоположного заряда называются силами ионной валентности. Можно сказать, что в кристалле хлорида натрия, в котором ион натрия имеет координационное число шесть (то есть он окружен шестью ближайшими соседями), общая ионная валентность иона натрия +1 разделяется между соседями, при этом каждую из шести связей между натрием и прилегающим хлором можно рассматривать как ионную связь силой 1/6. Отрицательный заряд иона хлора удовлетворяет шесть ионных связей, каждая силой 1/6, от шести соседних ионов натрия. Согласно правилу валентности, весьма существенному в неорганической химии, сумма ионных валентностей, направленных к каждому отрицательному иону, должна быть точно или приближённо равна ионной валентности данного отрицательного иона.
В ионных кристаллах связи в действительности не являются чисто ионными. Они носят частично ковалентный характер.
Метод молекулярных орбиталей (МО). Связывающие и разрыхляющие МО, сигма- и пи- МО. Энергетические диаграммы МО и порядок заполнения орбиталей электронами для двухатомных молекул элементов 2 периода на примере молекул типа А2,AB: O2, HF, LiF.
Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1s1 и 1s2 – МО± = C11s1 ±C21s2.
Поскольку ядра во взаимодействующих атомах водорода одинаковы, то и вклад атомных орбиталей будет одинаковым, что обеспечивается равенством коэффициентов, с которыми s-орбитали участвуют в линейной комбинации (C1 = C2 = C). Поскольку должно выполняться требование, что сумма квадратов коэффициентов при АО равна 1, то имеем 2C2 = 1. Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
 и
и 
Молекулярная орбиталь (MO1), включающая сумму 1sволновых функций одного и второго атомов водорода называется связывающей МО, а молекулярная орбиталь (MO2), включающая разность волновых функций атомов, называется разрыхляющей МО. Уровень энергии связывающей МО всегда ниже уровней энергии атомных орбиталей (АО), на основе которых формируется МО, а энергия разрыхляющей МО выше энергии атомных орбиталей.
Заселение электронами связывающей МО σсв стабилизирует систему, а заселение разрыхляющих – дестабилизирует ее.
Так же как и АО молекулярные орбитали (МО) на схемах иногда изображают клетками. МО заселяют электронами в соответствии с принципом минимума энергии, принципом Паули и правилом Хунда. Так, два электрона молекулы водорода следует поместить на связывающую МО. Спины электронов при этом антипараллельны.
базе энергии связывающей МО всегда ниже уровней энергии атомных орбиталей (АО) на базеа называется связывающей МО, а молекул
Энергетическая диаграмма атомных и молекулярных уровней водорода: Заселение электронами связывающей МО σсв стабилизирует систему, а заселение разрыхляющих – дестабилизирует ее. Переход двух электронов на МО σсв способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H–H. Даже удаление одного электрона с МО (σсв)2 c образованием (σсв)1 в молекулярном ионе H2+H оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
Основные положения метода молекулярных орбиталей.
1. Вся молекула рассматривается как единое целое, состоящее из ядер и электронов бывших атомов.
2. Всe электроны являются общими для всех ядер, т.е. химические связи являются многоцентровыми и простираются между ядрами всей молекулы.
3. Для решения уравнения Шредингера, как и в случае расчета атомных систем, вводится понятие одноэлектронного приближения, которое предполагает, что можно рассматривать каждый электрон движущимся в поле ядер и усредненном поле остальных электронов молекулы. В молекуле образуется собственная система молекулярных орбиталей, на которых находятся все электроны данной молекулы.
4. Распределение электронов по орбиталям подчиняется тем же принципам что и по АО: принцип минимума энергии, принцип Паули, правило Хунда.
Логично предположить, что движение электрона вблизи некоторого ядра будет приблизительно таким как и в атоме в отсутствие других атомов. Поэтому вблизи этого ядра МО должна быть похожа на АО. Поэтому МО можно представить в виде линейной комбинации АО, т.е. ЛКАО:
Ψi = Ci1Φ1 + Ci2Φi2 …CijΦij, где Cij – численные коэффициенты, которые находятся решением уравнения Шредингера. По физическому смыслу квадраты данных коэффициентов определяют вероятность нахождения электрона на данной МО (i) в области пространства данного атома (j).
Общее количество таким образом построенных МО равно общему количеству базисных АО, из которых они сформированы. Кроме связывающих и разрыхляющих выделяют несвязывающие МО, которые локализованы на одном из атомов, не участвуют в образовании связи и соответствуют в первом приближении АО. Так, в молекуле НF из орбитали атома водорода и орбитали атома фтора образуются одна связывающая (σсв) и одна разрыхляющая (σраз.) орбитали молекулы, причем, связыающая орбиталь ближе по энергии к уровню 2рх АО фтора, а разрыхляющая – к уровню энергии 1s АО водорода. 2py и 2pz орбитали фтора трансформируются в несвязывающие молекулярные орбитали HF и, по существу, локализованы на атоме фтора. С 1s орбиталью они не взаимодействуют из-за разной симметрии волновых функций. Хотя волновые функции1s орбиталь водорода и 2s фтора одинаковы по симметрии (интеграл перекрывания функций отличен от нуля), взаимодействие этих орбиталей практически отсутствует, потому что велика разность уровней энергии этих орбиталей. 2s орбиталь формально трансформируется в несвязывающую орбиталь, а по существу совпадающую с ней. На несвязывающих орбиталях обычно находятся неподеленные пары электронов.
 Из двух 1s АО атомов водорода 2s и 2рх АО атома бериллия получают две сигма-связывающие (σсв), на которые помещают четыре валентных электрона атомов водорода и бериллия, и две сигма-разрыхляющие (σраз.) МО.
Из двух 1s АО атомов водорода 2s и 2рх АО атома бериллия получают две сигма-связывающие (σсв), на которые помещают четыре валентных электрона атомов водорода и бериллия, и две сигма-разрыхляющие (σраз.) МО.
 Сигма-связь (σ-связь) имеет осевую симметрию, причем ось симметрии является осью соединяющей ядра атомов образующих связь. Пи-связь (π-связь) имеет плоскость симметрии перпендикулярную этой оси и пересекающую ее в середине между ядрами атомов. Например, σ- и π-связи, образованные рх и pz (рy) AO соответственно.
Сигма-связь (σ-связь) имеет осевую симметрию, причем ось симметрии является осью соединяющей ядра атомов образующих связь. Пи-связь (π-связь) имеет плоскость симметрии перпендикулярную этой оси и пересекающую ее в середине между ядрами атомов. Например, σ- и π-связи, образованные рх и pz (рy) AO соответственно.
Образование сигма (σ) и пи-связей (π) из различных атомных орбиталей:
Молекулярные орбитали двухатомных молекул элементов второго периода: Волновая функция МО строится как линейная комбинация волновых функций 2s и 2р АО этих элементов. Комбинацией двух 2s АО получают одну связывающую (σсв) и разрыхляющую (σ*) молекулярную орбиталь. Из двух 2рх АО – одну связывающую (σсв) и разрыхляющую (σ*). Изменение энергии при образовании сигма-МО (σсв, σ*) больше,чем при образовании пи-МО, так как в первом случае перекрывание АО больше. Из четырех pz и рy AO получают две связывающие, вырожденные МО и две разрыхляющие вырожденные МО. Заполнение МО валентными электронами осуществляется в соответствии с принципом минимума энергии, принципом Паули и правилом Хунда. Такой порядок уровней энергии МО у молекул фтора и кислорода.
 У двухатомных молекул порядок расположения уровней МО несколько изменяется. МО одинаковой симметрии и близкие по энергии могут взаимодействовать. При этом уровень энергии МО с большей энергией поднимается еще выше, а менее энергетический уровень МО опускается еще ниже. Одинаковыми по симметрии на диаграмме являются две (σсв) и две (σ*) МО. В молекулах F2 и O2 oни, однако, значительно отличаются по энергии и, поэтому практически не взаимодействуют. А вот в молекулах Li2, В2, С2 и N2 отличие в энергии невелики, поэтому взаимодействие (σсв) орбиталей, образованных из s и р АО приводит что энергия (σсв) МО, образованной s АО становится выше энергии двух вырожденных, связывающих π-МО, в частности в молекуле В2.
У двухатомных молекул порядок расположения уровней МО несколько изменяется. МО одинаковой симметрии и близкие по энергии могут взаимодействовать. При этом уровень энергии МО с большей энергией поднимается еще выше, а менее энергетический уровень МО опускается еще ниже. Одинаковыми по симметрии на диаграмме являются две (σсв) и две (σ*) МО. В молекулах F2 и O2 oни, однако, значительно отличаются по энергии и, поэтому практически не взаимодействуют. А вот в молекулах Li2, В2, С2 и N2 отличие в энергии невелики, поэтому взаимодействие (σсв) орбиталей, образованных из s и р АО приводит что энергия (σсв) МО, образованной s АО становится выше энергии двух вырожденных, связывающих π-МО, в частности в молекуле В2.
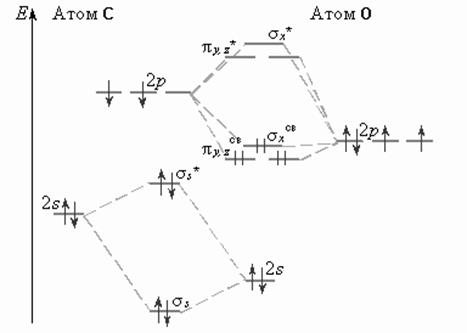 Удаление электрона со связывающей орбитали уменьшает энергию связи в молекулярном ионе (N2+, C2+, B2+ и Li2, а удаление электрона с разрыхляющей орбитали приводит к увеличению энергии связи в молекулярном ионе (O2+ и F2+) в сравнении с молекулой.
Удаление электрона со связывающей орбитали уменьшает энергию связи в молекулярном ионе (N2+, C2+, B2+ и Li2, а удаление электрона с разрыхляющей орбитали приводит к увеличению энергии связи в молекулярном ионе (O2+ и F2+) в сравнении с молекулой.
Метод МО позволяет объяснить и магнитные свойства молекул. На диаграмме энергетических уровней молекулы кислорода и бора имеют по два электрона с параллельными спинами, значит молекулы в целом имеют отличный от нуля магнитный момент и являются парамагнитными. Молекулы Li2, C2, N2, F2 – диамагнитны.
Аналогично можно построить диаграммы уровней энергии МО двухатомных гетерогенных молекул элементов второго периода, например, молекулы СО.
Порядок связи в двухатомных молекулах в методе МО определяется как полуразность количества электронов на связывающих и разрыхляющих МО: 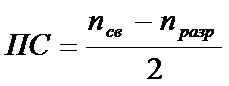 ;
;
Так, порядок связи для молекулы Li2 равна (2 – 0)/2 = 1, Ве – (2 – 2)/2 = 0, В2 – (4 – 2)/2 = 1, С2 – (6 – 2)/2 = 2, N2 – (8 – 2)/2 = 3, O2 – (8 – 4)/2 = 2, F2 – (8 – 6)/2 = 1, Ne2 – (8 – 8)/2 = 0.
Порядок связи в молекулах бериллия (Be2) и неона (Ne2) равен нулю. Действительно, такие молекулы не существуют.
Сравнительная характеристика методов МО и ВС
Оба квантовомеханических подхода к описанию химической связи – методов МО и ВС – приближенны, метод МО придает преувеличенное значение делокализации электрона в молекуле и основывается на одноэлектронных волновых функциях – молекулярных орбиталях. Метод ВС преувеличивает роль локализации электронной плотности и основывается на том, что элементарная связь осуществляется только парой электронов между двумя атомами. Сравнивая методы ВС м МО, следует отметить, что достоинством первого является его наглядность: насыщаемость связи объясняется как максимальная ковалентность, направленность вытекает из направленности атомных и гибридных орбиталей; дипольный момент молекулы складывается из дипольных моментов связей, разности ОЭО атомов, образующих молекулу, и наличия неподеленных электронных пар. Метод ВС достаточно хорошо предсказывает валентные возможности атомов и геометрию образующейся молекулы. Однако существование некоторых соединений невозможно объяснить с позиций метода ВС. Это электронодефицитные соединения (B2H6, NO,) и соединения благородных газов (XeF2, XeF4, ХеО3). Их строение легко объясняет метод МО. Устойчивость молекулярных ионов и атомов в сравнении с молекулами легко предсказывается с позиции метода МО. И, наконец, магнетизм и окраска вещества также легко объясняются метода МО. Количественные расчеты в методе МО, несмотря на свою громоздкость, все же гораздо проще, чем в методе ВС. Поэтому в настоящее время в квантовой химии метод ВС почти не применяется. В то же время качественно выводы метода ВС гораздо нагляднее и шире используются экспериментаторами, чем метода МО. Основанием для этого служит тот факт, что реально в молекуле вероятность пребывания данного электрона между связанными атомами гораздо больше, чем на других атомах, хотя и там она не равна нулю. В конечном счете, выбор метода определяется объектом исследования и поставленной задачей.
|
|
|

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...
© cyberpedia.su 2017-2026 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!