

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Другим важным примером отклонения от равновесия является образование в процессе фазовых превращений метастабильных фаз. Так называют неравновесные фазы, представляющие собой в одних случаях:
а) переходную стадию между исходной фазой и равновесной,
в других –
б) фазу, устойчивую при определенных соотношениях давления, температуры и концентраций.
На диаграммах фазовых равновесий метастабильные равновесия изображаются штриховыми линиями.
Метастабильные фазы образуются при кристаллизации элементарных веществ и двойных сплавов при значительном переохлаждении расплавов (растворов), при этом температурно-концентрационная область, в которой эти фазы являются метастабильными, имеет разную протяженность. Изобарно-изотермный потенциал у метастабильной фазы меньше, чем у исходной, но больше, чем у равновесной фазы, поэтому превращение метастабильной фазы в равновесную требует определенной энергии активации, при отсутствии которой метастабильная фаза может существовать сколь угодно долго.
Образование метастабильных фаз – явление, часто наблюдаемое и широко используемое и при превращениях в твердом состоянии. Сюда относится, прежде всего, образование пересыщенных твердых растворов, если их распад осуществляется при низких температурах, когда диффузия и соответственно образование равновесных фаз затруднены.
Есть все основания предполагать, что наблюдающееся в сильно легированных полупроводниках несовпадение концентрации электрически активной примеси и ее общей (химической) концентрации (политропия примеси) является в ряде случаев результатом начальных стадий распада твердого раствора, в процессе которого с участием примеси образуются метастабильные фазы.
|
|
Метастабильные фазы образуются также при резком охлаждении твердых растворов, которые должны в равновесных условиях охлаждения испытывать эвтектоидное превращение. Иллюстрацией этого является мартенситное превращение при закалке стали (аустенита). Многие из метастабильных состояний обусловливают в сплавах полезные, а иногда и уникальные свойства. Цель материаловедения – установление природы этих неравновесных состояний и разработка принципиальных режимов, позволяющих получить метастабильные состояния. Исходным моментом при решении этих задач является знание диаграмм фазовых равновесий.
Для описания метастабильных фаз используют специальные диаграммы фазовых равновесий метастабильных фаз – так называемые метастабильные диаграммы. Области метастабильности и метастабильные химические соединения на таких диаграммах показывают штрихованной линией. Вопрос о применении правила фаз к метастабильным диаграммам является дискуссионным. На рис. 3.17 приведены диаграммы фазового равновесия систем Со-С и Ni-С и метастабильные диаграммы этих систем.
Величина метастабильности определяется разностью между энергиями метастабильной фазы и смеси стабильных фаз. При очень больших скоростях охлаждения (102 – 1010) К /с из переохлажденных расплавов (растворов) ниже определенной температуры можно получить твердые метастабильные фазы не только в кристаллическом, но и в аморфном состоянии (когда в фазе есть ближний порядок и отсутствует дальний порядок в расположении атомов). Сплавы в аморфном состоянии можно получать не только при кристаллизации из жидкой фазы, но и при осаждении из газовой фазы. Для получения в аморфном состоянии фаз с ковалентным типом связи требуются меньшие скорости охлаждения, по сравнения с фазами с металлическим типом связи.

| Рисунок 3.17. – Метастабильные диаграммы (сплошные линии – стабильное, штрихованные – метастабильное равновесия): а – возможные метастабильные равновесия в диаграмме эвтектического типа; б – возможные метастабильные равновесия в диаграмме перитектического типа; в – метастабильная диаграмма системы Со-С; г – метастабильная диаграмма системы Ni-C. |
Знать диаграмму фазовых равновесий необходимо также при выборе составов жидкой фазы и температурных условий кристаллизации. Это особенно важно при получении кристаллов соединений. Рассмотрим это на примере получения монокристаллов вытягиванием их из жидкой фазы по методу Чохральского.
|
|
Кристаллизация происходит на кристалле–затравке, соприкасающемся с поверхностью жидкого расплава, переохлажденного на ∆ T ниже температуры ликвидуса. Это переохлаждение поддерживается в течение всего процесса кристаллизации. По мере кристаллизации новых слоев твердой фазы на затравке кристалл вытягивают из жидкой фазы. Состав кристаллизующейся твердой фазы определяется диаграммой фазового равновесия, если в процессе вытягивания поддерживаются условия, близкие к равновесным (скорость кристаллизации мала, широко развиты процессы диффузии в твердой и жидкой фазе, т.е. ∆ Т →0).
Конгруэнтно плавящиеся соединения, например GaTe и Ga2Te3 (см. рис. 3.13 а), можно получать из жидкой фазы того же состава, что и состав соединения. Их можно получать и кристаллизацией из расплава несколько отличающегося состава: например, соединение GaTe – из расплава состава Х 1 кристаллизацией при какой-либо из температур в интервале между 1100 и 1019 К. Однако при этом следует учитывать, что если соединение обладает определенной областью гомогенности, то вытягиваемый кристалл не будет иметь стехиометрического состава, а будет представлять собой твердый раствор предельной концентрации на основе этого соединения, равновесный для температуры кристаллизации.
Инконгруэнтно плавящиеся соединения нельзя получать из жидкой фазы того же состава. Так, на рис. 3.13 видно, что из жидкой фазы, отвечающей составу GaTe3 при переохлаждении ниже линии ликвидуса, будет кристаллизоваться твердая фаза состава Ga2Te3, а не GaTe3. Чтобы при кристаллизации из жидкой фазы выделялось конгруэнтно плавящееся соединение GaTe3, состав жидкой фазы должен лежать в интервале концентрации от Х 2 до Х 3, а кристаллизацию следует вести при температуре в интервале между Т 3 (~760 К) и Т 4 (709 К). Рассмотренную выше кристаллизацию инконгруэнтно плавящегося соединения принято называть кристаллизацией из раствора.
|
|
В отличие от этого кристаллизацию из жидкой фазы, отвечающей по составу кристаллизуемой твердой фазе, называют кристаллизацией из расплава. Вообще, понятия «расплав» и «жидкий раствор» требуют уточнения. Под расплавом следует понимать жидкую фазу, состав которой по основному (основным) компоненту (компонентам) отвечает составу элементарного вещества или соединения в пределах точности их определения, и содержание фоновых примесей и легирующих добавок, в котором не превышает (1 – 2) % (ат.). Под жидким раствором следует понимать жидкую фазу, состав которой по основным компонентам не совпадает с составом твердой фазы, а также и такую жидкую фазу, содержание фоновых примесей и легирующих добавок в которой превышает (1 – 2) % (ат.).
§ 9. Р – Т и Р – Т – Х диаграммы фазовых равновесий
Использование высоких и сверхвысоких давлений (единицы и десятки гигапаскалей) в ряде случаев приводит к изменению типа фазовой диаграммы, резкому смещению температур фазовых превращений, появлению новых фаз, отсутствующих в данной системе при атмосферном давлении. С этим связана важность изучения диаграмм фазового равновесия, построенных в координатах Р – Т – X (где Р – внешнее давление).
При этом основная закономерность заключается в том, что повышение давления затрудняет превращения, связанныe с увеличением удельного объема, и расширяет по составу и температуре области существования фаз с высокой плотностью.
В связи с возросшей ролью в полупроводниковой электронике различного рода полупроводниковых соединений и твердых растворов на их основе, содержащих летучие компоненты, представляет интерес изучение фазовых диаграмм, построенных в координатах р – Т – X, где р – давление пара летучего компонента или давление его диссоциации.
В системах, компоненты которых обладают малым давлением диссоциации и в которых максимальная температура плавления смесей ниже самой низкой температуры кипения компонентов, ролью газовой фазы можно пренебречь. Фазовые диаграммы этих систем строят обычно до температур ниже температуры кипения.
|
|
На рис. 3.18 приведен пример фазовой диаграммы с эвтектикой в интервале температур ниже температур кипения чистых компонентов.
Если же давление диссоциации какого-либо компонента велико, то состав газовой фазы необходимо учитывать при температурах как выше, так и ниже температур ликвидуса практически во всем интервале температур, в котором исследуются фазовые равновесия в изучаемой системе.

| Рисунок 3.18. – Фазовая диаграмма системы с эвтектическим разрывом растворимости и с малыми давлениями диссоциации компонентов. |
Таким образом, следует различать фазовые диаграммы для систем с малым давлением диссоциации, в которых Р – внешнее давление, влияющее, в частности, на фазовые превращения в твердом состоянии, и для систем с большим давлением диссоциации, в которых р – давление пара легколетучего компонента или давление диссоциации; в дальнейшем будем обозначать его р дис. Основной особенностью этих фазовых диаграмм является появление геометрических элементов, описывающих состав газовой фазы.
Фазовые диаграммы, построенные в координатах Р – Т.
Диаграммы однокомпонентных систем, изображенные в координатах Р – Т, представляют собой проекции диаграмм построенных в координатах G–Т–Р (где G – изобарно-изотермный потенциал), на плоскость Р – Т (рис. 3.19). Диаграммы G – Т – Р наглядно демонстрируют равенство химических потенциалов компонента (или адекватное ему в условиях однокомпонентной системы – равенство изобарно-изотермных потенциалов фаз) в условиях фазового равновесия.
Диаграммы Р – Т представляют собой фазовые диаграммы однокомпонентных систем, в которых фазовые превращения обусловлены только изменениями температуры и давления.
Р – Т -диаграммы веществ, не испытывающих полиморфных превращений в твердом состоянии, схематически представлены на рис. 3.19, б, в. Фазовые области, соответствующие твердому, жидкому и парообразному состояниям, разделены линиями моновариантных двухфазных равновесий: ОА – кривая сублимации; АС – кривая плавления; АВ – кривая испарения (кипения), вдоль которых реализуются равенства:
G тв = G ж или G ж = G п
или
μ тв = μ п, μ тв = μ ж и μ ж = μ п.

|
| Рисунок 3.19 – Фазовая диаграмма однокомпонентной системы: а – диаграмма, построенная в координатах G – T – P; указаны поверхности изобарно-изотермного потенциала G отдельных фаз линии пересечения двух из этих поверхностей отвечают моновариантному, а точка пересечения трех поверхностей – нонвариантному равновесию фаз; б, в – диаграммы, построенные в координатах Р – Т, при этом плавление твердой фазы сопровождается увеличением (б) и уменьшением (в) удельного объема |
Точка А является нонвариантной и соответствует трехфазному равновесию.
|
|
Задача. Определить число степеней свободы в точке А, рис.3.19.
Диаграммы на рис. 3.19, б, в, различаются наклоном кривой плавления АС. Наклон каждой из двух кривых определяется знаком производной dТ пл/ dP, который в свою очередь определяется знаком изменения удельного объема при фазовом превращении данного типа.
Увеличение давления повышает температуру фазового превращения, если оно сопровождается увеличением удельного объема, и понижает эту температуру, если в процессе фазового превращения удельный объем уменьшается.
Таким образом, при dV / dT > 0 и dT / dP > 0 линия фазового превращения наклонена вправо, а при dV / dT < 0 и dТ / dP < 0 – влево.
Испарение и сублимация всегда сопровождаются увеличением удельного объема, поэтому кривые ОА и АВ всегда наклонены вправо.
Знак изменения удельного объема и, следовательно, плотности при плавлении неоднозначен. Если при плавлении металлов ∆ V всегда положительно (рис. 3.19., б), то при плавлении полупроводников знак изменения ∆ V зависит от того, сопровождается ли переход в жидкое состояние изменением характера химических связей или нет.
При плавлении полупроводников возможны следующие два случая перехода из твердого состояния в жидкое:
1) полупроводник → полупроводник,
2) полупроводник → металл.
В первом случае, характерном для таких веществ, как сера, селен, теллур, соединений Bi2Te3, Cu2S, некоторых соединений типа А II В VI (например CdTe), ∆ V > 0, во втором, характерном для германия и кремния, а также для ряда соединений типа А III В V, наоборот, ∆ V < 0 (рис. 3.20).

|
| Рисунок 3.20. – Изменение плотности при плавлении полупроводниковых веществ: а – теллур (при плавлении сохраняются ковалентные р 2 – связи), б – германий (при плавлении разрушаются ковалентные sр 3 –гибридные связи). |
Уменьшение удельного объема при плавлении полупроводников вызвано тем, что характерная для ковалентных соединений некомпактная упаковка атомов в решетках типа алмаза или сфалерита сменяется более компактной упаковкой с большим координационным числом, характерным для металлических веществ.
Таким образом, высокие давления повышают температуру плавления металлов и понижают ее у некоторых полупроводников.
Р – Т -диаграммы веществ, испытывающих в твердом состоянии полиморфные превращения.
На рис. 3.21, а показана диаграмма Р – Т для SiO2, обладающего в твердом состоянии большим числом полиморфных модификаций (в том числе α-кварц, β-кварц, тридемит, кристобалит).
На рис. 3.21, б, в, г показаны Р – Т -диаграммы германия, кремния, углерода. Использование давлений выше 1010 Па показало, что при таких давлениях решетка типа алмаза с координационным числом К = 4 переходит в решетку с более высоким координационным числом К = 6, а химическая связь вместо ковалентной становится металлической.

|
| Рисунок – 3.21. Р – Т – диаграммы однокомпонентных систем, испытывающих полиморфные превращения: а – SiO2; б – Ge; в – Si; г – С |
В ряде случаев полиморфное превращение, вызванное высоким давлением, может оказаться практически необратимым. Тогда можно, однократно подвергнув вещество высокому давлению, получить его при нормальных условиях в метастабильном состоянии с необычными для этих условий свойствами.
Фазовые диаграммы, построенные в координатах Р – Т – X.
На рис. 3.22, а показана гипотетическая Р – Т – Х -диаграмма двойной системы. Изменение давления может привести к изменению не только температуры фазового превращения, но и самого типа фазовой диаграммы. Так, диаграмма с неограниченной растворимостью в твердом состоянии при высоких температурах и расслоением твердого раствора α на два раствора при низких температурах с увеличением давления постепенно переходит в диаграмму с эвтектикой. Такой переход, по-видимому, должен соответствовать тому случаю, когда исходный объем твердого раствора α будет больше, чем суммарный объем фаз α1 + α2, образованных из того же количества исходного вещества1.
1 Примером может служить твердый раствор углерода в железе с тетрагонально искаженной решеткой - так называемый мартенсит. Распад мартенсита на две фазы – менее концентрированный твердый раствор углерода в железе с о.ц.к. решеткой и карбид железа Fe3C (цементит) - сопровождается уменьшением объема.

|
| Рисунок 3.22. Р – Т – Х – диаграммы систем без образования (а) и с образованием химического соединения GaP (б) (соединение типа А III В V), включающего легко летучий компонент (фосфор) |
На рис. 3.22, б показана фазовая диаграмма Ga–Р, в которой образуется полупроводниковое соединение GaP. В зависимости от давления это соединение может плавиться конгруэнтно или инконгруэнтно. Соответственно изменяется и вид двойной диаграммы Т – X на различных изобарических сечениях тройной Р – Т – Х – диаграммы.
Приведенные примеры показывают, что между диаграммами разных типов нет резких границ и что диаграммы системы из данных компонентов в зависимости от внешних условий могут переходить из одного типа в другой.
Объемные Р – Т – Х – диаграммы, аналогичные показанным на рис. 3.22, строят очень редко. Обычно фазовые превращения в трехмерных Р – Т – Х – диаграммах анализируют с помощью их проекции на плоскости Р – Т, Т – X и Р – X, а также используют различные сечения при постоянных значениях температуры или давления (Р – Х – и Т – Х – сечения).
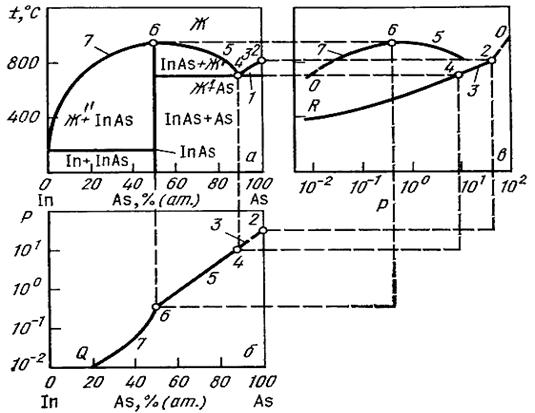
Такие проекции строят в соответствии с законами начертательной геометрии (рис. 3.23 и 3.24). При их анализе следует учитывать, что для системы на рис. 3.23 давление диссоциации мало и Р – внешнее давление, а в системе In–As на рис. 3.24 давление диссоциации мышьяка велико и в этом случае P = p дисAs, где p дисAs – равновесное для данных условий давление диссоциации мышьяка (в общем случае должно рассматриваться p дисAs всех фаз, находящихся в равновесии).
Общие закономерности влияния давления на фазовые состояния таковы:
При высоких давлениях диссоциации стабильна газовая фаза, конденсированные фазы не существуют. Следовательно, при этих давлениях лежит граница, разделяющая области существования газовой и конденсированной фаз.
Двухфазному равновесию отвечают поверхности, ограничивающие соседние однофазные области.

| Рисунок 3.23. – Проекции Р дис– Т – Х – диаграммы двухкомпонентной системы с эвтектическим разрывом растворимости: а – на плоскость Т – X; б – на плоскость Р – X; е – на плоскость Р – Т. Символы на линиях обозначают фазы, равновесные при данных условиях. Точки 1 и 2 соответствуют трехфазному равновесию чистых компонентов А и В | |
| ||
| Рисунок 3.24. – Проекции Р дис– Т – Х -диаграммы системы In–As: а – на плоскость Т – X; б – на плоскость Р – X; в – на плоскость Р – Т. Точки на проекциях соответствуют равновесию между фазами: 2 – Asтв+Asж+Asп; 4 – эвтектика InAs+As; 6 – InAs+ Ж '+ П; 7 – InAs+ Ж ''+ П; Ж ' и Ж " – составы жидкого раствора с избытком (против стехиометрического состава) мышьяка и индия соответственно. | ||
Равновесию трех фаз на Р–Т – проекции соответствуют линии, четырехфазные равновесия проектируются на Р–Т – проекцию как точки, в которых пересекаются линии трехфазного равновесия.
На Р – Т – проекции часто наносят также двухфазные линии и тройные точки чистых компонентов (см. рис. 3.23). Как отмечалось выше, р дис– Т – Х – диаграммы чрезвычайно важны для систем, содержащих полупроводниковые соединения, в состав которых входят легколетучие компоненты, например фосфор и мышьяк в соединениях A III B V. Среди компонентов, входящих в соединения типа А II В VI (CdS, HgTe), большим давлением диссоциации обладают не только анионы серы, селена и теллура, но и некоторые катионы, например катионы ртути и кадмия.
Как уже отмечалось, все полупроводниковые соединения обладают более или менее протяженной областью гомогенности, т. е. способны растворять в себе какой-либо из компонентов сверх стехиометрического состава или «третий» компонент – вакансии.
Любые отклонения от стехиометрического состава резко влияют на электрофизические свойства. Поэтому для стабильного получения кристаллов с заданными свойствами необходимо стабильное получение кристаллов соединений заданного состава. Последняя задача невыполнима, если неизвестна р дис– Т – Х – диаграмма соответствующей системы. Это связано с тем, что летучесть одного из компонентов приводит к образованию вакансий – анионных и катионных (в зависимости от того, давление диссоциации какого компонента будет больше) и соответственно к избытку другого компонента. В ряде соединений вакансии создают акцепторные или донорные уровни, влияя на электрофизические свойства. Количество и положение уровней зависят от химической природы элемента, замененного вакансией, состава соединений и др.
Энергия образования вакансий в позициях А и В никогда не бывает одинаковой, поэтому концентрация анионных и катионных вакансий также различна, а область гомогенности соединения оказывается несимметричной относительно стехиометрического состава. Следовательно, для таких соединений максимум температуры плавления не соответствует сплаву стехиометрического состава, т. е. образуются соединения со смещенной стехиометрией.
Предотвратить изменение состава соединения за счет летучести компонентов можно, если выращивать его из расплава или раствора при внешнем давлении летучего компонента, равном давлению диссоциации при температуре выращивания. Эти условия и выбирают с помощью диаграммы р дис– Т – Х.
Контрольные вопросы и задачи
1. Какие из характеристик металлов и полупроводников определяют вид температурной зависимости удельной электропроводности?
2. Чем вызвана нелинейность зависимости некоторых оптических и акустических свойств (поглощение, рассеяние, дифракция и др.) от интенсивности воздействия излучения?
3. Как влияет тип химических связей в твердых телах на их свойства (механические, электрические, акустические и др.)?
4. Почему вольфрам не ферромагнетик?
5. Почему кремний не используется в качестве конструкционного материала?
6. Кремний и германий образуют непрерывный ряд твердых растворов. Определите коэффициент компактности кристаллической решетки твердого раствора состава Ge0,5Si0,5 и ширину запрещенной зоны твердого раствора.
7. Определите концентрацию валентных электронов и электронов проводимости в монокристалле кремния n-типа при 300К, если известно, что удельное электрическое сопротивление равно 105 Ом*см, а подвижность электронов 1400 см2/(В*с).
8. Определите энергию связи кристалла кремния в килоджоулях на атом.
9. Почему для выращивания совершенных монокристаллов кремния, как и других алмазоподобных фаз, преимущественно используют бесконтейнерные способы кристаллизации, например способ Чохральского?
10. Определите энтропии плавления ΔSпл железа, вольфрама, кремния, германия и теллура и сопоставьте полученные значения с характером изменения химических связей этих веществ при плавлении.
11. Нарисуйте элементарную ячейку твердого раствора, содержащего 50% (ат.) Ge и 50% (ат.) Si. В двух случаях: при наличии ( ) и отсутствии (
) и отсутствии ( ) ближнего порядка.
) ближнего порядка.
12. Постройте Р–Т – проекцию двухкомпонентной фазовой диаграммы системы А–В, в которой образуется одно конгруэнтно плавящееся соединение АВ с двухсторонней областью гомогенности. Соединение АВ и компонент В обладают высоким давлением насыщенного пара. На Р–Т – проекцию нанести линии трехфазных равновесий.
13. Назовите соединения со смещенной стехиометрией среди соединений АIVBVI.
14. Почему нельзя получить соединение SnTe n-типа проводимости без легирования третьим компонентом?
15. Можно ли получить монокристаллы соединений PbS и SiC из расплавов, отвечающих стехиометрическому составу?
16. Почему у соединения GаАs ширина запрещенной зоны меньше, чем у соединения AlSb?
17. Какое из двух соединений GаАs и Gа2Те3 будет более радиационно стойким?
18. В интервале каких атомных масс соединения АIIIВV и АIIВVI будут обладать шириной запрещенной зоны больше 2 эВ.
19. Почему в качестве термоэлектрического материала целесообразно использовать не чистое соединение, а твердый раствор на его основе?
20. В чем различие в поведении при нагреве аморфных и стеклообразных веществ?
21. В чем различие структурных характеристик аморфных веществ с металлическими и ковалентными связями?
22. Подчиняются ли правилу Музера-Пирсона соединения CuInSi2As4 и CuGaGe2As4, кристаллизующиеся в структуру сфалерита?
23. Что общего и чем различаются процессы кристаллизации, перекристаллизации и рекристаллизации?
24. Как и почему различаются работы гомогенного образования зародыша новой фазы в случае превращения в твердом состоянии и в случае кристаллизации из жидкой фазы?
25. Зависит ли давление насыщенного пара в пространстве над частицей (каплей) данного вещества только от ее размера (объема) или от ее формы?
26. Чем объясняется, что микроструктура поликристаллических слитков кремния, германия, меди характеризуется большим количеством двойников, а в микроструктуре алюминия их практически нет?
27. Какие основные типы фаз могут существовать в твердом теле?
28. Равновесное состояние системы. Гетеро – и гомогенные системы.
29. Фаза. Аллотропия (полиморфизм).
30. Типы твердых растворов. Компоненты системы (число компонентов).
31. Термодинамические потенциалы. Возможности диаграмм фазовых равновесий.
32. Фазовые переходы I-го и II-го рода.
33. Условия гетерогенного равновесия фаз.
34. Правило фаз Гиббса.
35. Основные представления при построении фазовых диаграмм двойных систем.
36. Термодинамические функции характеризующие раствор.
37. Изобарно-изотермический потенциал смешения в случае равновесия двух идеальных растворов (жидкого и твердого).
38. Т – Х диаграммы фазовых равновесий двойных систем с неограниченной растворимостью.
39. Применение твердых растворов с неограниченной растворимостью.
40. Построение фазовых диаграмм с неограниченной растворимостью по данным об измерении термодинамического потенциала.
41. Переход от неограниченной к ограниченной растворимости.
42. Т – Х диаграммы фазовых равновесий двухкомпонентных систем с ограниченной растворимостью.
43. Диаграммы фазовых равновесий с эвтектическим превращением.
44. Диаграммы фазовых равновесий с эвтектоидными превращением.
45. Диаграммы фазовых равновесий с перитектическим превращением.
46. Диаграммы фазовых равновесий с перитектоидными превращением.
47. Диаграммы фазовых равновесий с химическими соединениями.
48. Диаграммы фазовых равновесий с эвтектикой с разными химическими связями компонентов.
49. Ликвация.
50. Дендриты.
51. Бертоллиды.
52. Дальтониды.
53. Общие закономерности влияния давления на фазовые состояния.
54. Р – Т диаграммы веществ, испытывающих в твердом состоянии полиморфные превращения.
55. Методы выращивания монокристаллов.
ЛИТЕРАТУРА
1. Глазов В.М., Павлова Л.М. Химическая термодинамика и фазовые превращения. М.: Металлургия, 1981, – 336 с.
2. Товстюк К.Д. Полупроводниковое материаловедение. – Киев, Наукова думка. 1984 – 264 с.
3. Физическое материаловедение под ред. Кана Р. Т 1-3. М. Мир 1967-1968 г
4. Горелик С.С., Дашевский М.Я. Материаловедение полупроводников и металловедение. – М., МИССиС, 2003. – 480 с.
5. Жданов Г.С., Хунджуа А.Г. Лекции по физике твердого тела. Изд-во Московского университета. 1988. – 231 с.
6. Лившиц Б.Г., Краношин В.С., Лиснецкий Я.Л. Физические свойства металлов и сплавов. М.Металлургия, 1980, – 320 с.
7. Харрисон У. Электронная структура и свойства твердых тел. Т. 1,2 М. Мир, 1983 т.1. – 379, т.2. – 332 с.
8. Жуховицкий А.А., Шварцман Л.А. Физическая химия. М.: Металлургиздат, 1963, – 676 с.
9. Материаловедение и технология металлов / Г.П. Фетисов, М.Г. Карпман, В.М. Матюнин и др. – М.:Высш.шк., 2002.
10. В.С.Чередниченко Материаловедение, Москва, Омега-Л. 2006
11. Кабанова Т.А. Электрофизические свойства твердых диэлектрических материалов. – М.: МИЭМ, 1999. – 40 с.
12. Горбачев В.В., Синицина Л.С., Физика полупроводников и металлов. М.: Металлургия, 1982, – 434 с.
13. Киттель Ч. Введение в физику твердого тела. М.Наука, 1978, – 791с.
14. Левин А.А. Введение в квантовую химию твердого тела. М., Химия, 1974, – 237 с.
15. Захаров А.М. Диаграммы состояния двойных и тройных систем. М. металлургия. 1990. – 239 с.
16. Петров Д.А. Двойные и тройные системы. М. Металлургия, 1982, – 168 с.
17. Уманский Я.С., Скаков Ю.А. Физика металлов. – М. Атомиздат. 1978, – 352 с.
18. Таиров Ю.М., Цветков В.Ф. Технология полупроводниковых и диэлектрических материалов. М.ВШ, 1983. – 271 с.
19. Юсфин, Ю.С. Металлургия железа. – М., 2007
20. Лахтин Ю.М., Леонтьева В.П. Материаловедение – М.: Машиностроение, 1990. – 528 с.
21. Сироткин, О.С. Основы инновационного материаловедения. – М., 2011
22. Харрис П. Углеродные нанотрубы и родственные структуры. Новые материалы XXI века. М.: Техносфера, 2003. – 335 с.
23. Рыбалко В.В. Углеродосодержащие наноразмерные материалы. М.: МИЭМ, 2003. – 55 с.
ПРИЛОЖЕНИЕ.
ФАЗОВЫЕ ДИАГРАММЫ НЕКОТОРЫХ ПОЛУПРОВОДНИКОВЫХ СИСТЕМ


Рис. 1. Рис. 2.
Фазовая диаграмма системы Фазовая диаграмма системы
Ag – Fu Ag –Cu


Рис. 3. Рис. 4.
Фазовая диаграмма системыCu – Au Фазовая диаграмма системы
Cu – Fu Al –Si


Рис. 5. Рис. 6.
Фазовая диаграмма системы Фазовая диаграмма системы
Nl – O Al – Se


Рис. 7. Рис. 8.
Фазовая диаграмма системы Фазовая диаграмма системы
Ru – C Ag – Cr
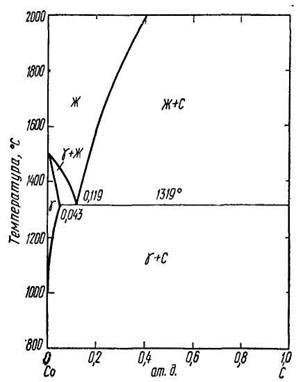

Рис. 9. Рис. 10.
Фазовая диаграмма системы Фазовая диаграмма системы
Co – C Zn – Cr

 Рис. 11. Рис. 12.
Рис. 11. Рис. 12.
Фазовая диаграмма системы Фазовая диаграмма системы
Al – Sc Zn– Cr

 Рис. 13. Рис. 14.
Рис. 13. Рис. 14.
Фазовая диаграмма системы Фазовая диаграмма системы
Zn– Cr B – C

 Рис. 15. Рис. 16.
Рис. 15. Рис. 16.
Фазовая диаграмма системы Фазовая диаграмма системы
Cu– Sc Ag – Ca

 Рис. 17. Рис. 18.
Рис. 17. Рис. 18.
Фазовая диаграмма системы Фазовая диаграмма системы
Cr– C Hf – C


Рис. 19. Рис. 20.
Фазовая диаграмма системы Фазовая диаграмма системы
Zr– Cr Cu – As


Рис. 21. Рис. 22.
Фазовая диаграмма системы Фазовая диаграмма системы
Fe– Ge Fe – As

 Рис. 23. Рис. 24.
Рис. 23. Рис. 24.
Фазовая диаграмма системы Фазовая диаграмма системы
Ni– Au Ni – As

 Рис. 25. Рис. 26.
Рис. 25. Рис. 26.
Фазовая диаграмма системы Фазовая диаграмма системы Fe– Se Cu – Nb 
 Рис. 27. Рис. 28.
Рис. 27. Рис. 28.
Фазовая диаграмма системы Фазовая диаграмма системы Ni– Sc Cu – Se
|
|
|

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!