

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
Топ:
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Дисциплины:
|
из
5.00
|
Заказать работу |
Запишем уравнение состояния для i -го компонента газовой смеси, если он занимает весь ее объем и находится там при температуре смеси. Тогда его давление равно парциальному:
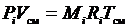 . (3.14)
. (3.14)
Просуммируем полученные зависимости для всех компонентов, входящих в смесь
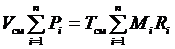 .
.
Вспоминая, что 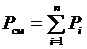 и, вводя обозначение
и, вводя обозначение 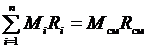 ,
,
получим уравнение состояния газовой смеси:
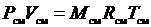 , (3.15)
, (3.15)
где R см – газовая постоянная смеси. Ее величина может быть рассчитана из соотношения
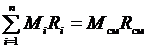 .
.
Поделив его на массу смеси М, получим соотношение:
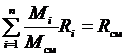 , но
, но 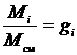 ,
,
тогда 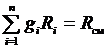 . (3.16)
. (3.16)
Введение понятия о кажущейся молекулярной массе смеси упрощает расчеты газовых смесей:
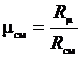 . (3.17)
. (3.17)
Или после подстановки выражения (3.17) для 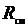 получим с учетом равенства
получим с учетом равенства 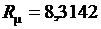 Дж/(моль∙К)
Дж/(моль∙К)
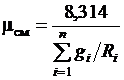 . (3.18)
. (3.18)
Запишем уравнение состояния для массы газа mi:
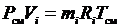 или, с учетом
или, с учетом 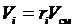 ;
;
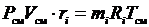 .
.
Последнее выражение преобразуем к виду
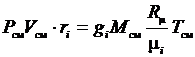 .
.
Если записать выражения для каждого компонента смеси, а затем просуммировать, получим
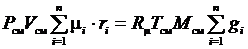 ;
; 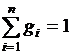 ,
,
тогда 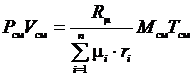 .
.
Таким образом 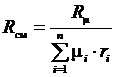 , а
, а 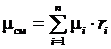 . (3.19)
. (3.19)
Получим расчетные зависимости для 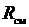 и
и 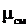 , если смесь задана массовыми долями
, если смесь задана массовыми долями 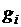 . Запишем уравнение состояния для М кг газовой смеси и для
. Запишем уравнение состояния для М кг газовой смеси и для 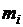 кг компонентов газов, входящих в смесь, через их парциальные объемы:
кг компонентов газов, входящих в смесь, через их парциальные объемы:
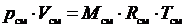 ;
;  .
.
Если записать второе выражение для каждого компонента, а затем их просуммировать, то получим
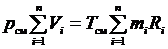 .
.
Перепишем его в виде 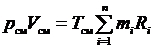 .
.
Поделив последнюю зависимость на уравнение состояния смеси для М кг, получим зависимость для расчета R см и mсм через массовый состав:
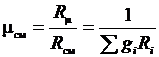 ;
; 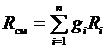 . (3.20)
. (3.20)
Последние выражения позволяют по объемным долям и молекулярным массам компонентов рассчитать газовую постоянную смеси и среднюю молекулярную массу.
Зная соотношения между массовыми и объемными долями газов, можно рассчитать парциальные давления
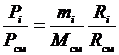 ;
; 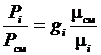 или
или 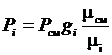 . (3.21)
. (3.21)
Запишем закон Бойля-Мариотта для i -го компонента и всей смеси
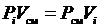 ,
,
откуда 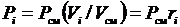 ,
,
тогда 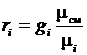 или
или 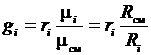 . (3.22)
. (3.22)
Приравнивая зависимости (3.21) и (3.22), получим формулы перевода массовых долей в объемные и наоборот:
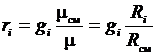 ;
; 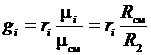 . (3.23)
. (3.23)
Плотность газовой смеси:
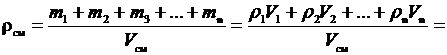
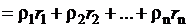 ,
,
таким образом, 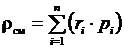 . (3.24)
. (3.24)
Выразим 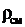 через массовый состав смеси:
через массовый состав смеси:
 ,
,
следовательно,  .
.
Теплоемкость смеси газов
Пусть известны ci – зависимость массовых теплоемкостей компонентов от температуры
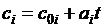 .
.
Для одного килограмма газовой смеси массовая теплоемкость может быть рассчитана по формуле
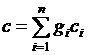 . (3.25)
. (3.25)
Или с учетом зависимости теплоемкостей от температуры
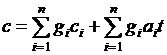 .
.
Если задан объемный состав, то удобней пользоваться объемными теплоемкостями:
для 1 м3 компоненты: 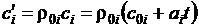 ,
,
для 1 м3 смеси: 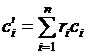 . (1.26)
. (1.26)
Или с учетом зависимости от температуры:
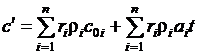 . (1.27)
. (1.27)
Энтропия газовой смеси
Воспользовавшись объединенным выражением первого и второго начал термодинамики, запишем
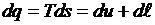
или
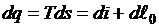 .
.
Распишем выражения, входящие в правые части
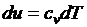 ;
; 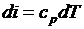 ;
; 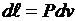 ;
; 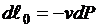 .
.
Тогда после подстановки получим
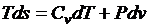 ;
; 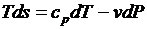 .
.
Предполагая газ совершенным, а, следовательно, подчиняющимся уравнению состояния в форме Клапейрона-Менделеева, преобразуем, правые части к виду удобному для интегрирования (исключим лишнюю переменную)
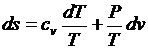 ;
; 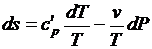 .
.
Запишем уравнение состояния и выразим из него давление и удельный объем
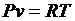 ;
; 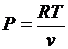 ;
;  или
или 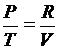 ;
; 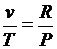 .
.
После подстановки в (3.26) и (3.27)
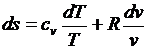 ;
; 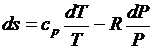 .
.
Проинтегрируем (3.26) и (3.27) от состояния 1 до состояния 2:
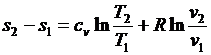 ; (3.28)
; (3.28)
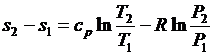 . (3.29)
. (3.29)
Если в качестве независимых переменных будут выбраны 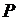 и
и 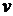 , то выражение для расчета изменения энтропии в политропных процессах может быть преобразовано к виду
, то выражение для расчета изменения энтропии в политропных процессах может быть преобразовано к виду
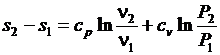 . (3.30)
. (3.30)
Известно, что энтропия является аддитивной функцией состояния, а, следовательно, для системы, состоящей из «n» частей, должны вычисляться соотношения
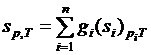 . (3.31)
. (3.31)
С другой стороны энтропия может быть рассчитана по зависимости, в которой в явной форме аддитивность не отражена
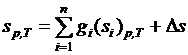 . (3.32)
. (3.32)
По своей сути выражения (3.32) и (3.31) эквивалентны.
Энтропия смеси идеальных газов представляет собой сумму энтропий газов, входящих в смесь
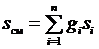 . (3.33)
. (3.33)
Для газа с параметрами  и
и  следует, что его энтропия в соответствии с (1.29) равна
следует, что его энтропия в соответствии с (1.29) равна
 , (3.34)
, (3.34)
где 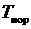 – температура нормировки;
– температура нормировки; 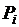 – парциальное давление;
– парциальное давление; 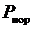 – давление нормировки.
– давление нормировки.
Парциальное давление компонента в смеси можно определить по ранее приведенной зависимости
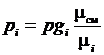 .
.
Тогда второе слагаемое правой части выражения (3.34) может быть сведено к виду
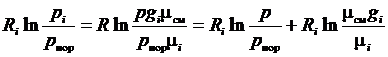 .
.
Следовательно, выражение для энтропии газовой смеси (3.33), представленное в виде аналогичном (1.31), можно переписать
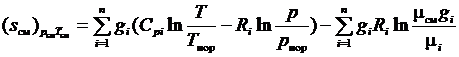 . (3.35)
. (3.35)
Выражение, стоящее в скобках в правой части (3.35), представляет собой энтропию 1 кг компонента при параметрах смеси, которую можно обозначить, как 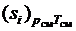 , а последнюю сумму можно определить как приращение энтропии в процессе необратимого смешения идеальных газов, входящих в смесь. Так как по смыслу величина
, а последнюю сумму можно определить как приращение энтропии в процессе необратимого смешения идеальных газов, входящих в смесь. Так как по смыслу величина 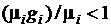 , то выражение (1.35) может быть переписано в виде
, то выражение (1.35) может быть переписано в виде
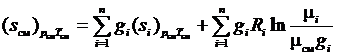 . (3.36)
. (3.36)
Учитывая формулу соотношения массовых и объемных долей 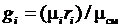 , перепишем (3.36)
, перепишем (3.36)
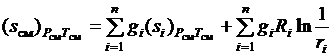 . (3.37)
. (3.37)
Из (3.37) следует, что смешение различных газов при 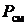 ,
, 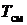 приводит к возрастанию энтропии на величину энтропии смешения
приводит к возрастанию энтропии на величину энтропии смешения
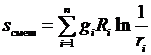 (3.38)
(3.38)
или для отдельно взятого i -го компонента
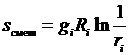 . (3.39)
. (3.39)
Выражение (3.32) учитывает возрастание энтропии i -го компонента за счет необратимости процесса смешения.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Основные принципы Второго закона термодинамики, сформулированные в курсе общей физики, отражают связь энтропии со статистическим весом и вероятностью состояния. Показано, что отношение бесконечно малого количества теплоты к абсолютной температуре приводит к появлению нового параметра состояния 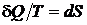 – энтропии, дифференциал которой для термодинамических процессов подчиняется неравенству
– энтропии, дифференциал которой для термодинамических процессов подчиняется неравенству  , где
, где  лишь для обратимых процессов (циклов), а
лишь для обратимых процессов (циклов), а 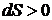 для необратимых. Очевидно, что если энтропия S является параметром состояния, то для обратимых процессов должно выполнятся условие
для необратимых. Очевидно, что если энтропия S является параметром состояния, то для обратимых процессов должно выполнятся условие 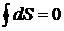 . Для произвольных циклов как обратимых, так и необратимых
. Для произвольных циклов как обратимых, так и необратимых
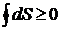 . (4.1)
. (4.1)

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!