Теории теплоемкости
Основной предпосылкой кинетической теории газов является установленный Максвеллом и Больцманом закон о равномерном распределении энергии по степеням свободы поступательного и вращательного движений молекул газа. Из молекулярно-кинетической теории известно, что у одноатомного газа молекула имеет i = 3 степени свободы поступательного движения, у двухатомной молекулы газа к трем степеням свободы поступательного движения добавляются еще две степени свободы вращательного движения и их общее число равно 5. У трехатомных молекул и многоатомных вращательных степеней свободы 6. Для идеального газа (совершенного газа – газа подчиняющегося уравнению Клапейрона-Менделеева) внутренняя энергия однозначно определяется температурой и рассчитывается по зависимости, полученной из анализа основного уравнения молекулярно-кинетической теории. Запишем выражение для расчета внутренней энергии одного моля идеального газа:
 . (2.53)
. (2.53)
где  = 8,3142 [Дж/моль×К] – универсальная газовая постоянная; i – число степеней свободы. Тогда после постановки численного значения универсальной газовой постоянной для идеального газа получим
= 8,3142 [Дж/моль×К] – универсальная газовая постоянная; i – число степеней свободы. Тогда после постановки численного значения универсальной газовой постоянной для идеального газа получим
 .
.
Продифференцируем внутреннюю энергию по температуре при постоянном объеме, считая, что 
 ;
;  Дж/моль×К.
Дж/моль×К.
Очевидно, что на каждую степень свободы молекулы приходится одна треть от рассчитанной выше
 Дж/моль×К.
Дж/моль×К.
Теперь можно рассчитать теплоемкости двухатомных, трех и многоатомных газов, считая их совершенными, т. е. подчиняющимися уравнению Клапейрона-Менделеева.
Для двухатомного газа 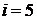 , а
, а 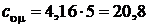 Дж/(моль×К);
Дж/(моль×К);
Для трехатомного газа  , а
, а 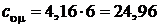 Дж/(моль×К);
Дж/(моль×К);
Однако при сравнительно высоких температурах экспериментально полученные значения теплоемкостей заметно отличаются от рассчитанных на основе положений МКТ. Это связано с тем, что в приведенной модели не учитывалась энергия, приходящаяся на степени свободы внутримолекулярного и внутриатомного движений, а также энергия, связанная с взаимодействием молекул, зависящая от изменения объема при изменении температуры. Попытка учета этих составляющих связана с тем, что атомы в молекуле не всегда жестко связаны друг с другом и могут совершать колебания друг относительно друга. Тогда для определения конфигурации молекулы требуется ввести еще одну координату. Это координата – расстояние между молекулами. Таким образом двухатомная молекула будет обладать 6-ю степенями свободы: 3 – поступательные, 2 – вращательные и 1 – колебательная степень свободы.
Если молекула состоит из n атомов, нежестко связанных между собой, то она имеет 3 n степени свободы, из которых 3 – поступательные, 3 – вращательные, а остальные колебательные. Таким образом, нелинейная молекула из n атомов имеет 3 n – 6 колебательных степеней свободы, а у линейных 3 n – 5.
Колебательные степени свободы возбуждаются при высоких температурах. При достаточно малых амплитудах колебания атомов можно считать гармоническими осцилляторами.
Для гармонического осциллятора средние значения потенциальной и кинетической энергии равны между собой. Если в молекуле возбуждаются гармонические колебания, то по закону равнораспределения на каждую колебательную степень свободы приходится  в виде кинетической и
в виде кинетической и  в виде потенциальной энергии. Тогда формула для подсчета числа степеней свободы будет иметь вид
в виде потенциальной энергии. Тогда формула для подсчета числа степеней свободы будет иметь вид
 (2.45)
(2.45)
Эйнштейн, воспользовавшись квантовой теорией Планка, получил следующее выражение для мольной теплоемкости, достаточно точное для температур, применяемых в теплотехнике.
 , (2.46)
, (2.46)
где  – число степеней свободы поступательного движения и вращательного;
– число степеней свободы поступательного движения и вращательного;
 – число степеней свободы внутримолекулярных колебаний;
– число степеней свободы внутримолекулярных колебаний;
 – характеристическая температура колебательного движения,
– характеристическая температура колебательного движения, 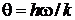
( – постоянная Планка);
– постоянная Планка);
 – постоянная Больцмана;
– постоянная Больцмана;
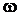 – частота колебаний в секунду;
– частота колебаний в секунду;
е – основание натуральных логарифмов;
Т – температура.
В приведенной выше формуле первый член учитывает количество теплоты, расходуемое на увеличение поступательного и вращательного движения молекул и определяется числом степеней свободы этих движений. Второй член учитывается количество теплоты, расходуемое на увеличение внутримолекулярных колебаний.
ГАЗОВЫЕ СМЕСИ
Практически во всех сферах деятельности мы сталкиваемся не с веществами в чистом виде, а с их химическими соединениями, либо с механически перемешенными веществами или растворами. К примеру, рабочие тела почти всех тепловых машин представляют собой некоторую газовую смесь. Не составляет исключение и воздух, которым мы дышим и используем в большинстве случаев как окислитель в камерах сгорания двигателей, топках различных топливосжигающих устройств. Как известно, воздух состоит из 78,08 % азота N2, 20,95 % кислорода О2, и где-то около 1 % составляют примеси других газов. С экологической точки зрения хотелось бы, чтобы процент примесей не возрастал в результате не всегда разумного вмешательства человечества в естественные массообменные процессы природы.
При термодинамических расчетах рабочих процессов тепловых машин мы сталкиваемся с необходимостью определения термодинамических параметров рабочих тел, в подавляющем большинстве случаев представляющих собой газовую смесь продуктов сгорания углеводородных топлив, что требует умения и навыков расчета газовых смесей. Следовательно, должны быть разработаны методы их расчета и способы задания газовых смесей.
3.1 Способы задания газовой смеси
Под смесью идеальных газов понимается механическая смесь химически обособленных исходных газов, подчиняющихся уравнению состояния идеального газа. Тогда будем считать, что и смесь представляет из себя некоторый самостоятельный идеальный газ, термодинамические свойства которого определяются количественным соотношением входящих в него исходных компонентов, т. е. свойства газовой смеси однозначно определяются ее составом.
Состав газовой смеси определяется количественным соотношением входящих в него компонентов и может быть задан массовыми, объемными или мольными долями.
Пусть М см – масса газовой смеси, а тi – масса i -го компонента, входящего в смесь. Согласно закону сохранения массы будем иметь очевидное равенство:
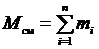 , (3.1)
, (3.1)
где n – число компонентов смеси.
Под массовой долей i -го компонента будем понимать отношение:
 или в процентах
или в процентах  %. (3.2)
%. (3.2)
На основании закона сохранения вещества, запишем уравнение баланса массы:
 . (3.3)
. (3.3)
Если массовые доли заданы в процентах, то
 %. (3.4)
%. (3.4)
Объемные доли представляют собой отношение парциальных объемов компонентов к объему газовой смеси:
 , (3.5)
, (3.5)
где Vi – парциальный объем i -го компонента; V см – объем газовой смеси.
Под парциальным объемом будем понимать тот объем, которым бы обладал i-й компонент, находясь при температуре  и давлении
и давлении 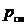 газовой смеси.
газовой смеси.
Нетрудно показать, что парциальные объемы газов прямо пропорциональны их парциальным давлениям. Парциальным называется давление, которое создавал бы i -й газ смеси, если бы он один занимал весь объем смеси, находясь в нем при температуре смеси. Запишем уравнение Бойля-Мариотта для компонента смеси:
 , т. е. (3.6)
, т. е. (3.6)
 ,
, 
или
 ,
, 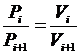 ,
,
где Pi – парциальное давление i -го компонента; Vi – парциальный объем
i -го компонента.
Сложим почленно левые и правые части закона Бойля-Мариотта для компонентов:
 или
или  .
.
Согласно закону Дальтона
 , (3.7)
, (3.7)
тогда  . (3.8)
. (3.8)
Объем газовой смеси равен сумме парциальных объемов компонентов, входящих в смесь. Это утверждение равносильно равенству
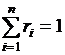 или
или  %. (3.9)
%. (3.9)
Состав газовой смеси может быть задан и числом молей, входящих в нее компонентов
 (3.10)
(3.10)
где  – число молей смеси;
– число молей смеси;  – число молей i -го компонента.
– число молей i -го компонента.
Тогда под мольной долей будем понимать отношение
 (3.11)
(3.11)
и, согласно закону сохранения количества вещества, будем иметь равенство
 или
или  %. (3.12)
%. (3.12)
Воспользуемся следствием из закона Авогадро: одинаковые количества различных идеальных газов, находящихся при одинаковых давлениях и температуре, занимают одинаковые объемы.
Запишем  , но
, но  ,
,
тогда  , (3.13)
, (3.13)
т. е. объемные и мольные доли компонентов смеси равны между собой.



 . (2.53)
. (2.53) = 8,3142 [Дж/моль×К] – универсальная газовая постоянная; i – число степеней свободы. Тогда после постановки численного значения универсальной газовой постоянной для идеального газа получим
= 8,3142 [Дж/моль×К] – универсальная газовая постоянная; i – число степеней свободы. Тогда после постановки численного значения универсальной газовой постоянной для идеального газа получим .
.
 ;
;  Дж/моль×К.
Дж/моль×К. Дж/моль×К.
Дж/моль×К.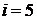 , а
, а 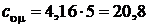 Дж/(моль×К);
Дж/(моль×К); , а
, а 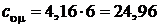 Дж/(моль×К);
Дж/(моль×К); в виде кинетической и
в виде кинетической и  (2.45)
(2.45) , (2.46)
, (2.46) – число степеней свободы поступательного движения и вращательного;
– число степеней свободы поступательного движения и вращательного; – число степеней свободы внутримолекулярных колебаний;
– число степеней свободы внутримолекулярных колебаний; – характеристическая температура колебательного движения,
– характеристическая температура колебательного движения, 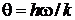
 – постоянная Планка);
– постоянная Планка); – постоянная Больцмана;
– постоянная Больцмана;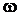 – частота колебаний в секунду;
– частота колебаний в секунду;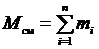 , (3.1)
, (3.1) или в процентах
или в процентах  %. (3.2)
%. (3.2) . (3.3)
. (3.3) %. (3.4)
%. (3.4) , (3.5)
, (3.5) и давлении
и давлении 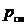 газовой смеси.
газовой смеси. , т. е. (3.6)
, т. е. (3.6) ,
, 
 ,
, 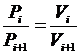 ,
, или
или  .
. , (3.7)
, (3.7) . (3.8)
. (3.8)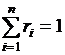 или
или  %. (3.9)
%. (3.9) (3.10)
(3.10) – число молей смеси;
– число молей смеси;  – число молей i -го компонента.
– число молей i -го компонента. (3.11)
(3.11) или
или  %. (3.12)
%. (3.12) , но
, но  ,
, , (3.13)
, (3.13)


