

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
а) для закрытой системы
В соответствии с определением первого начала энергия, подведенная к системе, расходуется на изменение внутренней энергии и на совершение работы.
Если система не поточная, закрытая, то энергию можно подвести лишь в форме тепла и работы. При этом работа связана лишь с изменением объема. Тогда математическая запись первого начала примет вид:
 . (2.21)
. (2.21)
 – подведенное элементарное тепло,
– подведенное элементарное тепло,
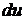 – изменение внутренней энергии,
– изменение внутренней энергии,
 – элементарная работа расширения.
– элементарная работа расширения.
 >0 – тепло подводится с системе;
>0 – тепло подводится с системе;
 <0 – тепло отводится от системы;
<0 – тепло отводится от системы;
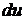 >0 – внутренняя энергия и температура растут;
>0 – внутренняя энергия и температура растут;
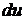 <0 – внутренняя энергия и температура падают;
<0 – внутренняя энергия и температура падают;
 >0 – работа совершается системой;
>0 – работа совершается системой;
 <0 – работа совершается над системой.
<0 – работа совершается над системой.
б) для поточной системы
Рассмотрим течение жидкости или газа в канале произвольной формы (рисунок 2.5).
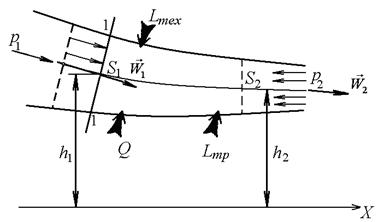 Рисунок 2.5
К выводу уравнения
Первого начала термодинамики для
поточной системы
Рисунок 2.5
К выводу уравнения
Первого начала термодинамики для
поточной системы
|
Поскольку потери массы через стенки канала (трубки тока) невозможны, выполняется уравнение сохранения расхода  .
.
На На выходе эта энергия составит  , G – массовый расход вещества через канал.
, G – массовый расход вещества через канал.
Изменение кинетической энергии по длине выделенного участка составит
 .
.
Запишем уравнение первого начала термодинамики
 .
.
Индексы относятся к выделенным сечениям.
Определим работу потока.
Для того, чтобы через сечение 1 ввести в канал в единицу времени массу G, нужно совершить некоторую работу на то, чтобы вытолкнуть предшествующую порцию. При этом работа совершается окружающей средой над системой и, следовательно, в соответствии с принятым правилом знаков она отрицательна
 ,
,
где р 1 – давление в сечении 1; S 1 – площадь этого сечения; D X 1 – перемещение G массы газа.
Но  , очевидно, что
, очевидно, что 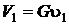 . Работа совершается против системы, тогда
. Работа совершается против системы, тогда  .
.
Рассуждая аналогично, получим:  – работа совершается потоком.
– работа совершается потоком.
Таким образом, на протекании G количества газа в единицу времени между сечением 1-2 совершается работа, равная алгебраической сумме вышеприведенных работ, которую в термодинамике принято называть работой проталкивания
 , [Дж]
, [Дж]
Работа проталкивания pu – это такая работа, которую нужно совершить, чтобы систему объемом u поместить в среду давлением р.
Элементарная работа проталкивания
 .
.
Первое слагаемое  связано с работой затраченной на изменение объема.
связано с работой затраченной на изменение объема.
Вторая составляющая работы потока пошла на приращение кинетической энергии
 .
.
Третья составляющая работы затрачивается на приращение потенциальной энергии струи, связанное с изменением положения центра масс поперечного сечения струйки потока относительно нулевого уровня потенциальной энергии
 .
.
Четвертая составляющая – техническая работа  (турбина, компрессор и т. д.).
(турбина, компрессор и т. д.).
Пятая составляющая – работа по преодолению диссипативных сил – трение, турбулизация потока и т. д. ( ,
,  ).
).
Тогда работа, которая может совершаться движущимся потоком в общем случае, может быть записана в виде
 .(2.22)
.(2.22)
Воспользуемся уравнением первого закона термодинамики для потока вещества
 (2.23)
(2.23)
Или в дифференциальной форме для единицы расхода через канал после деления на расход G
 , (2.24)
, (2.24)
или через энтальпию 
 . (2.25)
. (2.25)
В конечных величинах для 1 кг вещества в потоке уравнение первого начала имеет вид:
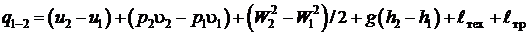 , (2.26)
, (2.26)
 , (2.27)
, (2.27)
где i – удельная энтальпия – тепловая функция  , Дж/кг.
, Дж/кг.
Величина q – полное тепло, подведенное к потоку, она равна сумме тепла, подведенного через границы системы за счет теплообмена  и внутреннего –
и внутреннего – 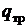 , обусловленного действием диссипативных сил (трение, турбулентность и т. д.).
, обусловленного действием диссипативных сил (трение, турбулентность и т. д.).
 .
.
Тогда  .
.
В связи с очевидным равенством
 ,
,
последнее выражение может быть переписано в виде
 . (2.28)
. (2.28)
Итак, мы получим уравнение первого начала термодинамики для любой системы и для потока вещества через систему
 .
.
На основании идентичности уравнений приравняем их правые части с учетом того, что

После сокращений, получим

Тогда для любого потока вещества справедливо равенство
 (2.29)
(2.29)
Для случая, когда  ;
;  ;
; 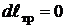 получим
получим
 . (2.30)
. (2.30)
Изменение кинетической энергии системы численно равно величине технической работы, совершаемой системой или над ней.
Энтальпия
Под энтальпией понимается тепловая функция представляющая собой полную энергию системы, состоящую из внутренней энергии u и работы затраченной на проталкивание  .
.
 . (2.31)
. (2.31)
Энтальпия включает в себя все слагаемые, являющиеся параметрами состояния, поэтому ее дифференциал будет полным, а циркуляция от него по замкнутому контуру равна нулю.
 .
.



 (2.32)
(2.32)


Энтальпия подчиняется закону аддитивности по сути своей являясь экстенсивным параметром 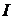 ,[Дж]. Чаще всего в расчетах используют удельную энтальпию i, [Дж/кг]
,[Дж]. Чаще всего в расчетах используют удельную энтальпию i, [Дж/кг]
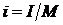 , [Дж/кг], (2.33)
, [Дж/кг], (2.33)
где М – масса вещества в системе.
Уравнение первого начала термодинамики может быть записано через энтальпию и располагаемую работу. Запишем выражение для полного дифференциала энтальпии
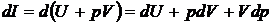 .
.
Первое начало термодинамики имеет вид
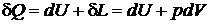
Из выражения для дифференциала энтальпии выразим сумму 
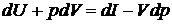
Тогда после подстановки получим
 (2.34)
(2.34)
или для 1 кг вещества в системе
 (2.35)
(2.35)
Подведенная теплота расходуется на изменение энтальпии системы и на совершение располагаемой (технической) работы.
Теплоемкость газов
Одним из проявлений взаимодействия термодинамической системы с окружающей средой является изменение температуры термодинамической системы (исключение – изотермический процесс). Обмен теплом между системой и средой оценивается экстенсивным параметром состояния – теплоемкостью, истоки которого идут еще от теплорода.
Под теплоемкостью понимают количество теплоты, которое необходимо подвести (отвести) к термодинамической системе по какому-либо процессу с тем, чтобы изменить ее температуру на 1 Кельвин.
Теплоемкость конкретного вещества зависит от его физических свойств, агрегатного состояния в котором оно находится, от температуры и в некоторой степени от давления.
В газообразном состоянии основное влияние на теплоемкость веществ оказывает температура. В этом случае разумно ввести в рассмотрение среднюю и истинную теплоемкости, понимая под последней теплоемкость при данной конкретной температуре.
Под средней теплоемкостью в интервале температур 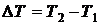 понимается отношение:
понимается отношение:
 , [Дж/К] (2.36)
, [Дж/К] (2.36)
где  – количество теплоты, полученное телом в процессе изменения ее температуры на величину
– количество теплоты, полученное телом в процессе изменения ее температуры на величину 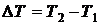 . Индекс “ x ” указывает на характер процесса подвода теплоты.
. Индекс “ x ” указывает на характер процесса подвода теплоты.
Под истиной теплоемкостью будем понимать предел отношения
 ;
;  , [Дж/К] (2.37)
, [Дж/К] (2.37)
Теплоемкость системы является экстенсивным параметром. Интенсивные свойства отражают удельные теплоемкости, т. е. теплоемкости отнесенные к единице измерения количества вещества.
Массовая теплоемкость:
 . [Дж/кг×К] (2.38)
. [Дж/кг×К] (2.38)
Объемная теплоемкость
 . [Дж/м3×К] (2.39)
. [Дж/м3×К] (2.39)
Мольная теплоемкость
 . [Дж/моль×К] (2.40)
. [Дж/моль×К] (2.40)
Между объемной и мольной теплоемкостями существует, очевидная взаимосвязь:
 . [Дж/м3×К] (2.41)
. [Дж/м3×К] (2.41)
Аналогично можно записать зависимость, связывающую объемную и удельную (массовую) теплоемкости
 или
или 
Таким образом, справедливы соотношения:
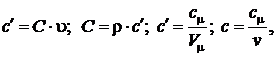
где  – количество вещества (число молей)
– количество вещества (число молей)  .
.
Мольная теплоемкость удобна при использовании, т. к. она зависит от особенностей структуры отдельных молекул. Введение ее дает возможность сравнить теплоемкости разных газов, ибо в 1 моле любого вещества при нормальных условиях содержится одно и тоже число молекул: 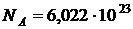 .
.
Теплота Q – есть функция процесса, а число всевозможных процессов бесчисленно велико, следовательно, и теплоемкость тела может изменяться неограниченно от  до
до 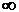 .
.
Наиболее часто используются изохорная  и изобарная
и изобарная  теплоемкости. Причем изобарная теплоемкость всегда больше изохорной ср > с u на величину тепла, затраченного на совершение работы расширения в изобарном процессе при изменении температуры на 1 К. Рассмотрим систему, содержащую 1 кг вещества.
теплоемкости. Причем изобарная теплоемкость всегда больше изохорной ср > с u на величину тепла, затраченного на совершение работы расширения в изобарном процессе при изменении температуры на 1 К. Рассмотрим систему, содержащую 1 кг вещества.
В соответствии с первым началом термодинамики для изохорного процесса  ,
,  , следовательно
, следовательно

или иначе 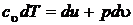 , т. к.
, т. к.  , то
, то  и
и
 или
или  . (2.42)
. (2.42)
Для изобарного процесса, используя параметр состояния энтальпии, можно также записать  ,
, 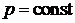 ,
,  , следовательно,
, следовательно, 
 ,
,  . (2.43)
. (2.43)
Уравнение Майера
Найдем зависимость между изобарной и изохорной теплоемкостями.
Воспользуемся первым началом термодинамики
 .
.
Для параметра состояния u, считая независимыми переменными u и T, можно записать выражение полного дифференциала в виде
 . (2.44)
. (2.44)
Подставим du в первое начало термодинамики
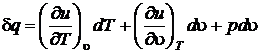 или
или
 или
или
с учетом того, что  , получим
, получим  .
.
Предполагая процесс подвода тепла изобарным, после деления на dT получим
 ;
;  .
.
Величину  принято называть теплотой расширения – количество теплоты необходимое для изотермического увеличения объема тела на единицу объема.
принято называть теплотой расширения – количество теплоты необходимое для изотермического увеличения объема тела на единицу объема.
Тогда  . (2.45)
. (2.45)
Для твердых и жидких фаз, слабо расширяющихся при нагревании, теплота расширения Н невелика. Мало и изменение объема  .
.
В этом случае  практически не отличается от
практически не отличается от 
 .
.
Для идеальных газов  . В этом случае уравнение первого начала сводится к виду
. В этом случае уравнение первого начала сводится к виду
 .
.
Если процесс изобарный 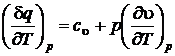 .
.
Продифференцируем уравнение состояния идеального газа при 
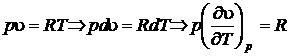 ,
,
тогда после подстановки, получим
 ,
,  . (2.46)
. (2.46)
где  – универсальная газовая постоянная, Дж/моль×К;
– универсальная газовая постоянная, Дж/моль×К; 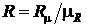 – индивидуальная газовая постоянная, Дж/кг×К. Индивидуальная газовая постоянная
– индивидуальная газовая постоянная, Дж/кг×К. Индивидуальная газовая постоянная  практически всегда используется в технических расчетах и в какой то степени она характеризует свойства конкретного газа.
практически всегда используется в технических расчетах и в какой то степени она характеризует свойства конкретного газа.

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!