СПОСОБЫ УПРАВЛЕНИЯ ХИМИЧЕСКИМ ПРОЦЕССОМ
Рассмотрим возможности воздействия на равновесие:
- Температура;
- Давление;
- Разбавление реакционной смеси;
- Избыток одного из компонентов;
- Удаление продукта из реакционной смеси.
1. Температура. Повышение температуры связано с подводом дополнительного тепла. Химически реагирующая система будет противодействовать этому – поглощать тепло. В эндотермической реакции превращение и, следовательно, поглощение тепла увеличиться, т.е. равновесная степень превращения увеличится. В экзотермической реакции произойдет уменьшение выделения тепла вследствие уменьшения превращения, т.е. равновесная степень превращения уменьшится. Такое изменение x р(Т) показано на рис. 3.3. Из этого и следует способ увеличения x р: увеличение температуры для эндотермической реакции и уменьшение - для экзотермической.
2. Давление. В соответствие с принципом Ле-Шателье увеличению давления P должно противодействовать смещение равновесия, приводящее к уменьшению P, т.е. к уменьшению объема реакционной смеси. Если реакция протекает с уменьшением объема, то увеличение P приведет к большему превращению (увеличению x р). И наоборот - в системе, где реакция протекает с увеличением объема, равновесие сдвинется в сторону уменьшения x р.
Такой же вывод получим из анализа уравнения равновесия. Используя связь pi = PСi и уравнение для газо-фазных реакций, преобразуем последнее к виду

где nD = (nR + nS +...) - (nA + nB +...) - изменение числа молей в реакции.
Если реакция протекает с увеличением объема (nD > 0), то увеличение Р (и также Р nD) приведет к уменьшению концентраций продуктов R и S, т.е. к уменьшению степени превращения.
Если nD < 0, то увеличение Р (уменьшение Р nD) компенсируется ростом концентраций продуктов и степени превращения
Синтез аммиака (N2 + 3H2 = 2NH3) протекает с уменьшением объема. Исходная смесь - стехиометрическая с отношением Н2: N2 = 3:1, которое сохраняется в течение реакции. Обозначим С р - равновесная концентрация NH3. Тогда равновесные концентрации N2 и Н2 соответственно равны 0,75(1 - С р) и 0,25(1 - С р). Уравнение равновесия:
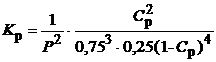
При давлении Р = 0,1 МПа образуется менее 1% аммиака. С увеличением давления Р равновесная концентрация аммиака С р также увеличивается - рис. 3.4.

Для реакций в жидких и конденсированных средах (жидких и твердых) давление практически не сказывается на равновесном составе.
3. Разбавление реакционной смеси - добавление инертного вещества - равнозначно уменьшению давления. Покажем на примере реакции дегидрирования бутана до бутилена С4Н10 = С4Н8 + Н2, протекающей с увеличением объема реакционной смеси. Начальное содержание бутана С 10. Равновесная степень превращения бутана - x р, и: 
В этом уравнении использовано определение концентрации в реагирующей смеси, если реакция протекает с изменением объема.
Из полученного уравнения следует, что разбавление, т.е. уменьшение С 10, будет компенсироваться увеличением x р - равновесной степени превращения бутана. Поэтому в промышленности дегидрирование бутана (как и другие процессы дегидрирования) проводят при разбавлении водяным паром.
4. Избыток одного компонента сырья.
Пусть протекает реакция
A + B = R + S.
Равновесные концентрации компонентов выразим через степень превращения А – х Р:
С A = C A0(1 - х Р); С B = С B0 - C A0 х Р = C A0(l - х Р); С R = С S = C A0 х Р.
Здесь l = С B0/ C A0 – соотношение компонентов А и В в исходной смеси. Из уравнения равновесия получим:
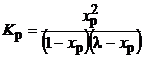
Пусть содержание исходного реагента В увеличено, т.е. увеличено l. Чтобы при этом выполнялось равенство, должна увеличиться х Р - степень превращения компонента А. На практике избытком одного компонента (в данном примере В) увеличивают превращение более ценного компонента сырья (в данном случае А).
5. Удаление компонента продукта. В процессе с реакцией
A + B = R + S
удаляется продукт S, так что в смеси поддерживается его концентрация С S. Условие равновесия (3.51) примет вид:
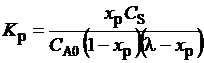 (3.52)
(3.52)
Из (3.52) следует: удаление S, т.е. уменьшение С S, будет компенсироваться увеличением х Р – степенью превращения исходного вещества. Такой прием увеличения равновесной степени превращения используется, например, в реакционно-ректификационном процессе – в нем, например, отгоняется летучий побочный продукт, что обеспечивает более глубокое протекание реакции.
Равновесная степень превращения метана в его реакции с водяным паром при начальном соотношении пар: метан = 2:1 равна 0,54 (Р = 4 МПа, Т = 1100 К).
Избыток водяного пара до соотношения пар: метан = 4:1, которое используется в промышленности, позволяет увеличить максимальное (равновесное) превращения метана до 0,74.




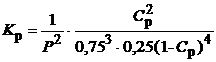


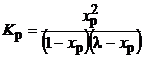
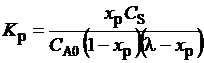 (3.52)
(3.52)


