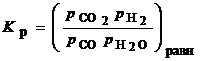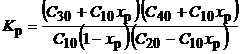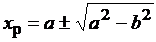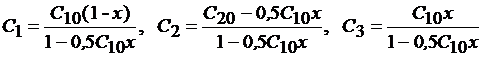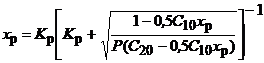Концентрации всех компонентов в реагирующей смеси связаны между собой стехиометрическим уравнением, их можно определить через начальный состав и степень превращения ключевого компонента x.
В равновесии достигается равновесная степень превращения xр, так что выражение (2) или (3) примет вид
КР = f(xР) (4
Определив из него xр, далее находят равновесные концентрации всех компонентов. Приведем примеры.
Простая реакция.
•Простая обратимая реакция: А = R.
Начальная концентрация компонента А - С A0, компонент R - отсутствует.
В равновесном состоянии С А,равн= c A0(1- x Р)
и С R,равн= С A0 x Р.
Из (2) получим
 ,
, 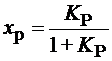 (5)
(5)
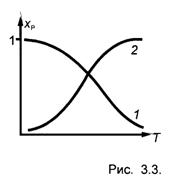
Учитывая зависимость К Р(Т) для экзо- и эндотермических реакций, можно построить зависимость x Р(Т) для этих реакций - рис. 3.3.
2. Конверсия СО с водяным паром: СО + Н2О = СО2 + Н2. Для нее
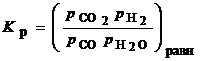
где парциальные давления компонентов p i = РС i;
Р - общее давление.
Концентрации СО, Н2О, СО2, Н2 в начальной смеси С 10, С 20, С30, С40, а в равновесии - С 1р, С 2р, С 3р, С 4р соответственно.
Выразим Сi p через равновесную степень превращения x P:
С 1р = С 10(1 - x Р); С 2р = С 20 - С 10ХР; С3р = С 30 + С 10XР; С 4р = С 40 + С 10XР;
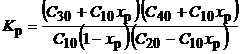
тогда из (3.39) получим квадратное уравнение относительно x P:
Его решение
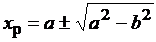
где а = КР/[2С10(КР - 1)], b = (С20/С10) [КР - С30С40/(С10С20)]. (0 < XР < 1)
3. Не всегда можно получить аналитическое выражение для xр.
Реакция SO2 + 0,5O2 = SO3 протекает с изменением объема.
Начальные концентрации SO2 и O2 - С10 и С20 соответственно.
Парциальные давления компонентов получим из определения pi = РСi
Р - общее давление.
Концентрации компонентов выразим через степень превращения SO2 - x:
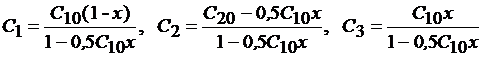
(индекс "3" относится к SO3).
В условиях равновесия
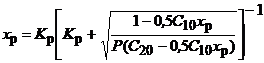
Уравнение решают методом подбора x р, после чего находят концентрации всех компонентов.
Сложная реакция
Для расчета равновесного состава смеси, в которой протекает сложная реакция, описываемая несколькими уравнениями, надо использовать только стехиометрически независимые уравнения как при расчете состава реагирующей смеси.Возможная последовательность расчета такая.
- Определяется базисная система стехиометрически независимых уравнений, позволяющая выразить концентрации всех компонентов смеси через степени превращения ключевого вещества в каждом уравнении выбранной системы.
Обозначим их C (x). Число определенных степеней превращения и количество уравнений в базисной системе совпадают.
Например, для конверсии метана определена базисная система уравнений
CН4 + Н2О = СО + 3Н2;
СН4 + 2Н2О = СO2 + 4Н2.
и получены выражения для концентраций всех веществ, т.е. C (x).
2. Сложное превращение может быть представлено протекающими реакциями, не обязательно совпадающими с уравнениями для расчета состава реагирующей смеси, но их число такое же, как в базисной системе уравнений. Для этих уравнений известны константы равновесия, и можно определить уравнения равновесия. Обозначим их K P j (C).
В примере конверсии метана такими реакциями являются реакции
CН4 + Н2О = СО + 3Н2;
СО + Н2О = СО2 + Н2,
и химическое равновесие - K P(C) - определяется уравнениями:

где К Р1, К Р2 – константы равновесия; р 1, р 2, р 3, р 4, р 5 – равновесные парциальные давления соответственно CН4, Н2О, Н2, СО, СО2; Сi – соответствующие концентрации (мольные доли).
3. Полученные зависимости C(x) подставляем в выражения KPj(C) и получаем зависимости KPj(х), в которых x становятся равновесными степенями превращения XР, т.е. получаем зависимости KP(XР). Для заданных условий (температура, давление) определяем константы равновесия реакций, и из уравнений KP(XР) определяем все значения XP. Теперь из имеющихся зависимостей C(x) можно рассчитать равновесный состав реакционной смеси – концентрации всех компонентов.
Изменение химического равновесия достигается изменением внешних условий. Направленность влияния определяется правилом, называемом принципом Ле-Шателье:



 ,
, 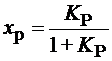 (5)
(5)