Цель работы: научится рассчитывать скорость химической реакции по кинетическому уравнению.
Вопросы для подготовки к занятию:
- понятие истинной и средней скорости химической реакции, константы скорости химической реакции
- закон действия масс
- кинетическое уравнение реакции
Ход работы
I. Теоретическая часть
Основные понятия и расчетные формулы
Для химической реакции общего вида:
n1A+n2B  3C+n4D
3C+n4D
истинная скорость химической реакции (СХР) рассчитывается по формуле:
 , (1)
, (1)
где
 - СХР в определенный момент времени, моль/л•с
- СХР в определенный момент времени, моль/л•с
k - константа СХР, 1/с; л/моль; л2/моль2•с
СА и СB - концентрации реагирующих веществ в заданный момент времени, моль/л
n1 и n2 - коэффициенты в уравнении реакции.
Зависимость СХР от концентраций реагирующих веществ, выраженная формулой 1, называют кинетическим уравнением химической реакции.
II. Практическая часть.
II.1 Примеры решения задач
1. Реакция происходит по схеме: 2A  B+C.
B+C.
Начальная концентрация исходного вещества составляет 5 моль/л, константа скорости реакции составляет 0,01. Найти скорость реакции в начальный момент времени и когда прореагирует 80% от исходного количества А.
Дано СИ Решение
k2=0.01л/моль•с 1)Записать уравнение реакции и расставить коэффициенты:
 =5 моль/л 2А→ В + С
=5 моль/л 2А→ В + С
 =80%С0А 2)Записать кинетическое уравнение для данной реакции
=80%С0А 2)Записать кинетическое уравнение для данной реакции
 (формула 1):
(формула 1):
Найти: 

 3)Найти СХР в начальный момент времени, для чего подставить в кинетическое уравнение начальные концентрации:
3)Найти СХР в начальный момент времени, для чего подставить в кинетическое уравнение начальные концентрации: 
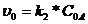 =0,01•52=0,25 (моль/л•с)
=0,01•52=0,25 (моль/л•с)
4)Найти изменение концентраций реагирующих веществ:

С0А - 100% (по исходным даннным)
 - 80%
- 80%
 = С0А •
= С0А •  (моль/л)
(моль/л)
5) Найти конечную концентрацию реагирующих веществ:

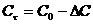
 = 5 – 4 = 1 (моль/л)
= 5 – 4 = 1 (моль/л)
6)Найти скорость химической реакции в конечный момент времени, для чего подставить в кинетическое уравнение конечные концентрации: 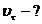
 = 0,01•12=0,01 (моль/л•с)
= 0,01•12=0,01 (моль/л•с)
Ответ: 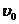 = 0,25 моль/л•с;
= 0,25 моль/л•с; 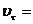 0,01 моль/л•с
0,01 моль/л•с
2. Начальная концентрация реагирующих веществ в реакции синтеза аммиака составляет для азота - 2 моль/л, для водорода - 5 моль/л. Константа скорости химической реакции составляет 1,5•10-3. Найти скорость химической реакции в начальный момент времени и когда прореагирует 20% исходного количества азота.
Дано СИ Решение
C0 N2 = 2моль/л 1)Записать уравнение реакции и расставить
C0 Н2 = 5моль/л коэффициенты:
k3 = 1, 5*10-3л2/моль2*с N2+3H2  3NH3
3NH3

 2) Записать кинетическое уравнение для данной
2) Записать кинетическое уравнение для данной
Найти: реакции (формула 1):



3)Найти скорость химической реакции в начальный момент времени: 
 = 1, 5•10-3•2•53=0,375 (моль/л•с)
= 1, 5•10-3•2•53=0,375 (моль/л•с)
4) Найти изменение концентраций реагирующих веществ: 
а)  (по исходным данным)
(по исходным данным)
С0N2 - 100%
 - 20%
- 20%
 = С0N2•
= С0N2•  0, 4 (моль/л)
0, 4 (моль/л)
б)  (по уравнению реакции с составлением пропорции)
(по уравнению реакции с составлением пропорции)
1мольN2 - 3мольH2
 -
- 
 =
=  1, 2 (моль/л)
1, 2 (моль/л)
5) Найти конечную концентрацию реагирующих веществ: 
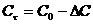
а)  ?
?
 = 2 - 0,4 = 1,6 (моль/л)
= 2 - 0,4 = 1,6 (моль/л)
б)  ?
?
 = 5 - 1,2 = 3,8(моль/л)
= 5 - 1,2 = 3,8(моль/л)
6) Найти конечную скорость химической реакции: 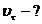
 = 1, 5•10-3•1,6 • 3,83 = 0,132 (моль/л•с)
= 1, 5•10-3•1,6 • 3,83 = 0,132 (моль/л•с)
Ответ:  0,375 моль/л•с;
0,375 моль/л•с; 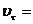 0,132 моль/л•с
0,132 моль/л•с
II.2 Примеры для самостоятельной работы:
1. Реакция происходит по уравнению: 2B  C.
C.
Начальная концентрация исходного вещества 2 моль/л, константа скорости реакции равна150. Найти скорость реакции в начальный момент времени и когда прореагирует 70% от исходного количества вещества B.
2. Реакция происходит по уравнению: CO + H2O  CO2 + H2.
CO2 + H2.
Начальные концентрации исходных веществ равны между собой и составляют 0,5 моль/л. Константа скорости реакции 0,2. Найти СХР в начальный момент времени и когда образуется 0,3 моль/л H2.
3. Реакция происходит по уравнению: S02+O2  S03.
S03.
Начальная концентрация для реагентов составляет для S02 - 5 моль/л, для O2 - 7,5 моль/л, константа скорости реакции составляет 2,5•10-5. Найти скорость реакции в начальный момент времени и когда прореагирует треть от начального количества диоксида серы.
4.* В реакторе объемом 10 л находится 20 г иода и 10 г водорода. Найти скорость реакции в начальный момент времени и когда прореагирует 5 г иода. Все вещества в газообразном состоянии, константа скорости реакции составляет 3•10-6
Оформление отчета:
Отчет должен содержать:
1. Тему и цель работы.
2. Основные расчетные формулы (1).
3. Пример расчетной задачи.
4. Выполненное задание для самостоятельной работы (задачи со знаком *выполняются по желанию на дополнительную оценку).
Практическое занятие № 11



 3C+n4D
3C+n4D , (1)
, (1) - СХР в определенный момент времени, моль/л•с
- СХР в определенный момент времени, моль/л•с B+C.
B+C.

 =5 моль/л 2А→ В + С
=5 моль/л 2А→ В + С =80%С0А 2)Записать кинетическое уравнение для данной реакции
=80%С0А 2)Записать кинетическое уравнение для данной реакции (формула 1):
(формула 1):

 3)Найти СХР в начальный момент времени, для чего подставить в кинетическое уравнение начальные концентрации:
3)Найти СХР в начальный момент времени, для чего подставить в кинетическое уравнение начальные концентрации: 
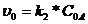 =0,01•52=0,25 (моль/л•с)
=0,01•52=0,25 (моль/л•с)
 (моль/л)
(моль/л)
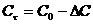
 = 5 – 4 = 1 (моль/л)
= 5 – 4 = 1 (моль/л)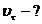
 = 0,01•12=0,01 (моль/л•с)
= 0,01•12=0,01 (моль/л•с)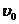 = 0,25 моль/л•с;
= 0,25 моль/л•с; 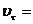 0,01 моль/л•с
0,01 моль/л•с
 2) Записать кинетическое уравнение для данной
2) Записать кинетическое уравнение для данной

 = 1, 5•10-3•2•53=0,375 (моль/л•с)
= 1, 5•10-3•2•53=0,375 (моль/л•с)
 (по исходным данным)
(по исходным данным) - 20%
- 20% 0, 4 (моль/л)
0, 4 (моль/л) (по уравнению реакции с составлением пропорции)
(по уравнению реакции с составлением пропорции)
 1, 2 (моль/л)
1, 2 (моль/л) ?
? = 2 - 0,4 = 1,6 (моль/л)
= 2 - 0,4 = 1,6 (моль/л) ?
? = 5 - 1,2 = 3,8(моль/л)
= 5 - 1,2 = 3,8(моль/л) = 1, 5•10-3•1,6 • 3,83 = 0,132 (моль/л•с)
= 1, 5•10-3•1,6 • 3,83 = 0,132 (моль/л•с) 0,375 моль/л•с;
0,375 моль/л•с; 

