Предположение о том, что любое вещество состоит из мельчайших неделимых частиц – атомов – было высказано около 2500 лет назад древнегреческим философом Демокритом. На основе идей древних учёных в 18 в. начала развиваться молекулярно-кинетическая теория (МКТ). МКТ – это учение о строении, свойствах вещества и тепловых процессах, протекающих в них, на основе представлений о том, что все вещества состоят из отдельных атомов и молекул как мельчайших частицах вещества. Основные положения МКТ строения вещества:
1) вещество состоит из частиц – атомов и молекул;
2)эти частицы беспорядочно движутся;
3)частицы взаимодействуют друг с другом.
Каждое утверждение имеет экспериментальное доказательство.
1. Чтобы доказать, что существуют атомы и молекулы, надо определить их размеры. Наблюдая расплывание капельки масла, например оливкового, по поверхности воды, можно заметить, что масло никогда не займёт всю её поверхность, если сосуд велик. Можно предположить, что при растекании масла до максимальной площади оно образует слой толщиной всего лишь в одну молекулу. Зная объём капли V и площадь её растекания S, можно определить диаметр молекулы d = V/ S. Диаметр любого атома равен 10 -8см = 10 -10м. Увидеть изображения отдельных атомов и молекул позволяют современные приборы (ионные микроскопы).
2. Доказательством беспорядочного движения частиц являются диффузия и броуновское движение. Диффузия - это перемешивание газов, жидкостей и твёрдых тел при непосредственном контакте. Диффузией объясняется распространение запахов, смешивание разнородных жидкостей, процесс растворения твёрдых тел – засол рыбы, овощей, варка варенья, сварка, склеивание, дыхание и т. д.
Броуновское движение – это тепловое движение взвешенных в жидкости (или газе) частиц. Движение микроскопических (броуновских) частиц объясняется хаотическим движением частиц жидкости (газа), которые сталкиваются с броуновскими частицами и приводят их в движение. Это движение никогда не прекращается, а с увеличением температуры жидкости (газа) его интенсивность растёт. Пример броуновского движения – дрожание стрелок чувствительных приборов.
3. Между частицами вещества действуют силы притяжения и отталкивания. Силы притяжения между атомами и молекулами препятствуют растяжению твёрдого тела, силы отталкивания препятствуют его сжатию. Силы притяжения и отталкивания действуют одновременно, но результат их действия зависит от расстояния между частицами вещества. При сближении частиц преобладают силы отталкивания, а при увеличении расстояния между ними - силы притяжения.
Интенсивность (быстроту) беспорядочного движения молекул характеризуют температурой. В середине 19 в. Английский учёный Кельвин предложил абсолютную шкалу температур (шкалу Кельвина), нуль которой соответствует «абсолютному холоду», то есть t = ─2730С. Температура, измеряемая по этой шкале, называется абсолютной температурой (Т), её измеряют в кельвинах (К). Абсолютная температура Т и температура t по шкале Цельсия связаны соотношением Т = t+273.
Т =0 К – абсолютный нуль. Эта температура недостижима, т.к. при такой температуре или давление газа стремится к нулю, или объём газа стремится к нулю. Ни то ни другое невозможно.
Билет 9.
Давление газа. Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона). Изопроцессы.
Величины, характеризующие состояние макроскопических (больших) тел, называют макроскопическими параметрами – это объём, давление и температура. Простейшим состоянием вещества является идеальный газ. Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. Беспорядочно двигаясь, сталкиваясь со стенкой сосуда, молекулы газа оказывают на неё давление.
Это давление зависит от концентрации (число молекул в единице объёма), массы и скорости молекулы газа. Давление газа можно найти по формуле, называемой основным уравнением молекулярно-кинетической теории: p = 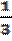 m0•n•
m0•n• 
(m0 – масса молекулы, n –концентрация,  - среднее значение квадрата скорости молекулы). Так как средняя кинетическая энергия поступательного движения молекулы
- среднее значение квадрата скорости молекулы). Так как средняя кинетическая энергия поступательного движения молекулы  , то
, то
p = 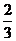 n•
n•  – давление идеального газа прямо пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это другая форма записи основного уравнения МКТ.
– давление идеального газа прямо пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это другая форма записи основного уравнения МКТ.
Формула, связывающая между собой давление p, объём V и температуру Т, называется уравнением состояния идеального газа: p•V = 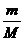 •R•T
•R•T
p – давление газа(Па),V - объём(м3), m – масса газа(кг), М – молярная масса(кг/моль),
Т – абсолютная температура(К), R = 8,31  – универсальная газовая постоянная.
– универсальная газовая постоянная.





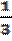 m0•n•
m0•n• 
 - среднее значение квадрата скорости молекулы). Так как средняя кинетическая энергия поступательного движения молекулы
- среднее значение квадрата скорости молекулы). Так как средняя кинетическая энергия поступательного движения молекулы  , то
, то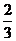 n•
n•  – давление идеального газа прямо пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это другая форма записи основного уравнения МКТ.
– давление идеального газа прямо пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это другая форма записи основного уравнения МКТ.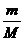 •R•T
•R•T – универсальная газовая постоянная.
– универсальная газовая постоянная.


