

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Действие на клетку патогенных факторов закономерно сопровождается активацией (или включением) реакций, направленных на устранение либо уменьшение степени повреждения и его последствий. Комплекс этих реакций обеспечивает приспособление (адаптацию) клетки к изменившимся условиям ее жизнедеятельности. К числу основных адаптивных механизмов относят реакции компенсации, восстановления, замещения утраченных или поврежденных структур и нарушений функций, защиты клеток от действия патогенных агентов, а также регуляторное снижение их функциональной активности. Весь комплекс адаптивных реакций условно можно разделить на две группы: внутриклеточные и межклеточные.
Внутриклеточные адаптивные механизмы при повреждении.
К их числу можно отнести следующие:
1. Компенсация нарушений энергетического обеспечения клеток:
а) интенсификация ресинтеза АТФ в процессе гликолиза, а также тканевого дыхания в неповрежденных митохондриях;
б) активация механизмов транспорта энергии АТФ;
в) активация механизмов утилизации энергии АТФ.
2. Защита мембран и ферментов клетки:
а) повышение активности факторов системы антиоксидантной защиты;
б) активация буферных систем;
в) повышение активности ферментов детоксикации микросом;
г) активация механизмов репарации компонентов мембран и ферментов.
3. Уменьшение степени или устранение дисбаланса ионов и жидкости в клетках:
а) снижение степени нарушения энергообеспечения;
б) снижение степени повреждения мембран и ферментов;
в) активация буферных систем.
4. Устранение нарушений генетической программы клеток:
а) устранение разрывов в нитях ДНК;
б) ликвидация (блокада) измененных участков ДНК;
|
|
в) синтез нормального фрагмента ДНК вместо поврежденного или утраченного.
5. Компенсация расстройств механизмов регуляции внутриклеточных процессов:
а) изменение числа "функционирующих" рецепторов клетки;
б) изменение сродства рецепторов клетки к регулирующим факторам;
в) изменение активности аденилат – и (или) гуанилатциклазной систем, других "посреднических" систем;
г) изменение активности и (или) содержания внутриклеточных регуляторов метаболизма (ферментов, катионов и др.).
6. Снижение функциональной активности клеток.
7. Регенерация.
8. Гипертрофия.
9. Гиперплазия (см. рис. 6.8).
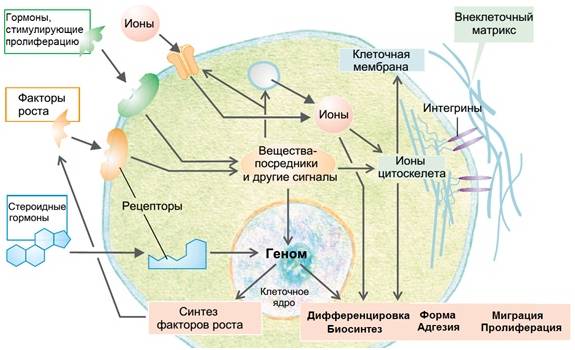
Рис. 6.8. Регуляция процессов жизнедеятельности клетки (пролиферация, подвижность, дифференцировка)
(Зильбергналь С. Клиническая патофизиология. Атлас. Перевод с английского под ред. П.Ф. Литвицкого. / С. Зильбергналь, Ф. Ланг/. – М.: ПРАКТИЧЕСКАЯ МЕДИЦИНА, 2015. – С.5.)
Компенсация нарушений энергетического обеспечения клеток. При повреждении клетки, как правило, в большей или меньшей мере страдают митохондрии и снижается ресинтез АТФ в процессе тканевого дыхания. Это служит сигналом для увеличения "продукции" АТФ в системе гликолиза. При слабой или умеренной степени повреждения активация ресинтеза АТФ может быть достигнута за счет повышения активности ферментов, принимающих участие в процессах окисления и фосфорилирования.
Определенный вклад в компенсацию нарушений энергообеспечения внутриклеточных процессов при повреждении вносит активация ферментов транспорта и утилизации энергии АТФ (адениннуклеотидтрансферазы, креатинфосфокиназы, АТФазы), а также ограничение функциональной активности клетки. Последнее способствует существенному уменьшению расхода энергии АТФ.
Защита мембран и ферментов клеток. Одним из значимых механизмов повреждения мембранного аппарата и энзимов клетки является интенсификация свободнорадикальных и перекисных реакций. Интенсивность этих реакций ограничивается главным образом ферментами антиоксидантной защиты – супероксиддисмутазой (инактивирующей радикалы кислорода), каталазой и глютатионпероксидазой, расщепляющими соответственно перекиси водорода и липидов.
|
|
Другим механизмом защиты мембран и энзимов от повреждающего действия, в частности ферментов лизосом, может быть активация буферных систем клетки. Это обусловливает уменьшение степени внутриклеточного ацидоза и как следствие избыточной гидролитической активности лизосомальных энзимов.
Важную роль в защите мембран и ферментов клеток от повреждения играют ферменты микросом (прежде всего эндоплазматической сети), обеспечивающие физико-химическую трансформацию патогенных агентов путем их окисления, восстановления, деметилирования и т.д. Альтерация клеток может сопровождаться дерепрессией генов и, как следствие, активацией процессов синтеза и репарации компонентов мембран (белков, липидов, углеводов) взамен поврежденных или утраченных.
Уменьшение степени или устранение дисбаланса ионов и жидкости в клетках. При повреждении клеток устранение дисбаланса ионов и жидкости может быть достигнуто путем активации механизмов энергетического обеспечения ионных "насосов", а также защиты мембран и ферментов, принимающих участие в транспорте ионов. Определенную роль в снижении степени ионного дисбаланса играет изменение интенсивности характера метаболизма, а также действие внутриклеточных буферных систем. Так, усиление гликолиза, сочетающегося с распадом гликогена, сопровождается высвобождением из его молекул ионов калия, содержание которого в поврежденных клетках понижено в связи с повышением проницаемости их мембран. Активация внутриклеточных буферных систем (карбонатной, фосфатной, белковой) может способствовать восстановлению оптимального соотношения в гиалоплазме и трансмембранного распределения ионов калия, натрия, кальция и др., в частности, путем уменьшения содержания в клетке ионов водорода. Снижение степени дисбаланса ионов в свою очередь может сопровождаться нормализацией содержания и циркуляции внутриклеточной жидкости, объема клеток и их органелл, а также электрофизиологических параметров.
Устранение нарушений в генетической программе клеток.
Изменения структуры ДНК, ведущие к повреждению клеток, могут быть обнаружены и устранены с участием ферментов репаративного синтеза ДНК. Эти ферменты обеспечивают обнаружение и удаление измененного участка ДНК (они получили название эндонуклеаз или рестриктаз), синтез нормального фрагмента нуклеиновой кислоты взамен удаленного (с помощью ДНК-полимераз) и встраивание вновь синтезированного фрагмента на место удаленного (с участием лигаз). Помимо этих сложных ферментных систем репарации ДНК, в клетке имеются энзимы, устраняющие "мелкомасштабные" биохимические изменения в геноме. К их числу относятся демителазы, удаляющие метильные группы; лигазы, устраняющие разрывы в цепях ДНК, возникающие под действием ионизирующего излечения или свободных радикалов, и др.
|
|
Компенсация расстройств механизмов регуляции внутриклеточных процессов.
К числу реакций, эффективно компенсирущих нарушения механизмов восприятия клеткой регулирующих влияний, относится изменение числа рецепторов гормонов, нейромедиаторов и других физиологически активных веществ на поверхности клетки и ее органелл, а также чувствительности (сродства) рецепторов к этим веществам. Количество рецепторов может меняться, в частности, благодаря тому, что молекулы их способны погружаться в мембрану или цитоплазму клетки и подниматься на ее поверхность. От числа и чувствительности рецепторов, воспринимающих регулирующие стимулы, в значительной мере зависят характер и выраженность ответа на них.
Избыток или недостаток гормонов и нейромедиаторов, а также существенные колебания их активности могут быть "сдемпфированы" на уровне так называемых вторых посредников реализации нервного стимула, в частности циклических нуклеотидов и фосфоинозитольной системы. Известно, например, что соотношение цАМФ и цГМФ изменяется не только в результате действия внутриклеточных регуляторных стимулов, но и внутриклеточных факторов, в частности фосфодиэстераз и ионов кальция. Нарушение реализации регулирующих влияний на клетку может в определенной мере компенсироваться и на уровне внутриклеточных метаболических процессов, поскольку многие из них протекают на основе регуляции интенсивности обмена веществ количеством продукта ферментной реакции (принцип положительной или отрицательной обратной связи).
|
|
Снижение функциональной активности клеток.
Важное значение среди адаптивных механизмов поврежденных клеток имеет управляемое, регулируемое снижение их функциональной активности. Это обусловливает уменьшение расхода энергии АТФ, субстратов метаболизма и кислорода, необходимых для осуществления функции и обеспечения пластических процессов. В результате этого степень и масштаб повреждения клеток при действии патогенного фактора существенно снижаются, а после прекращения его действия отмечается более интенсивное и полное восстановление клеточных структур и их функции. К числу главных механизмов, обусловливающих временное понижение функции клеток, можно отнести уменьшение эффективных центров, снижение числа или чувствительности рецепторов на поверхности клетки, внутриклеточное регуляторное подавление метаболических реакций, репрессию активности отдельных генов.
Адаптация клеток в условиях повреждения происходит не только на метаболическом и функциональном уровнях. Длительное повторное или значительное повреждение обусловливает существенные структурные перестройки в клетке, имеющие адаптивное значение. Они достигаются за счет процессов регенерации, гипертрофии, гиперплазии.
Регенерация (от лат. regeneratio - возрождение, восстановление). Означает возмещение клеток и (или) отдельных структурных элементов взамен погибших, поврежденных или закончивших свой жизненный цикл. Регенерация структур сопровождается восстановлением их функций. Выделяют так называемую клеточную и внутриклеточную (субклеточную) формы регенерации. Первая характеризуется размножением клеток путем митоза или амитоза. Внутриклеточная регенерация проявляется восстановлением органелл: митохондрий, ядра, эндоплазматической сети и других вместо поврежденных или погибших.
Гиперплазия (от греч. hyper - чрезмерно, увеличение + греч. plasis - образование, формирование). Характеризуется увеличением числа структурных элементов, в частности органелл в клетке. Нередко в одной и той же клетке наблюдаются признаки и гиперплазии и гипертрофии. Оба процесса обеспечивают не только компенсацию структурного дефекта, но и возможность повышенного функционирования клетки (см. рис. 6.9.)
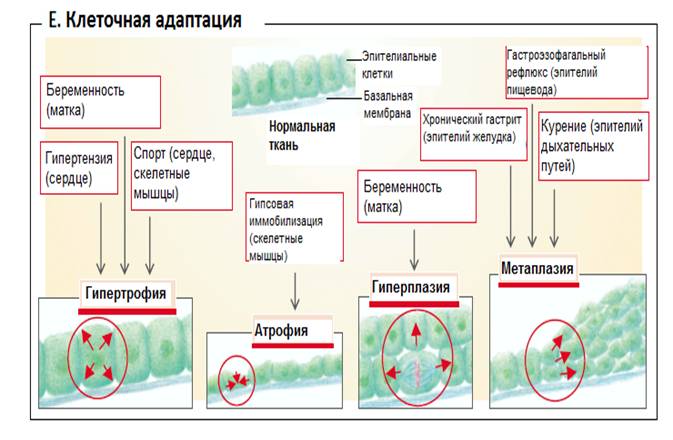
Рис.6.9. Гиперплазия и ее отличие от гипертрофии, атрофии и метаплазии
(Зильбергналь С. Клиническая патофизиология. Атлас. Перевод с английского под ред. П.Ф. Литвицкого. / С. Зильбергналь, Ф. Ланг/. – М.: ПРАКТИЧЕСКАЯ МЕДИЦИНА, 2015. – С.5).
|
|
Межклеточные (системные) механизмы адаптации клеток при их повреждении. В пределах тканей и органов клетки не разобщены. Они взаимодействуют друг с другом путем обмена метаболитами, ФАВ, ионами.
В свою очередь взаимодействие клеток и органов в организме в целом обеспечиваются функционированием систем- и кровообращения, иммунобиологического надзора, эндокринными и нервными влияниями.
Так, уменьшение содержания кислорода в крови (что обусловливает или может обусловить повреждение клеток, прежде всего, мозга) рефлекторно через раздражение хеморецепторов стимулирует нейроны дыхательного центра. Это приводит к увеличению объема альвеолярной вентиляции и ликвидирует или уменьшает степень недостатка кислорода в крови и тканях. Повреждение в результате увеличения выработки гормонов, способствующих повышению в крови уровня глюкозы и транспорта ее в клетки: адреналина, глюкокортикоидов, соматотропного гормона и др.
Примером адаптивной реакции циркуляторного типа может быть увеличение притока крови по коллатеральным (обходным) сосудам при закрытии просвета магистральной артерии какого-либо органа или ткани.
Иммунные механизмы надзора и защиты включаются при действии патогенного фактора антигенной природы. Иммунокомпетентная система с участием фагоцитов, антител и (или) Т-лимфоцитов инактивирует эндо и экзогенные антигены, способные повредить клетки организма. В норме указанные выше и другие системы обеспечивают адекватное реагирование организма в целом на различные воздействия эндо- и экзогенного происхождения. В патологии они участвуют в регуляции и реализации механизмов защиты, компенсации и восстановления поврежденных структур и нарушенных функций клеток и тканей.
Характерной чертой межклеточных механизмов адаптации является то, что они реализуются в основном при участии клеток, которые неподвергались непосредственному воздействию патогенного фактора (например, гиперфункция кардиомиоцитов за пределами зоны некроза при инфаркте миокарда).
По уровню реализации реакции межклеточной адаптации при повреждении клеток можно разделить на органно-тканевые, внутрисистемные, межсистемные.
Примером реакции органно-тканевого уровня может служить активация функции поврежденных клеток печени или почки при повреждении клеток части органа. Это снижает нагрузку на клетки, подвергшиеся патогенному воздействию, способствует уменьшению степени их альтерации и реализации репаративных процессов.
К числу внутрисистемных реакций относится сужение артериол при снижении работы сердца (например, при инфаркте миокарда), что обеспечивает поддержание высокого уровня перфузионного давления в тканях и предотвращает (или уменьшает степень) повреждения их клеток.
Вовлечение в адаптивные реакции нескольких физиологических систем наблюдается, например, при общей гипоксии. При этом активируется работа систем дыхания, кровообращения, крови и тканевого метаболизма, что снижает недостаток кислорода и субстратов метаболизма в тканях, повышает их утилизацию и уменьшает благодаря этому степень повреждения их клеток.
Активация внутриклеточных и межклеточных механизмов адаптации при повреждении, как правило, предотвращает гибель клеток, обеспечивает выполнение ими функций и способствует ликвидации последствий действия патогенного фактора. В этом случае говорят об обратимых изменениях в клетках. Если сила патогенного агента велика и (или) защитно-приспособительные механизмы недостаточны, развивается необратимое повреждение клеток и они погибают.
|
|
|

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!