

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
Топ:
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Интересное:
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Титриметрический метод определения ХПК основан на окислении органических веществ избытком бихромата калия в растворе серной кислоты при нагревании в присутствии катализатора - сульфата серебра. Остаток бихромата калия находят титрованием раствором соли Мора в присутствии индикатора фенилантраниловой кислоты или ферроина и по разности определяют количество 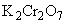 , израсходованное на окисление органических веществ. Конец реакции отмечается появлением фиолетового окрашивания от одной избыточной капли раствора.
, израсходованное на окисление органических веществ. Конец реакции отмечается появлением фиолетового окрашивания от одной избыточной капли раствора.
Е.3.1 Средства измерений, вспомогательные устройства, реактивы и растворы
Весы лабораторные высокого (II) класса точности с ценой деления 0,1 мг и наибольшим пределом взвешивания 200 г по ГОСТ 24104 или
весы с неавтоматическим установлением показаний высокого (II) класса точности с действительной ценой деления 0,05 мг и максимальной нагрузкой 200 г.
Набор гирь (1-100 г)  по OIML R 111-1.
по OIML R 111-1.
Колбы 2-100-2; 2-500-2; 2-1000-2 по ГОСТ 1770.
Пипетки 1-1-2-1; 1-1-2-2 по ГОСТ 29227.
Пипетки 2-2-5; 2-2-10; 2-2-20 по ГОСТ 29169.
Бюретка 1-3-2-25-0,1 по ГОСТ 29251.
Цилиндры 3-25-2; 3-50-2 по ГОСТ 1770.
Плитка электрическая с закрытой спиралью и регулируемой мощностью нагрева по ГОСТ 14919.
Стаканчик СВ-14/18 по ГОСТ 25336.
Капельница 2-50 ХС по ГОСТ 25336.
Эксикатор по ГОСТ 25336.
Установка для определения ХПК в составе.
Колба К-1-250-29/32 ТС или колба Гр-250-29/32 по ГОСТ 25336.
Холодильник ХПТ-2-400-29/32 ХС по ГОСТ 25336.
Воронка В-56-80 ХС по ГОСТ 25336.
Калий двухромовокислый (бихромат калия) по ГОСТ 4220, раствор молярной концентрации 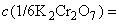 0,1 моль/дм
0,1 моль/дм  (0,1 н.); готовят по ГОСТ 25794.2.
(0,1 н.); готовят по ГОСТ 25794.2.
Железо (II) сернокислое 7-водное по ГОСТ 4148.
Соль закиси железа и аммония двойная сернокислая (соль Мора) по ГОСТ 4208, раствор молярной концентрации 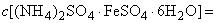 0,05 моль/дм
0,05 моль/дм  (0,05 н.).
(0,05 н.).
|
|
Сульфат серебра.
Кислота серная по ГОСТ 4204.
1,10-Фенантролин моногидрат  .
.
1,10-Фенантролин сульфат 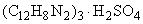 .
.
Бумага индикаторная универсальная.
Вода дистиллированная по ГОСТ 6709.
Часы.
Примечание - Допускается применение других средств измерений с метрологическими характеристиками и оборудования с техническими характеристиками не хуже, а также реактивов по качеству не ниже указанных.
Е.3.2 Подготовка к выполнению измерений
Е.3.2.1 Приготовление растворов и реактивов
Е.3.2.1.1 Раствор соли Мора молярной концентрации 0,05 моль/дм 
9,8 г соли Мора переносят в мерную колбу вместимостью 500 см  , растворяют в дистиллированной воде, осторожно добавляют 10 см
, растворяют в дистиллированной воде, осторожно добавляют 10 см  концентрированной серной кислоты и после охлаждения доводят объем раствора до метки дистиллированной водой. Хранят в плотно закрытой посуде не более 6 мес. Точную молярную концентрацию раствора устанавливают ежедневно или перед серией определений.
концентрированной серной кислоты и после охлаждения доводят объем раствора до метки дистиллированной водой. Хранят в плотно закрытой посуде не более 6 мес. Точную молярную концентрацию раствора устанавливают ежедневно или перед серией определений.
Е.3.2.1.2 Раствор индикатора
Готовят раствор ферроина: 1,485 г 1,10-фенантролина и 0,695 г 7-водного сернокислого железа (II) помещают в мерную колбу вместимостью 100 см  , растворяют в дистиллированной воде, доводят объем раствора водой до метки и перемешивают. Раствор индикатора хранят в плотно закрытой склянке из темного стекла не более 3 мес.
, растворяют в дистиллированной воде, доводят объем раствора водой до метки и перемешивают. Раствор индикатора хранят в плотно закрытой склянке из темного стекла не более 3 мес.
Е.3.3 Выполнение измерений
Пипеткой 20 см  очищенной сточной воды помещают в колбу, добавляют пипеткой 10 см
очищенной сточной воды помещают в колбу, добавляют пипеткой 10 см  раствора двухромовокислого калия и малыми порциями приливают 30 см
раствора двухромовокислого калия и малыми порциями приливают 30 см  концентрированной серной кислоты. Затем добавляют 200 мг сернокислого серебра, содержимое тщательно перемешивают и после присоединения обратного холодильника смесь равномерно кипятят в течение 2 ч. Затем колбу охлаждают, обмывая стенки холодильника 50 см
концентрированной серной кислоты. Затем добавляют 200 мг сернокислого серебра, содержимое тщательно перемешивают и после присоединения обратного холодильника смесь равномерно кипятят в течение 2 ч. Затем колбу охлаждают, обмывая стенки холодильника 50 см  дистиллированной воды, добавляют 2-3 капли раствора ферроина и титруют избыток двухромовокислого калия раствором соли Мора, фиксируя окончание титрования появлением фиолетового окрашивания.
дистиллированной воды, добавляют 2-3 капли раствора ферроина и титруют избыток двухромовокислого калия раствором соли Мора, фиксируя окончание титрования появлением фиолетового окрашивания.
Одновременно проводят контрольный опыт с 20 см  дистиллированной воды.
дистиллированной воды.
|
|
|
|
|

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!