Основные законы и формулы
1. Первое начало термодинамики:
а) в общем случае
 ,
,
т.е. теплота Q, сообщенная газу, идет на изменение  его внутренней энергии и на работу А, совершаемую газом против внешних сил;
его внутренней энергии и на работу А, совершаемую газом против внешних сил;
б) при изохорическом процессе ( )
)
 ,
,
следовательно,
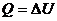 ,
,
т.е. теплота, сообщенная газу, полностью идет на изменение его внутренней энергии.
С другой стороны
 ;
;
в) при изобарическом процессе ( )
)
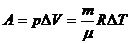 ,
,
поэтому

или
 ;
;
г) при изотермическом процессе ( )
)

 ,
,
следовательно,
 ,
,
т.е. теплота, сообщенная газу, полностью идет на совершение газом работы против внешних сил;
д) при адиабатическом процессе (Q=0)
 ,
,
т.е. работа совершается газом за счет изменения его внутренней энергии
 ,
,
или
 .
.
2. Уравнения Пуассона. При адиабатическом процессе давление газа и его объем связаны соотношением  .
.
Начальное и конечное значения давления, объема и температуры связаны соотношениями:
 ,
,
 ,
,
 .
.
3. Термический к.п.д.  характеризует степень использования теплоты при превращении ее в работу или, другими словами, совершенство цикла, по которому работает тепловой двигатель:
характеризует степень использования теплоты при превращении ее в работу или, другими словами, совершенство цикла, по которому работает тепловой двигатель:
 ,
,
где Q1 – теплота, полученная рабочим веществом (газом) от нагревателя, Q2 – теплота, переданная рабочим веществом (газом) холодильнику.
4. Термический к.п.д. обратимого цикла Карно:
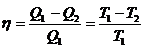 ,
,
где Т1 – абсолютная температура нагревателя, Т2 – абсолютная температура холодильника.
Свойства жидкостей
Основные законы и формулы
1. Коэффициент поверхностного натяжения:
 , (1)
, (1)
где F – сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкости, или
 , (2)
, (2)
где  – изменение свободной энергии поверхностного слоя жидкости, связанное с изменением
– изменение свободной энергии поверхностного слоя жидкости, связанное с изменением  поверхности этого слоя.
поверхности этого слоя.
Формула (1) показывает, что коэффициент поверхностного натяжения есть величина, численно равная силе, действующей на единицу длины границы раздела поверхности жидкости.
Из формулы (2) следует, что коэффициент поверхностного натяжения есть величина, численно равная изменению свободной энергии слоя жидкости при изменении площади ее на единицу.
2. Формула Лапласа, выражающая давление р, создаваемое изогнутой поверхностью жидкости:
а) в общем случае
 ,
,
где R 1 и R 2 – радиусы кривизны двух взаимно перпендикулярных сечений поверхности жидкости;
б) в случае сферической поверхности
 .
.
3. Высота подъема жидкости в капиллярной трубке
 ,
,
где θ – краевой угол; при полном смачивании стенки трубки жидкостью θ=0, при полном несмачивании стенки трубки жидкостью θ=  , R – радиус канала трубки,
, R – радиус канала трубки,  – плотность жидкости, g – ускорение свободного падения.
– плотность жидкости, g – ускорение свободного падения.
4. Высота подъема жидкости между двумя близкими и параллельными друг другу плоскостями:
 ,
,
где d – расстояние между плоскостями.
Примеры решения задач
Пример 1. Определить плотность смеси газов из  моль азота и
моль азота и 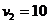 моль кислорода, которая содержится в баллоне при температуре t =170С и давлении
моль кислорода, которая содержится в баллоне при температуре t =170С и давлении  МПа.
МПа.
Решение. Согласно определению плотности имеем
 , (1)
, (1)
где m1 и m2 – массы азота и кислорода соответственно; V – объем баллона.
Выразим массу каждого газа через количество вещества и молярную массу:
 ,
,  (2)
(2)
Для определения объема газа в баллоне воспользуемся уравнением Менделеева-Клапейрона для смеси газов:
 ,
,
где R – молярная газовая постоянная; Т – термодинамическая температура. Тогда
 . (3)
. (3)
Подставив выражения (2) и (3) в (1), получим
 . (4)
. (4)
Вычислим искомую плотность:
 кг/м3=31,8 кг/м3.
кг/м3=31,8 кг/м3.
Пример 2. Определить: 1) число атомов, содержащихся в 1 кг гелия; 2) массу одного атома гелия.
Решение. 1. Число молекул в данной массе газа:
 , (1)
, (1)
где m – масса газа; М – молярная масса;  – количество вещества,
– количество вещества, 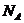 – постоянная Авогадро.
– постоянная Авогадро.
Поскольку молекулы гелия одноатомны, число атомов в данной массе газа равно числу молекул.
Запишем величины, входящие в формулу (1), в СИ:  кг/моль,
кг/моль,  моль-1.
моль-1.
Найдем искомое число атомов:
 .
.
2. Для определения массы  одного атома массу газа разделим на число атомов в нем:
одного атома массу газа разделим на число атомов в нем:
 . (2)
. (2)
Подставив числовые значения величин в (2), получим:
 кг
кг  кг.
кг.
Пример 3. Считая водяной пар массой  г при температуре
г при температуре 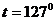 С идеальным газом, определить: 1) внутреннюю энергию пара; 2) среднюю энергию вращательного движения одной молекулы этого пара.
С идеальным газом, определить: 1) внутреннюю энергию пара; 2) среднюю энергию вращательного движения одной молекулы этого пара.
Решение. 1. Внутренняя энергия идеального газа есть полная кинетическая энергия всех молекул газа; она выражается формулой:
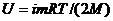 , (1)
, (1)
где 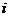 – число степеней свободы молекулы газа; М – молярная масса; R – молярная газовая постоянная; Т – термодинамическая температура.
– число степеней свободы молекулы газа; М – молярная масса; R – молярная газовая постоянная; Т – термодинамическая температура.
Вычислим искомую внутреннюю энергию:

2. Известно, что на каждую степень свободы молекулы газа приходится в среднем энергия
 ,
,
где k – постоянная Больцмана.
Вращательному движению каждой молекулы приписывается некоторое число степеней свободы i вр. Это относится ко всем молекулам, кроме одноатомных, для которых энергия вращательного движения равна нулю, как для материальных точек, размещенных на оси вращения.
Таким образом, энергия вращательного движения молекулы равна:
 .
.
Выпишем числовые значения величин в единицах СИ:  Дж/К;
Дж/К;  , так как вращательному движению трехатомной молекулы соответствуют три степени свободы.
, так как вращательному движению трехатомной молекулы соответствуют три степени свободы.
Выполнив подстановку и вычисления, получим:
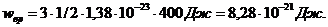
Пример 4. Кислород массой  г изобарно расширяется под давлением
г изобарно расширяется под давлением  Па от начальной температуры
Па от начальной температуры 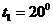 С, поглощая в процессе расширения теплоту
С, поглощая в процессе расширения теплоту  кДж. Определить: 1) работу расширения газа; 2) конечный объем газа.
кДж. Определить: 1) работу расширения газа; 2) конечный объем газа.
Решение. 1. Работа, совершаемая газом при постоянном давлении, выражается формулой
 . (1)
. (1)
Из уравнения Менделеева-Клапейрона, записанного для начального и конечного состояний газа ( ,
,  ), выразим неизвестные начальный V1 и конечный V2 объемы:
), выразим неизвестные начальный V1 и конечный V2 объемы:
 ; (2)
; (2)
 . (3)
. (3)
Подставив (2) и (3) в (1), получим:
 , (4)
, (4)
где М – молярная масса кислорода; R – молярная газовая постоянная; Т 1 и Т 2 – начальная и конечная температуры газа.
Из формулы для теплоты при изобарном процессе
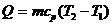 ,
,
где ср – удельная теплоемкость газа при постоянном давлении, выразим неизвестную разность температур:
 . (5)
. (5)
Известно, что
 , (6)
, (6)
где i – число степеней свободы молекулы газа. Подставив (6) в (5), а результат затем в (4), получим:
 . (7)
. (7)
По формуле (7) вычислим А:

2. Для определения конечного объема V2 воспользуемся формулой (1), преобразовав которую получим:
 (8)
(8)
Неизвестную величину V1 можем определить из уравнения Менделеева-Клапейрона для начального состояния газа.
Подставив в (8) правую часть уравнения (2), получим:

Вычислим искомый конечный объем:
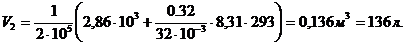
Пример 5. Определить: 1) среднюю длину свободного пробега l и 2) среднюю частоту столкновений z молекул воздуха при температуре t= 0 0C и давлении 1,01 Па. Принять эффективный диаметр молекулы воздуха равным  см.
см.
Решение. 1. Средняя длина свободного пробега молекулы выражается формулой:
 , (1)
, (1)
где n – концентрация молекул (отношение числа молекул к объему газа, в котором они заключены). Для определения неизвестной концентрации молекул воспользуемся основным уравнением молекулярно-кинетической теории:
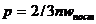 , (2)
, (2)
здесь р – давление газа, wпост – средняя энергия поступательного движения молекулы газа, равная
 , (3)
, (3)
где k – постоянная Больцмана, Т – термодинамическая температура газа.
Подставив (3) в (2), выразим из полученной формулы концентрацию молекул:
 , (4)
, (4)
Подставив (4) в (1), получим
 .
.
Вычислим искомую длину свободного пробега молекул:

2. Средняя частота столкновений молекул газа связана с длиной свободного пробега соотношением:
 , (5)
, (5)
где 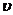 – средняя арифметическая скорость молекул. Ее можно определить по формуле:
– средняя арифметическая скорость молекул. Ее можно определить по формуле:
 , (6)
, (6)
где R – молярная газовая постоянная; М – молярная масса воздуха.
Подставив (6) в (5), после преобразования получим
 . (7)
. (7)
Вычислим искомую частоту столкновений:
 .
.
Пример 6. Определить среднюю квадратичную скорость молекул идеального газа при давлении  Па, если плотность газа
Па, если плотность газа  кг/м3.
кг/м3.
Решение. Средняя квадратичная скорость молекул идеального газа выражается формулой:
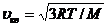 , (1)
, (1)
где R – молярная газовая постоянная; Т – термодинамическая температура газа; М – молярная масса.
Для определения неизвестных величин Т и М воспользуемся уравнением Менделеева-Клапейрона:
 ,
,
откуда
 . (2)
. (2)
Подставив  из (2) в (1), получим:
из (2) в (1), получим:
 . (3)
. (3)
Вычислим искомую скорость молекул:
 = 389 м/с.
= 389 м/с.
Пример 7. Определить, при каком градиенте плотности углекислого газа через каждый квадратный метр поверхности почвы продиффундирует в атмосферу в течение 1 ч масса газа 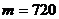 мг, если коэффициент диффузии
мг, если коэффициент диффузии 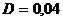 см2/с.
см2/с.
Решение. Масса газа, переносимая в результате диффузии, определяется законом Фика:
 , (1)
, (1)
где D – коэффициент диффузии;  – градиент плотности, т.е. изменение плотности, приходящееся на 1 м толщины слоя почвы; S – площадь поверхности слоя; t – длительность диффузии.
– градиент плотности, т.е. изменение плотности, приходящееся на 1 м толщины слоя почвы; S – площадь поверхности слоя; t – длительность диффузии.
Из (1) выразим искомый градиент плотности:
 . (2)
. (2)
Вычислим градиент плотности:
 кг/м4= –0,05кг/м4.
кг/м4= –0,05кг/м4.
Отрицательное значение градиента плотности соответствует сущности процесса диффузии: зависимость плотности от расстояния в направлении движения диффундирующей массы выражается убывающей функцией, градиент которой - отрицательная величина.
Пример 8. Определить количество теплоты, теряемое через бетонные стены здания площадью  м2 за время
м2 за время  мин, если в помещении температура стены
мин, если в помещении температура стены  С, а снаружи
С, а снаружи 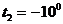 С. Толщина стен
С. Толщина стен 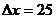 см.
см.
Решение. Количество теплоты, передаваемое за счет теплопроводности стен, выражается законом Фурье:
 , (1)
, (1)
где  – теплопроводность материала стены;
– теплопроводность материала стены; 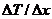 – градиент температуры, т. е. изменение температуры, приходящееся на 1 м толщины стены; S – площадь поверхности стены; t – время передачи теплоты.
– градиент температуры, т. е. изменение температуры, приходящееся на 1 м толщины стены; S – площадь поверхности стены; t – время передачи теплоты.
Подставим числовые значения величин в формулу (1) и вычислим:

Пример 9. Воздух, взятый при температуре  С, был адиабатно сжат так, что его объем уменьшился в три раза. Определить температуру воздуха после сжатия.
С, был адиабатно сжат так, что его объем уменьшился в три раза. Определить температуру воздуха после сжатия.
Решение. Зависимость между температурой и объемом при адиабатном сжатии выражается уравнением Пуассона:
 , (1)
, (1)
где 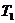 ,
, 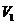 – соответственно термодинамическая температура и объем до сжатия воздуха;
– соответственно термодинамическая температура и объем до сжатия воздуха;  ,
,  – те же величины после сжатия воздуха;
– те же величины после сжатия воздуха;  – отношение теплоемкости газа при постоянном давлении к теплоемкости газа при постоянном объеме.
– отношение теплоемкости газа при постоянном давлении к теплоемкости газа при постоянном объеме.
Из теории теплоемкостей газов известно, что
 ,
,
где i – число степеней свободы молекулы газа.
Так как воздух – газ двухатомный, то  и, следовательно,
и, следовательно,
 .
.
Из формулы (1) получим:
 . (2)
. (2)
Подставим числовые значения  К,
К,  ,
, 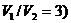 в (2):
в (2):
 .
.
Прологарифмируем обе части полученного равенства:
 .
.
По значению lg Т2, пользуясь справочной таблицей, найдем
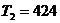 К, или
К, или 
Пример 10. Нагреватель тепловой машины, работающей по циклу Карно, имеет температуру  С. Определить температуру холодильника, если ¾ теплоты, полученной от нагревателя, газ отдает холодильнику.
С. Определить температуру холодильника, если ¾ теплоты, полученной от нагревателя, газ отдает холодильнику.
Решение. Термический КПД тепловой машины, работающей по циклу Карно, выражается формулой
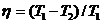 , (1)
, (1)
или, как и для любого цикла,
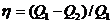 , (2)
, (2)
где 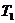 и
и  – соответственно термодинамические температуры нагревателя и холодильника;
– соответственно термодинамические температуры нагревателя и холодильника;  – теплота, полученная газом от нагревателя;
– теплота, полученная газом от нагревателя;  – теплота, отданная газом холодильнику.
– теплота, отданная газом холодильнику.
Приравняв правые части формулы (1) и (2), получим:
 . (3)
. (3)
После преобразований уравнение (3) примет вид  , откуда
, откуда
 . (4)
. (4)
Подставив числовые значения  ,
,  в (4) и вычислим:
в (4) и вычислим:
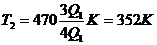 , или
, или 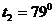 С.
С.
Задачи для самостоятельного решения
2.1. Вычислить массу молекулы воды.
2.2. В озеро глубиной h= 20 м и площадью S = 10 км2 бросили кристаллик поваренной соли массой m= 0,010 г. Сколько молекул этой соли оказалось бы в наперстке воды объемом  см3, зачерпнутом из этого озера, если считать, что соль, растворившись, равномерно распределилась по всему объему озера?
см3, зачерпнутом из этого озера, если считать, что соль, растворившись, равномерно распределилась по всему объему озера?
2.3. Оценить для железа: 1) число атомов в объеме  3 см; 2) расстояние между центрами соседних атомов.
3 см; 2) расстояние между центрами соседних атомов.
2.4. Оценить для газа при нормальных условиях: 1) число молекул в 1,0 см3; 2) среднее расстояние между соседними молекулами.
2.5. Вычислить концентрацию молекул газа при нормальных условиях.
2.6. Определить плотность углекислого газа при нормальных условиях.
2.7. Сколько молей содержится в 1,0 кг воды?
2.8. Считая, что объем молекулы воды равен 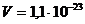 см3, найти, какой процент от всего пространства, занятого водой, приходится на долю самих молекул.
см3, найти, какой процент от всего пространства, занятого водой, приходится на долю самих молекул.
2.9. Считая, что диаметр молекул кислорода равен  см, оценить, какой длины получилась бы нить, если все молекулы, содержащиеся в m= 1,0 мг кислорода, были расположены в один ряд, вплотную друг другу. Во сколько раз длина этой нити оказалась бы больше среднего расстояния от Земли до Луны?
см, оценить, какой длины получилась бы нить, если все молекулы, содержащиеся в m= 1,0 мг кислорода, были расположены в один ряд, вплотную друг другу. Во сколько раз длина этой нити оказалась бы больше среднего расстояния от Земли до Луны?
2.10. Хорошо откаченная лампа накаливания объемом V= 10 см3 имеет трещину, в которую ежесекундно проникает z= 106 молекул газа. Сколько времени понадобится для наполнения лампы до нормального давления, если скорость проникновения газа остается постоянной? Температура t= 00C.
2.11. За время t= 10 суток полностью испарилось из стакана m= 100 г воды. Сколько в среднем вылетало молекул с поверхности воды за 1,0 с?
2.12. Вычислить среднюю квадратичную скорость атомов гелия при температуре 270С.
2.13. При повышении температуры идеального газа на  средняя квадратичная скорость его молекул увеличилась с
средняя квадратичная скорость его молекул увеличилась с  до
до  =500 м/с. На сколько нужно нагреть газ, чтобы увеличить среднюю квадратичную скорость его молекул с
=500 м/с. На сколько нужно нагреть газ, чтобы увеличить среднюю квадратичную скорость его молекул с 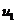 =500 м/с до u2=600 м/с?
=500 м/с до u2=600 м/с?
2.14. Определить концентрацию молекул идеального газа при нормальном давлении и температуре t= 230C. Сколько таких молекул будет содержаться в колбе емкостью V= 200 мл.
2.15. В закрытом сосуде находится идеальный газ. Как изменится его давление, если средняя квадратичная скорость его молекул увеличится на 20 %?
2.16. Кислород при температуре 770С и давлении 0,20 МПа занимает объем 10 л. Какова его масса?
2.17. В сосуде объемом 12 л находится 25 г газа при температуре 270С и давлении 1,85 кПа. Какой это газ?
2.18. Когда из сосуда выпустили некоторое количество газа, давление в нем упало на 40%, а абсолютная температура уменьшилась на 10%. Какую часть газа выпустили?
2.19. Воздух в открытом сосуде медленно нагрели до T1 =400 К, затем, герметически закрыв, сосуд охладили до T2=280 К. На сколько при этом изменилось давление газа в сосуде?
2.20. Во сколько раз увеличится объем воздушного шара, если его внести с улицы в теплое помещение. Температура на улице –30С, в помещении +270С.
2.21. Объем некоторой массы газа при нагревании на  =10 К при постоянном давлении увеличился на n=3% от своего первоначального объема. Определить начальную температуру газа.
=10 К при постоянном давлении увеличился на n=3% от своего первоначального объема. Определить начальную температуру газа.
2.22. Какая масса воздуха выйдет из комнаты, если температура воздуха возросла с t1= 100C до t2= 200С? Объем комнаты V= 60 м3. Давление нормальное.
2.23. Внутри закрытого с обоих концов горизонтального цилиндра имеется тонкий поршень, который может скользить в цилиндре без трения. С одной стороны поршня находится водород массой  г, с другой – азот массой
г, с другой – азот массой  г. Какую часть объема цилиндра занимает водород?
г. Какую часть объема цилиндра занимает водород?
2.24. В стальной баллон емкостью 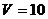 л нагнетается водород при температуре
л нагнетается водород при температуре  К. Сколько водорода можно поместить в баллон, если допустимое давление на стенки баллона
К. Сколько водорода можно поместить в баллон, если допустимое давление на стенки баллона  МПа?
МПа?
2.25. Два сосуда, содержащих одинаковую массу одного и того же газа, соединены трубкой с краном. В первом сосуде давление  Па, а во втором
Па, а во втором  Па. Температура в сосудах одинакова. Какое установится давление после открытия крана?
Па. Температура в сосудах одинакова. Какое установится давление после открытия крана?
2.26. В сосуд объемом  л помещают кислород массой
л помещают кислород массой 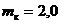 г и азот массой
г и азот массой 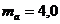 г. Каково давление смеси при температуре
г. Каково давление смеси при температуре  К?
К?
2.27. В сосуде объемом  л находится смесь кислорода и углекислого газа. Масса смеси
л находится смесь кислорода и углекислого газа. Масса смеси 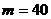 г, температура
г, температура  К, давление
К, давление 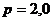 МПа. Найти массу каждого из газов.
МПа. Найти массу каждого из газов.
2.28. В закрытом сосуде находится воздух и капля воды массой  г. Объем сосуда
г. Объем сосуда  л, давление в нем
л, давление в нем  кПа и температура
кПа и температура  К. Каким будет давление в сосуде, когда капля воды испарится?
К. Каким будет давление в сосуде, когда капля воды испарится?
2.29. В атмосферном воздухе на долю азота приходится 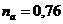 массы, а на долю кислорода
массы, а на долю кислорода  (если пренебречь примесями других газов). Вычислить молярную массу воздуха.
(если пренебречь примесями других газов). Вычислить молярную массу воздуха.
2.30. Свинцовая пуля, летевшая со скоростью  м/с, пробила стенку. Определить, на сколько градусов нагрелась пуля, если после стенки скорость ее снизилась до
м/с, пробила стенку. Определить, на сколько градусов нагрелась пуля, если после стенки скорость ее снизилась до 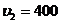 м/с. Считать, что на нагревание пули пошло 50% выделившейся теплоты.
м/с. Считать, что на нагревание пули пошло 50% выделившейся теплоты.
2.31. С какой скоростью должна лететь свинцовая пуля, чтобы при ударе о препятствие она расплавилась? Первоначальная температура пули равна 270С. Считать, что вся выделившаяся теплота сообщается пуле.
2.32. Найти расход бензина автомобиля «Запорожец» на  км пути при скорости
км пути при скорости  км/ч. Мощность мотора
км/ч. Мощность мотора  кВт, коэффициент полезного действия
кВт, коэффициент полезного действия  %.
%.
2.33. Автомобиль «Москвич» расходует бензин массой  кг на
кг на  км пути. Определить мощность N, развиваемую двигателем, если скорость движения
км пути. Определить мощность N, развиваемую двигателем, если скорость движения  км/ч и КПД двигателя
км/ч и КПД двигателя  %.
%.
2.34. Определить, на сколько увеличится расход бензина на  км пути при движении автомобиля массой
км пути при движении автомобиля массой  т по дороге с подъемом
т по дороге с подъемом  м на
м на  м пути по сравнению с расходом бензина на горизонтальной дороге. КПД двигателя
м пути по сравнению с расходом бензина на горизонтальной дороге. КПД двигателя  %. Скорость на всех участках дороги постоянна.
%. Скорость на всех участках дороги постоянна.
2.35. Автомобиль развивает скорость  км/ч, расходуя при этом бензин массой
км/ч, расходуя при этом бензин массой 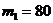 г на
г на  км. Какое количество бензина будет расходовать автомобиль при скорости
км. Какое количество бензина будет расходовать автомобиль при скорости  км/ч? Какую мощность он при этом разовьет? Сила сопротивления пропорциональна скорости, КПД двигателя
км/ч? Какую мощность он при этом разовьет? Сила сопротивления пропорциональна скорости, КПД двигателя  %.
%.
2.36. Определить градиент плотности углекислого газа в почве, если через площадь  м2 ее поверхности за время
м2 ее поверхности за время  с в атмосферу прошел газ массой
с в атмосферу прошел газ массой  кг. Коэффициент диффузии
кг. Коэффициент диффузии 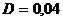 см2/с.
см2/с.
2.37. Определить толщину слоя суглинистой почвы, если за время  ч через площадь поверхности
ч через площадь поверхности  м2 проходит теплота
м2 проходит теплота  кДж. Температура на поверхности почвы
кДж. Температура на поверхности почвы 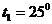 С, в нижнем слое почвы
С, в нижнем слое почвы  С.
С.
2.38. Сколько теплоты пройдет через площадь поверхности
 м2 песка за время
м2 песка за время  ч, если температура на его поверхности
ч, если температура на его поверхности  С, а на глубине
С, а на глубине 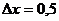 м –
м –  С?
С?
2.39. Определить массу газа, продиффундировавшего за время  ч через поверхность почвы площадью
ч через поверхность почвы площадью  см2, если коэффициент диффузии
см2, если коэффициент диффузии  см2/с. Плотность газа на глубине
см2/с. Плотность газа на глубине 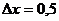 м равна
м равна  г/см3, а у поверхности
г/см3, а у поверхности  г/см3.
г/см3.
2.40. Определить коэффициент теплопроводности азота, находящегося в некотором объеме при температуре 280 К. Эффективный диаметр молекул азота принять равным 0,38 нм.
2.41. Кислород находится при нормальных условиях. Определить коэффициент теплопроводности кислорода, если эффективный диаметр его молекул равен 0,36 нм.
2.42. Пространство между двумя параллельными пластинами площадью 150 см2 каждая, находящимися на расстоянии 5 мм друг от друга, заполнено кислородом. Одна пластина поддерживается при температуре 170С, другая – при температуре 270С. Определить количество теплоты, прошедшее за 5 мин посредством теплопроводности от одной пластины к другой. Кислород находится при нормальных условиях. Эффективный диаметр молекул кислорода считать равным 0,36 нм.
2.43. Определить коэффициент диффузии кислорода при нормальных условиях. Эффективный диаметр молекул кислорода принять равным 0,36 нм.
2.44. Определить массу азота, прошедшего вследствие диффузии через площадку 50 см2 за 20 с, если градиент плотности в направлении, перпендикулярном площадке, равен 1 кг/м4, температура азота 290 К, а средняя длина свободного пробега его молекул равна 1 мкм.
2.45. Определить, во сколько раз отличаются коэффициенты динамической вязкости углекислого газа и азота, если оба газа находятся при одинаковых темепературе и давлении. Эффективные диаметры молекул этих газов считать равными.
2.46. Азот находится под давлением 100 кПа при температуре 290 К. Определить коэффициенты диффузии и внутреннего трения. Эффективный диаметр молекул азота равен 0,38 нм.
2.47. Найти среднюю длину свободного пробега молекул гелия при давлении 101,3 кПа и температуре 273 К, если вязкость гелия 13 мкПа . с.
2.48. Найти теплопроводность водорода, вязкость которого 8,6 мкПа . с.
2.49. В сосуде объемом 2 л находится  молекул двухатомного газа. Теплопроводность газа 14 мВт/(м . К). Найти коэффициент диффузии газа.
молекул двухатомного газа. Теплопроводность газа 14 мВт/(м . К). Найти коэффициент диффузии газа.
2.50. Найти добавочное давление р внутри мыльного пузыря диаметром  см и определить работу А, которую нужно совершить, чтобы выдуть этот пузырь. Поверхностное натяжение мыльной воды
см и определить работу А, которую нужно совершить, чтобы выдуть этот пузырь. Поверхностное натяжение мыльной воды  мН/м.
мН/м.
2.51. Определить изменение свободной энергии  поверхности мыльного пузыря при изобарическом увеличении его объема от
поверхности мыльного пузыря при изобарическом увеличении его объема от  см3 до
см3 до  см3. Поверхностное натяжение мыльной воды
см3. Поверхностное натяжение мыльной воды  мН/м.
мН/м.
2.52. Из вертикальной трубки внутренним радиусом 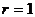 мм вытекают капли воды. Найти радиус капли в момент отрыва. Каплю считать сферической. Диаметр шейки капли в момент отрыва считать равным внутреннему диаметру трубки. Плотность
мм вытекают капли воды. Найти радиус капли в момент отрыва. Каплю считать сферической. Диаметр шейки капли в момент отрыва считать равным внутреннему диаметру трубки. Плотность  г/см3, поверхностное натяжение
г/см3, поверхностное натяжение  Н/м.
Н/м.
2.53. На сколько нагреется капля ртути, полученная от слияния двух капель радиусом 1 мм каждая? Плотность ртути 13,6 г/см3, поверхностное натяжение 0,5 Н/м, удельная теплоемкость 138  .
.
2.54. Какую работу против сил поверхностного натяжения надо совершить, чтобы разбить сферическую каплю ртути радиусом 3 мм на две одинаковые капли? Поверхностное натяжение ртути принять равным 0,5 Н/м.
2.55. Какую работу против сил поверхностного натяжения надо совершить, чтобы увеличить вдвое объем мыльного пузыря радиусом 1 см? Коэффициент поверхностного натяжения мыльного раствора принять равным 0,043 Н/м.
2.56. Давление воздуха внутри мыльного пузыря на  Па больше атомсферного. Чему равен диаметр пузыря? Поверхностное натяжение мыльного раствора принять равным 0,043 Н/м.
Па больше атомсферного. Чему равен диаметр пузыря? Поверхностное натяжение мыльного раствора принять равным 0,043 Н/м.
2.57. В сосуд с ртутью опущен открытый капилляр, внутренний диаметр которого  мм. Разность уровней ртути в сосуде и в капилляре
мм. Разность уровней ртути в сосуде и в капилляре  мм. Чему равен радиус кривизны ртутного мениска в капилляре? Плотность ртути 13,6 г/см3, поверхностное натяжение 0,5 Н/м.
мм. Чему равен радиус кривизны ртутного мениска в капилляре? Плотность ртути 13,6 г/см3, поверхностное натяжение 0,5 Н/м.
2.58. На какую высоту поднимется бензол в капилляре, внутренний диаметр которого равен  мм? Смачивание считать полным. Плотность бензола и его поверхностное натяжение соответственно равны 0,88 г/см3 и 0,03 Н/м.
мм? Смачивание считать полным. Плотность бензола и его поверхностное натяжение соответственно равны 0,88 г/см3 и 0,03 Н/м.
2.59. Какую силу надо приложить, чтобы оторвать друг от друга (без сдвига) две смоченные фотопластинки размером 9 х 12 см? Толщину водяной прослойки между пластинками считать равной 0,05 мм. Смачивание полное. Поверхностное натяжение воды принять равным 0,073 Н/м.
2.60. Между двумя вертикальными плоскопараллельными стеклянными пластинками, находящимися на расстоянии 0,25 мм друг от друга, налита жидкость. Найти плотность жидкости, если известно, что высота поднятия жидкости между пластинками равна 3,1 см. Поверхностное натяжение жидкости равно 0,03 Н/м. Смачивание полное.
Электричество
Электростатика
Основные законы и формулы
1. Сила взаимодействия между двумя точечными зарядами выражается законом Кулона:
 ,
,
где q1q2 – величина точечных зарядов, заряд измеряется в Кулонах (Кл); 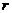 – расстояние между точечными зарядами;
– расстояние между точечными зарядами;  – электрическая постоянная;
– электрическая постоянная;  ,
, 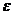 – диэлектрическая проницаемость среды.
– диэлектрическая проницаемость среды.
2. Закон сохранения электрического заряда для изолированной системы:
q1+q2+…..+qn=const.
3. Сила, действующая на заряд q со стороны электрического поля:
F=qE,
где Е – напряженность электрического поля.
4. Напряженность электрического поля:
 ,
,



 ,
, его внутренней энергии и на работу А, совершаемую газом против внешних сил;
его внутренней энергии и на работу А, совершаемую газом против внешних сил; )
) ,
,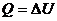 ,
, ;
; )
)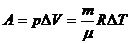 ,
,
 ;
; )
)
 ,
, ,
, ,
, ,
, .
. .
. ,
, ,
, .
. характеризует степень использования теплоты при превращении ее в работу или, другими словами, совершенство цикла, по которому работает тепловой двигатель:
характеризует степень использования теплоты при превращении ее в работу или, другими словами, совершенство цикла, по которому работает тепловой двигатель: ,
,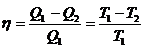 ,
, , (1)
, (1) , (2)
, (2) – изменение свободной энергии поверхностного слоя жидкости, связанное с изменением
– изменение свободной энергии поверхностного слоя жидкости, связанное с изменением  поверхности этого слоя.
поверхности этого слоя. ,
, .
. ,
, , R – радиус канала трубки,
, R – радиус канала трубки,  – плотность жидкости, g – ускорение свободного падения.
– плотность жидкости, g – ускорение свободного падения. моль азота и
моль азота и 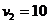 моль кислорода, которая содержится в баллоне при температуре t =170С и давлении
моль кислорода, которая содержится в баллоне при температуре t =170С и давлении  МПа.
МПа. , (1)
, (1) ,
,  (2)
(2) ,
, . (3)
. (3) . (4)
. (4) кг/м3=31,8 кг/м3.
кг/м3=31,8 кг/м3. , (1)
, (1) – количество вещества,
– количество вещества, 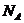 – постоянная Авогадро.
– постоянная Авогадро. кг/моль,
кг/моль,  моль-1.
моль-1. .
. одного атома массу газа разделим на число атомов в нем:
одного атома массу газа разделим на число атомов в нем: . (2)
. (2) кг
кг  кг.
кг. г при температуре
г при температуре 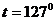 С идеальным газом, определить: 1) внутреннюю энергию пара; 2) среднюю энергию вращательного движения одной молекулы этого пара.
С идеальным газом, определить: 1) внутреннюю энергию пара; 2) среднюю энергию вращательного движения одной молекулы этого пара.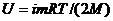 , (1)
, (1)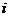 – число степеней свободы молекулы газа; М – молярная масса; R – молярная газовая постоянная; Т – термодинамическая температура.
– число степеней свободы молекулы газа; М – молярная масса; R – молярная газовая постоянная; Т – термодинамическая температура.
 ,
, .
. Дж/К;
Дж/К;  , так как вращательному движению трехатомной молекулы соответствуют три степени свободы.
, так как вращательному движению трехатомной молекулы соответствуют три степени свободы.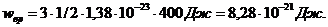
 г изобарно расширяется под давлением
г изобарно расширяется под давлением  Па от начальной температуры
Па от начальной температуры 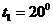 С, поглощая в процессе расширения теплоту
С, поглощая в процессе расширения теплоту  кДж. Определить: 1) работу расширения газа; 2) конечный объем газа.
кДж. Определить: 1) работу расширения газа; 2) конечный объем газа. . (1)
. (1) ,
,  ), выразим неизвестные начальный V1 и конечный V2 объемы:
), выразим неизвестные начальный V1 и конечный V2 объемы: ; (2)
; (2) . (3)
. (3) , (4)
, (4)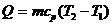 ,
, . (5)
. (5) , (6)
, (6) . (7)
. (7)
 (8)
(8)
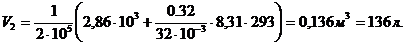
 см.
см. , (1)
, (1)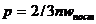 , (2)
, (2) , (3)
, (3) , (4)
, (4) .
.
 , (5)
, (5)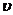 – средняя арифметическая скорость молекул. Ее можно определить по формуле:
– средняя арифметическая скорость молекул. Ее можно определить по формуле: , (6)
, (6) . (7)
. (7) .
. Па, если плотность газа
Па, если плотность газа  кг/м3.
кг/м3.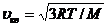 , (1)
, (1) ,
, . (2)
. (2) из (2) в (1), получим:
из (2) в (1), получим: . (3)
. (3) = 389 м/с.
= 389 м/с.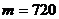 мг, если коэффициент диффузии
мг, если коэффициент диффузии 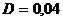 см2/с.
см2/с. , (1)
, (1) – градиент плотности, т.е. изменение плотности, приходящееся на 1 м толщины слоя почвы; S – площадь поверхности слоя; t – длительность диффузии.
– градиент плотности, т.е. изменение плотности, приходящееся на 1 м толщины слоя почвы; S – площадь поверхности слоя; t – длительность диффузии. . (2)
. (2) кг/м4= –0,05кг/м4.
кг/м4= –0,05кг/м4. м2 за время
м2 за время  мин, если в помещении температура стены
мин, если в помещении температура стены  С, а снаружи
С, а снаружи 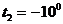 С. Толщина стен
С. Толщина стен 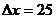 см.
см. , (1)
, (1) – теплопроводность материала стены;
– теплопроводность материала стены; 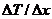 – градиент температуры, т. е. изменение температуры, приходящееся на 1 м толщины стены; S – площадь поверхности стены; t – время передачи теплоты.
– градиент температуры, т. е. изменение температуры, приходящееся на 1 м толщины стены; S – площадь поверхности стены; t – время передачи теплоты.
 С, был адиабатно сжат так, что его объем уменьшился в три раза. Определить температуру воздуха после сжатия.
С, был адиабатно сжат так, что его объем уменьшился в три раза. Определить температуру воздуха после сжатия. , (1)
, (1)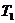 ,
, 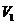 – соответственно термодинамическая температура и объем до сжатия воздуха;
– соответственно термодинамическая температура и объем до сжатия воздуха;  ,
,  – те же величины после сжатия воздуха;
– те же величины после сжатия воздуха;  – отношение теплоемкости газа при постоянном давлении к теплоемкости газа при постоянном объеме.
– отношение теплоемкости газа при постоянном давлении к теплоемкости газа при постоянном объеме. ,
, и, следовательно,
и, следовательно, .
. . (2)
. (2) К,
К,  ,
, 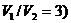 в (2):
в (2): .
. .
.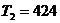 К, или
К, или 
 С. Определить температуру холодильника, если ¾ теплоты, полученной от нагревателя, газ отдает холодильнику.
С. Определить температуру холодильника, если ¾ теплоты, полученной от нагревателя, газ отдает холодильнику.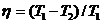 , (1)
, (1)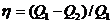 , (2)
, (2) – теплота, полученная газом от нагревателя;
– теплота, полученная газом от нагревателя;  – теплота, отданная газом холодильнику.
– теплота, отданная газом холодильнику. . (3)
. (3) , откуда
, откуда . (4)
. (4) ,
,  в (4) и вычислим:
в (4) и вычислим: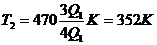 , или
, или 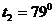 С.
С. см3, зачерпнутом из этого озера, если считать, что соль, растворившись, равномерно распределилась по всему объему озера?
см3, зачерпнутом из этого озера, если считать, что соль, растворившись, равномерно распределилась по всему объему озера? 3 см; 2) расстояние между центрами соседних атомов.
3 см; 2) расстояние между центрами соседних атомов.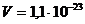 см3, найти, какой процент от всего пространства, занятого водой, приходится на долю самих молекул.
см3, найти, какой процент от всего пространства, занятого водой, приходится на долю самих молекул. см, оценить, какой длины получилась бы нить, если все молекулы, содержащиеся в m= 1,0 мг кислорода, были расположены в один ряд, вплотную друг другу. Во сколько раз длина этой нити оказалась бы больше среднего расстояния от Земли до Луны?
см, оценить, какой длины получилась бы нить, если все молекулы, содержащиеся в m= 1,0 мг кислорода, были расположены в один ряд, вплотную друг другу. Во сколько раз длина этой нити оказалась бы больше среднего расстояния от Земли до Луны? средняя квадратичная скорость его молекул увеличилась с
средняя квадратичная скорость его молекул увеличилась с  до
до  =500 м/с. На сколько нужно нагреть газ, чтобы увеличить среднюю квадратичную скорость его молекул с
=500 м/с. На сколько нужно нагреть газ, чтобы увеличить среднюю квадратичную скорость его молекул с 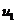 =500 м/с до u2=600 м/с?
=500 м/с до u2=600 м/с? =10 К при постоянном давлении увеличился на n=3% от своего первоначального объема. Определить начальную температуру газа.
=10 К при постоянном давлении увеличился на n=3% от своего первоначального объема. Определить начальную температуру газа. г, с другой – азот массой
г, с другой – азот массой  г. Какую часть объема цилиндра занимает водород?
г. Какую часть объема цилиндра занимает водород?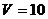 л нагнетается водород при температуре
л нагнетается водород при температуре  К. Сколько водорода можно поместить в баллон, если допустимое давление на стенки баллона
К. Сколько водорода можно поместить в баллон, если допустимое давление на стенки баллона  МПа?
МПа? Па, а во втором
Па, а во втором  Па. Температура в сосудах одинакова. Какое установится давление после открытия крана?
Па. Температура в сосудах одинакова. Какое установится давление после открытия крана?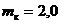 г и азот массой
г и азот массой 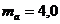 г. Каково давление смеси при температуре
г. Каково давление смеси при температуре  К?
К? л находится смесь кислорода и углекислого газа. Масса смеси
л находится смесь кислорода и углекислого газа. Масса смеси 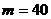 г, температура
г, температура  К, давление
К, давление 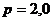 МПа. Найти массу каждого из газов.
МПа. Найти массу каждого из газов. г. Объем сосуда
г. Объем сосуда  л, давление в нем
л, давление в нем  кПа и температура
кПа и температура 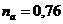 массы, а на долю кислорода
массы, а на долю кислорода  (если пренебречь примесями других газов). Вычислить молярную массу воздуха.
(если пренебречь примесями других газов). Вычислить молярную массу воздуха. м/с, пробила стенку. Определить, на сколько градусов нагрелась пуля, если после стенки скорость ее снизилась до
м/с, пробила стенку. Определить, на сколько градусов нагрелась пуля, если после стенки скорость ее снизилась до 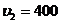 м/с. Считать, что на нагревание пули пошло 50% выделившейся теплоты.
м/с. Считать, что на нагревание пули пошло 50% выделившейся теплоты. км пути при скорости
км пути при скорости  км/ч. Мощность мотора
км/ч. Мощность мотора  кВт, коэффициент полезного действия
кВт, коэффициент полезного действия  %.
%. кг на
кг на  км пути. Определить мощность N, развиваемую двигателем, если скорость движения
км пути. Определить мощность N, развиваемую двигателем, если скорость движения  км/ч и КПД двигателя
км/ч и КПД двигателя  %.
%. т по дороге с подъемом
т по дороге с подъемом  м на
м на  м пути по сравнению с расходом бензина на горизонтальной дороге. КПД двигателя
м пути по сравнению с расходом бензина на горизонтальной дороге. КПД двигателя  км/ч, расходуя при этом бензин массой
км/ч, расходуя при этом бензин массой 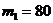 г на
г на  км/ч? Какую мощность он при этом разовьет? Сила сопротивления пропорциональна скорости, КПД двигателя
км/ч? Какую мощность он при этом разовьет? Сила сопротивления пропорциональна скорости, КПД двигателя  %.
%. м2 ее поверхности за время
м2 ее поверхности за время  кг. Коэффициент диффузии
кг. Коэффициент диффузии  ч через площадь поверхности
ч через площадь поверхности  кДж. Температура на поверхности почвы
кДж. Температура на поверхности почвы 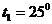 С, в нижнем слое почвы
С, в нижнем слое почвы  С.
С. ч, если температура на его поверхности
ч, если температура на его поверхности  С, а на глубине
С, а на глубине 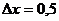 м –
м –  С?
С? ч через поверхность почвы площадью
ч через поверхность почвы площадью  см2, если коэффициент диффузии
см2, если коэффициент диффузии  см2/с. Плотность газа на глубине
см2/с. Плотность газа на глубине  г/см3, а у поверхности
г/см3, а у поверхности  г/см3.
г/см3. молекул двухатомного газа. Теплопроводность газа 14 мВт/(м . К). Найти коэффициент диффузии газа.
молекул двухатомного газа. Теплопроводность газа 14 мВт/(м . К). Найти коэффициент диффузии газа. см и определить работу А, которую нужно совершить, чтобы выдуть этот пузырь. Поверхностное натяжение мыльной воды
см и определить работу А, которую нужно совершить, чтобы выдуть этот пузырь. Поверхностное натяжение мыльной воды  мН/м.
мН/м. см3 до
см3 до  см3. Поверхностное натяжение мыльной воды
см3. Поверхностное натяжение мыльной воды 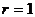 мм вытекают капли воды. Найти радиус капли в момент отрыва. Каплю считать сферической. Диаметр шейки капли в момент отрыва считать равным внутреннему диаметру трубки. Плотность
мм вытекают капли воды. Найти радиус капли в момент отрыва. Каплю считать сферической. Диаметр шейки капли в момент отрыва считать равным внутреннему диаметру трубки. Плотность  г/см3, поверхностное натяжение
г/см3, поверхностное натяжение  Н/м.
Н/м. .
. Па больше атомсферного. Чему равен диаметр пузыря? Поверхностное натяжение мыльного раствора принять равным 0,043 Н/м.
Па больше атомсферного. Чему равен диаметр пузыря? Поверхностное натяжение мыльного раствора принять равным 0,043 Н/м. мм. Разность уровней ртути в сосуде и в капилляре
мм. Разность уровней ртути в сосуде и в капилляре  мм. Чему равен радиус кривизны ртутного мениска в капилляре? Плотность ртути 13,6 г/см3, поверхностное натяжение 0,5 Н/м.
мм. Чему равен радиус кривизны ртутного мениска в капилляре? Плотность ртути 13,6 г/см3, поверхностное натяжение 0,5 Н/м. мм? Смачивание считать полным. Плотность бензола и его поверхностное натяжение соответственно равны 0,88 г/см3 и 0,03 Н/м.
мм? Смачивание считать полным. Плотность бензола и его поверхностное натяжение соответственно равны 0,88 г/см3 и 0,03 Н/м. ,
,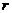 – расстояние между точечными зарядами;
– расстояние между точечными зарядами;  – электрическая постоянная;
– электрическая постоянная;  ,
, 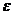 – диэлектрическая проницаемость среды.
– диэлектрическая проницаемость среды. ,
,


