

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
Топ:
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
Изобарный процесс (р = const)
dQP = dA + dU = р dV + dU;
A = р (V2 - V1) = р DV; A = р V2 - р V1 = n RT2 – n RT1 = n RDТ.
р 1 2
V1 V2 V График изобарного расширения (сжатия) идеального газа | На рис. приведен график изобарного расширения или сжатия. Работа равна площади прямоугольника. QP = DU + р DV; Qp = QV + р DV; Qp - QV = р DV. Разность теплот изобарного и изохорного процессов равна работе изобарного расширения или сжатия. |
dQp = dQV + р dV.
Продифференцируем это выражение по Т:
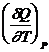 =
= 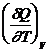 +
+ 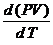 =
= 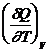 +
+ 
(так как р V = RT для 1 моля идеального газа).
C р = СV + R; C р - CV = R - уравнение Майера.
Изотермический процесс (T = const)
dU = CV dT = 0.
Внутренняя энергия идеального газа в изотермическом процессе остается без изменения.
р 1
V1 V2 V График изотермического расширения (сжатия) идеального газа | р V = RT = const для изотермы.
dA = р dV;
A = 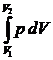 = = 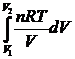 ;
А = n RT ln ;
А = n RT ln  = n RT ln = n RT ln 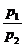 .
dU = 0, DU = 0, Q = A.
Теплота изотермического процесса равна работе процесса. .
dU = 0, DU = 0, Q = A.
Теплота изотермического процесса равна работе процесса.
|
Закон Гей-Люссака – Джоуля: внутренняя энергия идеального газа не зависит от давления и объема, а зависит только от температуры.
Адиабатический процесс (dQ = 0, Q = 0)
Это процесс, протекающий без теплообмена между системой и окружающей средой.
р dV + CV dT = 0.
 dV + CV dT = 0 /: T;
dV + CV dT = 0 /: T;
R 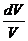 + CV
+ CV 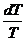 = 0.
= 0.
R = C р - CV Þ (C р - CV) 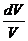 + CV
+ CV 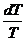 = 0 /: CV;
= 0 /: CV;
(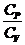 - 1)
- 1) 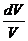 +
+ 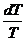 = 0,
= 0, 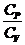 = g.
= g.
После интегрирования ln Vg-1 + ln T = const, ln TVg-1 = const.
TVg-1 = const¢. (1)
T = 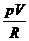 ,
, 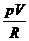 Vg-1 = const¢;
Vg-1 = const¢;
р Vg = const¢¢. (2)
Уравнения (1) и (2) - уравнения адиабаты (уравнения Пуассона).
Работа при адиабатическом процессе:
dA + CV dT = 0, dA = - CV dT, A = - 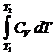 = CV (T1 - T2).
= CV (T1 - T2).
A > 0 при расширении Þ Т падает при адиабатическом расширении, то есть работа адиабатического расширения совершается за счет уменьшения внутренней энергии. При адиабатическом сжатии U увеличивается, Т растет.
A = CV (T1 - T2) = CV ( -
- 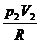 ) =
) = 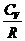 (р 1V1 - р 2V2);
(р 1V1 - р 2V2);
A = 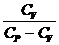 (р 1V1 - р 2V2) =
(р 1V1 - р 2V2) = 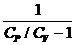 (р 1V1 - р 2V2) =
(р 1V1 - р 2V2) = 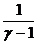 (р 1V1 - р 2V2).
(р 1V1 - р 2V2).
 р
изотерма
адиабата
V1 V2 V
Графики изотермического и адиабатического процессов в идеальном газе р
изотерма
адиабата
V1 V2 V
Графики изотермического и адиабатического процессов в идеальном газе
|
Сравним: р Vg = const¢¢ (адиабата) и р V = const (изотерма):
р = 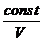 и р = и р = 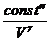 .
Адиабата идет круче, чем изотерма. .
Адиабата идет круче, чем изотерма.
|
Энтальпия
Энтальпия Н - это сумма внутренней энергии (U) и внешней (р V):
H = U + р V.
DH = DU + D(р V); при р = const DН = DU + р DV.
Изменение энтальпии в изобарном процессе включает в себя изменение внутренней и внешней энергии, причем изменение внешней энергии равно работе изобарного расширения (сжатия). U - функция состояния; р и V - параметры состояния, их изменение не зависит от пути процесса. Следовательно, энтальпия - также функция состояния, так как ее изменение не зависит от пути процесса.
Если процесс идет при р = const:
dQP = dU + р dV = dU + d (р V) = d (U + р V) = dH.
Тепло, передаваемое системе при р = const, расходуется на приращение энтальпии.
dQP = dH, QP = DH.
Теплота, поглощаемая при р = const, также не зависит от пути процесса.
Если процесс изобарно-изотермический, то DU = 0 и DH = р DV.
C р = 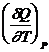 =
=  , dH = C р dT, DH = C р DT.
, dH = C р dT, DH = C р DT.
Введение энтальпии упрощает математическое выражение изобарного процесса. Кроме того, изменение Н может быть во многих случаях легко измерено, вследствие чего эта функция широко применяется при термодинамических исследованиях, особенно изобарных процессов.
Абсолютное значение энтальпии не может быть вычислено с помощью уравнений термодинамики, так как оно включает в себя абсолютную величину внутренней энергии.
2. Энтропия в случае равновесных и неравновесных процессов. Условия равновесия в изолированной системе
Для КПД цикла Карно было получено следующее уравнение:
h =  =
= 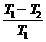 ; 1 -
; 1 - 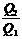 = 1 -
= 1 - 
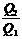 =
=  или
или 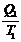 -
- 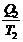 = 0
= 0
Отношение Q/Т - приведенная теплота. Вышеприведенная запись означает: алгебраическая сумма приведенных теплот по обратимому циклу Карно равна нулю.
 Понятие о б/м циклах Карно:
1. Бесконечно мала изотерма, конечна адиабата Понятие о б/м циклах Карно:
1. Бесконечно мала изотерма, конечна адиабата
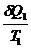 - - 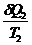 = 0
dQ/Т - элементарная приведенная теплота
2. Бесконечно мала адиабата, конечна изотерма = 0
dQ/Т - элементарная приведенная теплота
2. Бесконечно мала адиабата, конечна изотерма
 = = 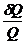 = = 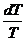
|  P dQ1, T1
Q, T
Q - dQ, T - dT P dQ1, T1
Q, T
Q - dQ, T - dT
  dQ2, T2
V
dQ2, T2
V
|

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!