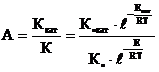Катализом называется изменение скорости химической реакции под действием особых ускорителей – катализаторов. Катализ – явление физико- химическое, тесно связанное со скоростью и с механизмом химических реакций. Практическое значение катализа очень велико. Его применение давно стало необходимостью в нефтехимической и химической промышленности, в производстве синтетических каучуков и смол, смазочных веществ, растворителей, лекарственных препаратов и т.д.
Катализатором является вещество, которое ускоряет определенную реакцию, непосредственно участвуя в ней, но после окончания реакции выделяется вновь в неизменном виде; катализатор лишь ускоряет реакцию, но не смещает термодинамического равновесия реакции в сторону образования целевого продукта. В настоящее время различаются три основные группы каталитических процессов: гомогенные, гетерогенные и ферментативные. Последние протекают в биологических системах под воздействием ферментов. В гомогенном катализе наиболее существенную роль играет характер среды (в основном жидкая фаза); в гетерогенном – поверхность катализатора, в ферметативном – активная группа атомов, соединенная с носителем.
В любом случае сущность катализа заключается в образовании промежуточных активированных комплексов субстрата с катализатором. Это вызывает перераспределение электронной плотности в молекуле субстрата и делает её реакционно-способной.
Любой каталитический процесс является равновесным процессом. Образование промежуточного активированного комплекса, а затем перегруппировка связей в нем требуют затрат энергии активации. Распад промежуточного комплекса связан с увеличением энтропии, т.е. термодинамически возможен и самопроизволен.
Гомогенные катализаторы, как правило, очень активны, но они имеют и определенные недостатки: сложность отделения катализатора от реакционной массы (отмывка, отгонка), при котором может образоваться большое количество токсичных или загрязненных сточных вод; сложность регенерации, что увеличивает долю катализатора в себестоимости продукции; коррозионность.
В связи с этим имеется тенденция перехода к гетерогенным катализаторам. В настоящее время принята следующая классификация гомогенных каталитических реакций в зависимости от природы катализатора и среды:
1) общий кислотно-основный катализ;
2) специфический кислотно-основный катализ;
Кроме этих основных типов гомогенного катализа выделен еще один тип процессов – электрофильный и нуклеофильный катализ. Встречаются и смешанные реакции. Гомогенный металлокомплексный катализ начал развиваться относительно недавно – с середины ХХ в. как специфические каталитические процессы в технологии органических веществ и синтезе полимерных материалов.
Гомогенный металлокомплексный катализ имеет ряд преимуществ перед гетерогенными каталитическими процессами: высокую активность (скорость), так как каждая молекула катализатора является активным центром; высокую селективность, так как катализатор в отличие от гетерогенного имеет только один тип активных центров; меньшую чувствительность к каталитическим ядам.
К недостаткам катализаторов подобного типа следует отнести трудности с выделением из гомогенной среды и относительно низкую термическую устойчивость. Гетерогенный катализ имеет большое значение в промышленности. С его помощью осуществляются дегидрирование (стирола, дивинила), гидрирование (циклогексана, аминов), окисление (оксида этилена), а также гидратация, алкилирование.
Гетерогенный катализ имеет ряд преимуществ перед гомогенными, которые состоят в малом расходе катализатора на единицу количества продукта, снижении качества или устранении сточных вод, отсутствии расходов на выделение катализатора из раствора (он легко отделяется от реакционной массы или не захватывается ею), опасности коррозии, продолжительности использования. Катализатор представляет собой носитель (основу), на который различными методами нанесена активная часть.
По способу осуществления гетерогенно-каталитические процессы можно разделить на три разновидности:
- со стационарным неподвижным катализатором (зерна катализатора диаметром 3…10 мм);
- с подвижным шариковым катализатором, перемещаемым по зонам реактора механическим транспортиром;
- с плавающим пылевидным (диаметр зерен 1…2мм) катализатором.
Катализатор должен отвечать ряду требований:
1) высокая каталитическая активность;
2) достаточно большая селективность по целевому продукту;
3) простота получения, обеспечивающая воспроизводимость каталитических свойств;
4) достаточная стабильность свойств и способность к регенерации, т.е. к восстановлению активности;
5) высокая механическая прочность при сжатии: ударе, истирании;
6) небольшие экономические затраты на единицу продукции.
Сумма требований к катализатору определяет и способ его получения. В зависимости от способа получения различают катализаторы: осажденные (соли, оксиды); на носителях (соли, оксиды, металлы); природные (силикаты, алюмосиликаты); плавленые (металлы, оксиды, металлические сетки и спирали).
Большое влияние на свойства катализатора оказывает способ его получения. Способы получения катализатора делятся на мокрые и сухие.
Эффективность использования катализаторов в промышленных гетерогенно-каталитических процессах существенно зависит от их технологических характеристик: активности, температуры зажигания, селективности действия, устойчивости к ядам, пористости, механической прочности, теплопроводности, доступности и дешевизны.
Активностью катализатора (А) называется степень его ускоряющего воздействия на данную химическую реакцию. Она определяется как соотношение констант скоростей каталитической Ккат и некаталитической К реакцией:
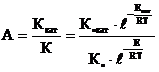
Температурой зажигания катализатора Тзаж называется минимальная температура, при которой процесс начинает протекать с достаточной для технологических целей скоростью. Чем выше активность катализатора, тем ниже температура его зажигания.
Селективностью катализатора называется его способность избирательно ускорять одну из реакций, если в системе термодинамически возможно протекание нескольких реакций.
Пористость катализатора характеризует его удельную поверхность и влияет на площадь поверхности контакта катализатора с реагентами.
Механическая прочность контактной массы должна быть такой, чтобы она не разрушалась под воздействием собственной массы в аппаратах с неподвижным слоем катализатора и не истиралась в аппаратах с движущимся слоем катализатора и аппаратах с «кипящим» слоем катализатора.
Устойчивость к контактным ядам является важнейшей характеристикой, определяющей возможность отравления катализатора. Отравление катализатора – это частичная или полная потеря активности под действием небольшого количества веществ, называемых контактными ядами.
Контрольные вопросы
1. Каким образом определяют порядок реакции?
2. Что связывает кинетическое уравнение реакции?
3. Влияние концентрации на скорость реакции в гомогенном процессе?
4. Как влияет температура на увеличение скорости процесса в гомогенном ХТП?
5. Что называется энергией активации?
6. Влияние давления на скорость реакции в гомогенном ХТП?
7. Какие процессы называют гетерогенными?
8. Что такое «лимитирующая стадия реакции» и для чего необходимо её знать?
9. Перечислите основные стадии гетерогенного процесса, с участием пористого вещества и газа?
10. Перечислите основные признаки протекания процесса во внешнедиффузионной, внутридиффузионной и кинетической областях?
11. Что называется катализом?
12. Какие вещества называют катализаторами?
13. Перечислите основные группы каталитических процессов?
14. В чем заключается сущность действия катализаторов?
15. Каковы достоинства и недостатки гомогенных катализаторов?
16. Каким образом классифицируют гомогенно каталитические реакции в зависимости от природы катализатора и среды?
17. Каковы достоинства и недостатки гетерогенных катализаторов?
18. Какие требования предъявляются к катализаторам?
19. Какие основные технологические характеристики твердых катализаторов вы знаете?
Дополнительная литература
1. Сороко В.Е. и др. Основы химической технологии. – Л: Химия, 1986
2. Москвичев Ю.А. и др. Теоретические основы химической технологии. – М: Академия, 2005
3. Кутепов А.М. и др. Общая химическая технология. – М.: Высшая школа, 1990.