Студент должен:
знать:
- определение и структуру ХТС;
- основные направления совершенствования ХТС;
уметь:
- читать технологическую схему;
- изображать технологическую схему по краткому описанию;
- давать краткое описание аппаратурной технологической системы.
Систему аппаратов с различным функциональным назначением, взаимосвязанных материальными и энергетическими потоками и действующих как единое целое с целью выпуска товарной продукции заданного качества, называют химико-технологической системой (ХТС). Структуру ХТС образуют входящие в ее состав элементы и связи между ними. Элементами ХТС являются отдельные аппараты. Связи между элементами выступают в виде трубопроводов, по которым передаются материальные и тепловые потоки.
Каждый элемент ХТС выполняет определенные функции по преобразованию параметров входящих в него потоков в параметры выходящих потоков. Типовые технологические операторы – это элементы химического превращения, теплообмена, массообмена, смесители и делители потоков, устройства для повышения и понижения давления, изменения агрегатного состояния вещества. Условные изображения этих элементов приведены на рис. 3.1.
| | | | | | | | | | | | | | | | | | | |
| | |  |
| | | |  |
| | | | | Элемент химического превращения
| |
| | | | | | |
| |
| |
| |
| | |  |
| | | | | Элемент сжатия или расширения
| |
| | | | |
| | | | |  |
| |
| |
| | | | Элемент изменения фазового состояния вещества
| |
| |  |
| | |  |
| |
| |
| |
| | | |
| | |  |
| |
| Элемент изменения фазового состояния вещества
| |
Рис. 3.1. Условные обозначения типовых технологических операторов
Параметрами состояния технологических потоков являются расход, температура, концентрации компонентов, давление и другие характеристики.
Связи между аппаратами внутри ХТС называют внутренними связями, связи между аппаратами различных ХТС и внешней средой – внешними связями.
Способы отображения структуры ХТС
Структуру ХТС, т.е. все элементы и способ их соединения между собой, чаще всего изображают с помощью структурных, технологических или операторных схем. На структурной схеме все элементы ХТС графически представлены в виде блоков, имеющих несколько входов и выходов материальных и тепловых потоков. Технологическая схема более информативна. На ней все элементы ХТС представлены в виде условных стандартных изображений, позволяющих получить информацию о принципиальном устройстве основных аппаратов и даже о соотношении размеров.
Еще большую информацию несет операторная схема ХТС. На такой схеме каждый аппарат изображается в виде нескольких типовых технологических операторов.
Основные типы связей между элементами ХТС
Связи между аппаратами бывают различных типов: последовательная, последовательно-обводная, параллельная, обратная, перекрестная.
Последовательная связь характеризуется тем, что входящий из предшествующего элемента поток является входящим для последующего элемента, и все технологические потоки проходят через каждый элемент не более одного раза.
Последовательно-обводная технологическая связь, ее часто называют байласной, характеризуется тем, что часть технологического потока минует один или несколько аппаратов по ходу технологической схемы. Байлас позволяет эффективно управлять температурным и концентрационным режимом работы аппаратов.
Параллельную технологическую связь применяют для повышения производительности, увеличения ассортимента продуктов, получаемых на основе одного сырья. Характеризуется параллельная технологическая связь тем, что устанавливают два или более одинаковых параллельно работающих элемента.
Обратная технологическая связь характеризуется наличием обратного технологического потока, связывающего выход какого-либо последующего элемента с входом одного из предыдущих элементов ХТС.
Этот вид связи предусматривает многократное возвращение в один и тот же элемент ХТС непрореагировавшей части одного или всех реагентов. Примерами такой ХТС может служить синтез аммиака.
Перекрестная технологическая связь. Этот вид технологической связи является вспомогательным и встречается практически во всех сложных ХТС. Перекрестную связь применяют главным образом для обеспечения эффективного использования энергии. Так, введение в ХТС теплообменников с перекрестной связью позволяет использовать теплоту продуктов химической реакции для предварительного нагрева исходной смеси реагентов, поступающих в реактор.
Контрольные вопросы
1. Что такое химико-технологические системы?
2. Что называют элементами ХТС?
3. Что такое типовые технологические операторы и их условные обозначения?
4. Какие способы отображения структуры ХТС вы знаете?
5. Какие основные типы связей между элементами ХТС вы знаете?
Дополнительная литература
1. Сороко В.Е. Основы химической технологии. – Л.: Химия, 1986.
Тема 3.2. Производство серной кислоты
Студент должен:
знать:
- свойства и применение химического продукта;
- способы получения;
- сырье для получения химического продукта;
- теоретические основы производства.
Серная кислота – один из важнейших продуктов химической промышленности. Ее применяют в различных отраслях промышленности и сельского хозяйства.
Безводная серная кислота представляет собой маслянистую, тяжелую жидкость. Чистая серная кислота бесцветная, техническая – окрашена примесями в темный цвет; 100%-ная серная кислота кипит при 296,2ºС, кристаллизуется при 10,4ºС. Серная кислота растворяет трехокись серы SO3, образуя олеум. Серная кислота весьма активна. Она растворяет окислы металлов и вытесняет при повышенной температуре все другие кислоты из их солей. Концентрированная серная кислота отнимает воду от других кислот, от кристаллогидратов солей. Это свойство серной кислоты используется в промышленности для осушки газов, для концентрирования разбавленной азотной кислоты.
Серная кислота является сильным водоотнимающим веществом, поэтому при попадании на кожу человека вызывает раздражение и омертвение ткани. При попадании внутрь организма даже в небольших количествах вызывает мучительную смерть. Работать с серной кислотой следует в спецодежде и защитных очках.
Сырьевая база для получения серной кислоты
Сырьем для получения серной кислоты могут служить элементарная сера и различные серосодержащие соединения, из которых можно получать серу или непосредственно оксид серы (IV). Серный колчедан – основное сырье для производства оксида серы (IV) – состоит из минерала пирита FeS2 и примесей. Пирит часто встречается в составе сернистых руд цветных металлов, так называемых полиметаллических рудах. (Чистый пирит содержит 53,5% серы и 46,5% железа). Такие руды перед переработкой разделяют методом флотации на концентраты, обогащенные определенными минералами цветных металлов, и отходы флотации, состоящие главным образом из пирита.
В зависимости от метода обжига и концентрации обжиговых печей серный колчедан применяют в виде кусочков размером 4-8 мм или в виде пыли – флотационный колчедан и отходы от дробления кускового колчедана.
Сера – лучшее сырье для производства оксида серы (IV). При сжигании серы получают оксид серы высокой степени чистоты и высокой концентрации. Элементарную серу получают из серных руд выплавкой (нагреванием в автоклавах).
Большое количество серной кислоты получают из отходящих газов обжиговых печей металлургических заводов, перерабатывающих сульфиды цветных металлов. Однако значительная часть отходящих газов различных заводов имеет низкое содержание оксида серы (IV) (до 3%).
Сырьем для производства сернистого газа служит также сероводород, являющийся побочным продуктом переработки угля и нефти. Сероводород окисляют в оксид серы (IV):

Производство серной кислоты из железного колчедана
Химическая схема получения серной кислоты из железного колчедана включает три последовательные стадии:
1) Окисление дисульфида железа кислородом воздуха:

2) Каталитическое окисление оксида серы (IV) избытком кислорода печного газа:
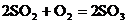
3) Абсорбция оксида серы (VI) с образованием серной кислоты:

Окислительный обжиг железного колчедана в потоке воздуха представляет собой необратимый некаталитический гетерогенный процесс, протекающий с выделением теплоты через стадии термической диссоциации пирита  и окисления продуктов диссоциации
и окисления продуктов диссоциации 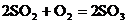 ;
;  , что описывается общим уравнением
, что описывается общим уравнением  .
.
Лимитирующей стадией этого процесса является диффузия кислорода воздуха к неокисленному ядру FeS через пленку окислов железа и обратная диффузия сернистого газа из глубины зерен. Процесс обжига ускоряется с повышением температуры, понижением концентрации SO2, увеличением концентрации кислорода, уменьшением размера частиц и увеличением интенсивности перемешивания колчедана и воздуха. Горение колчедана идет с выделением тепла, достаточного для поддержания высоких температур (автотермично). Обычно на горение колчедана подается в 1,2-1,8 раза воздуха больше, чем это требуется по суммарному уравнению обжига.
В современных сернокислотных системах для обжига колчедана применяют только печи с кипящим слоем[1].
Температуру в печи поддерживают в пределах 650-800ºС. Около 90% образующегося огарка уносится потоком обжигового газа. Эта пыль выделяется сначала в котле-утилизаторе, в циклоне, а затем в электрофильтре. Остаточное содержание серы в огарке составляет 0,5-1,0%.
После очистки и осушки сернистый газ поступает на окисление в контактный аппарата.
2) Окисление оксида серы (IV) протекает по реакции 


Эта реакция экзотермическая, протекающая с уменьшением объема. По принципу Ле-Шателье понижение температуры и повышение давления будут увеличивать процесс окисления SO2 в SO3. Однако даже при сравнительно высоких температурах (500-700ºС) этот процесс в обычных условиях протекает очень медленно и необходимо применять катализатор. В настоящее время в качестве катализатора в контактном способе получения серной кислоты широко используется контактная масса, содержащая в среднем 7% пятиокиси ванадия V2O5. В качестве носителя V2O5 применяют алюмосиликаты.
В производстве серной кислоты контактным методом получили наибольшее распространение полочные контактные аппараты с внутренним теплообменом[2].
Степень окисления SO2 в SO3 достигает 96-98%.
3) Абсорбция трехокиси серы сопровождается химической реакцией 

 .
.
Газообразная трехокись серы лучше всего поглощается 98,3%-ной серной кислотой, при других концентрациях способность кислоты абсорбировать SO2 ухудшается. Это объясняется тем, что при использовании в качестве поглотителя более слабых растворов серной кислоты или воды трехокись серы образует с парами воды туманообразную серную кислоту, трудно улавливаемую абсорбционными методами. При концентрации кислоты свыше 98,3% степень абсорбции SO3 также понижается, так как кислота может сама выделять в газовую фазу трехокись серы. Поглощение трехокиси серы – процесс экзотермический, поэтому газы и кислоту, поступающие в абсорбционное отделение, предварительно охлаждают до 30-40ºС. Процесс абсорбции трехокиси серы является гетерогенным процессом, для увеличения контакта взаимодействующих фаз его осуществляют в абсорберах с насадкой.
Схема производства серной кислоты контактным методом [3]
Пример расчета выхода серной кислоты
Задача. Вычислить максимально возможный выход серной кислоты из 40 т сульфида железа (FeS2). Содержание серы в нем равно 40%.
Решение:
1. Определить содержание серы в колчедане:
40 – 100
х – 40%
х = 16 т
2. Вычислить максимально возможный выход серной кислоты:

 ,
, 
32 – 98
16 – х
х = 49 т
Ответ: Из 40 т FeS2 с содержанием серы 40% максимально возможный выход серной кислоты 49 т.
Контрольные вопросы
1. Какие основные области использования серной кислоты и олеума вы знаете?
2. Что вы можете сказать о сырьевой базе производства серной кислоты?
3. Какие условия необходимо соблюдать при горении FeS2?
4. Почему печные газы (SO2) необходимо очищать от пыли?
5. Перечислите факторы, влияющие на степень превращения SO2 в SO3?
6. Какова роль катализатора на степень превращения SO2 в SO3?
7. Какие условия необходимо соблюдать при поглощении SO3 серной кислотой и олеумом?
8. Чем различаются технологии производства серной кислоты из железного колчедана и серы?
9. Сколько серной кислоты концентрацией 70% получат на башенной установке из 120 т колчедана с содержанием серы 40%?
Дополнительная литература
1. Сороко В.Е. Основы химической технологии. – Л.: Химия, 1986.
2. Общая химическая технология / под ред. Фурмер. – М.: Высшая школа, 1977.
[1] - Сороко В.Е., Вечная С.В., Попова Н.Н. Основы химической технологии. – Л.: Химия, 1986.
[2] - Общая химическая технология / под ред. Фурмер. – М.: Высшая школа, 1977.
[3] - Общая химическая технология / под ред. Фурмер. – М.: Высшая школа, 1977.












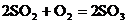

 и окисления продуктов диссоциации
и окисления продуктов диссоциации  , что описывается общим уравнением
, что описывается общим уравнением  .
.



 .
.
 ,
, 


