При проведении химико-технологических процессов необходимо знать предельную теплоту протекания процесса и условия равновесия реакции. Подвижное равновесие поступает тогда, когда скорости прямой и обратной реакции становятся равными. Соотношение компонентов во взаимодействующих системах остается постоянным до тех пор, пока не произойдет изменение внешних условий: температуры, давления, концентрации реагирующих веществ. При изменении внешних условий равновесие нарушается, и в системе самопроизвольно возникают химические и диффузионные процессы – это процессы медленного проникновения или выхода одного вещества в другое вещество, в результате которых устанавливается равновесие в новых условиях.
Принцип Ле-Шателье, согласно которому в системе, выведенной из состояния равновесия, происходят изменения, направленные к ослаблению воздействий, выводящих систему из равновесия. В качестве примера рассмотрим влияние температуры и давления на некоторые обратимые экзотермические и эндотермические реакции:
 (а)
(а)
Реакция (а) является обратимой экзотермической (+Q) протекает в газовой фазе без изменения объема, т.е. объем исходных веществ равен объему получаемых продуктов.
С повышением температуры равновесия этой реакции будет смещаться в сторону исходных веществ (т.е. в левую сторону) и равновесный выход водорода будет уменьшаться. Для смещения равновесия в сторону получения водорода температуру необходимо понижать. Поскольку объем реагирующей системы не изменяется, то давление в этом случае не влияет на равновесие.
Однако степень превращения одного из исходных веществ можно увеличить, взяв другое вещество в избытке по сравнению с количеством, необходимым по реакции. Применительно к рассматриваемой реакции увеличением избытка пара  можно повысить степень окисления СО в
можно повысить степень окисления СО в  и на единицу израсходованной окиси углерода (СО) получить большее количество водорода.
и на единицу израсходованной окиси углерода (СО) получить большее количество водорода.  (б)
(б)
Реакция (б) является обратимой, экзотермической (+Q), протекает в газовой фазе в правую сторону (прямая реакция) с уменьшением объема. На равновесие этой реакции будут влиять температура и давление. Повышение температуры по принципу Ле-Шателье будет смещать равновесие справа налево, т.е. в сторону исходных веществ, давление будет оказывать обратное действие, т.е. смещать слева направо, а следовательно, повышать и выход продукта – аммиака.
 (в)
(в)
Реакция (в) является обратимой, эндотермической (-Q), протекает в газовой фазе с увеличением объема газов. По этой реакции из двух молекул исходных продуктов получают четыре молекулы конечных.
Повышение температуры вызывает смещение равновесия этой реакции слева направо и давления справа налево. Для этой реакции применяют повышенное давление, равновесие смещается в сторону получения водорода.
Зная зависимость равновесия обратимых реакций от различных факторов, влияющих на технологический процесс, можно определить условия, при которых обратимая реакция будет в большей степени направлена в сторону образования продукта реакции. А это в свою очередь позволяет установить максимально возможный выход продукта реакции при данных условиях. Помимо законов равновесия, не менее важно знать кинетику процесса: с какой скоростью протекают взаимодействия исходных веществ и каким законом они подчиняются.
Константа равновесия
Количественно подвижное равновесие характеризуется константой равновесия К, которая равна соотношению констант скоростей прямой и обратимой реакций при равновесии, т.е. когда скорости этих реакций равны. Для реакции nA+mB 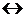 pD+qF скорость прямой реакции:
pD+qF скорость прямой реакции:  ; скорость обратной реакции:
; скорость обратной реакции: 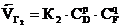 ,
,
где 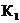 и
и  - константы скоростей прямой и обратной реакции соответственно;
- константы скоростей прямой и обратной реакции соответственно;
 - концентрации веществ А, В, D, F.
- концентрации веществ А, В, D, F.
В момент равновесия 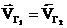 ,
,  ;
;
Тогда константа равновесия будет:  .
.
Для газовых реакций концентрации компонентов могут быть выражены в виде парциальных давлений, тогда 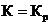 .
.
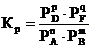 ; где
; где 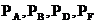 - парциальное давление А, В, D, F соответственно.
- парциальное давление А, В, D, F соответственно.
Константа равновесия есть величина постоянная, зависящая от температуры и не зависящая от общего давления смеси и парциальных давлений исходных компонентов. Зависимость константы равновесия от температуры при постоянном давлении выражается уравнением Вант-Гоффа.
По константе равновесия можно рассчитать равновесные состав продуктов реакции и степень превращения при различных параметрах процесса.
Контрольные вопросы
- Из каких этапов состоит любой ХТП?
- По каким признакам классифицируются химические реакции?
- Какие показатели эффективности ХТП вы знаете?
- Что означает выражение «реагенты взяты в стехиометрическом соотношении»?
- Способы смещения равновесия (Принцип Ле-Шателье)?
- Каким образом связаны материальный и тепловой балансы?
Дополнительная литература
1. В.Е.Сороко, С.В.Вечная, Н.Н.Попова. Основы химической технологии: Л Химия, 1986
2. А.М.Кутепов и др. Общая химическая технология. - М. Высшая школа,1990.
3. Ю.А.Москвичев и др. Теоретические основы химической технологии. – М: Академия,2005.



 (а)
(а) можно повысить степень окисления СО в
можно повысить степень окисления СО в  и на единицу израсходованной окиси углерода (СО) получить большее количество водорода.
и на единицу израсходованной окиси углерода (СО) получить большее количество водорода.  (б)
(б) (в)
(в) pD+qF скорость прямой реакции:
pD+qF скорость прямой реакции:  ; скорость обратной реакции:
; скорость обратной реакции: 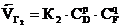 ,
,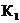 и
и  - константы скоростей прямой и обратной реакции соответственно;
- константы скоростей прямой и обратной реакции соответственно; - концентрации веществ А, В, D, F.
- концентрации веществ А, В, D, F.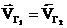 ,
,  ;
; .
.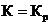 .
.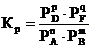 ; где
; где 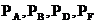 - парциальное давление А, В, D, F соответственно.
- парциальное давление А, В, D, F соответственно.


