

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Гомогенные процессы в промышленности в основном осуществляются в газообразной или жидкой фазе. При проведении гомогенных процессов химические реакции протекают во всем объеме реакционной смеси, и если реагенты в исходной смеси достаточно хорошо перемешаны, то диффузионные процессы не лимитируют общей скорости процесса, которая определяется, как правило, кинетикой химического превращения.
Влияние концентрации на скорость реакции и степень превращения
Математическую формулу, связывающую скорость с концентрациями называют кинетическим уравнением реакции. Вид кинетического уравнения определяет порядок реакции, который равен сумме показателей степеней при концентрациях реагентов в уравнении. Влияние концентраций реагирующих веществ на скорость определяется законом действия масс, являющимся основным законом химической кинетики.
Для реакции: аА + вВ +…= продукты кинетическое уравнение можно представить в виде:  (а) порядок реакции m равен:
(а) порядок реакции m равен: 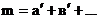
Порядок реакций в большинстве случаев не совпадает с молекулярностью реакций
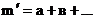 , что объясняется сложным механизмом таких реакций. Показатель степени при концентрации какого-либо компонента в кинетическом уравнении (а) называют порядком реакции относительно этого компонента.
, что объясняется сложным механизмом таких реакций. Показатель степени при концентрации какого-либо компонента в кинетическом уравнении (а) называют порядком реакции относительно этого компонента.
Наиболее простые случаи гомогенных реакций описываются кинетическими уравнениями 1 и 2-го порядков: m=1 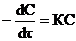 1-ый порядок; m=2
1-ый порядок; m=2 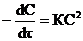 2-ой порядок.
2-ой порядок.
Как следует из уравнений, зависимость скорости реакции от концентрации сильно изменяется при возрастании порядка реакции.
Для технолога важно знать влияние начальной концентрации реагентов на среднюю скорость процесса. Именно этот факт определяет конечную производительность установки.
|
|
Для простых необратимых и обратимых реакций выход продукта по какому-либо веществу численно равен степени превращения этого вещества. Если в реакции участвуют два вещества А и В, то увеличение концентрации одного из них (например, В) приводит к повышению выхода продукта (например, Д) по другому веществу 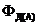 . Этот прием широко распространен в инженерной практике, когда необходимо более полно использовать дорогостоящее, дефицитное или вредное для окружающей среды вещество А. Увеличивая избыток другого дешевого или безвредного вещества В путем увеличения его концентрации
. Этот прием широко распространен в инженерной практике, когда необходимо более полно использовать дорогостоящее, дефицитное или вредное для окружающей среды вещество А. Увеличивая избыток другого дешевого или безвредного вещества В путем увеличения его концентрации  , повышает степень превращения дорогого вещества
, повышает степень превращения дорогого вещества  и выход продукта по этому веществу
и выход продукта по этому веществу 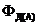 (рис 2.1)
(рис 2.1)
 |
Рис. 2.1. Влияние повышения концентрации СВ и коэффициента избытка 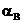 вещества В на степень превращения вещества А и выход продукта Д по веществу А в реакции А+В
вещества В на степень превращения вещества А и выход продукта Д по веществу А в реакции А+В  Д
Д
При этом верхний предел выхода 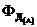 максимальный для необратимых реакций равен 1, а для обратимых – равновесному выходу.
максимальный для необратимых реакций равен 1, а для обратимых – равновесному выходу.
Температура как фактор повышения скорости процесса и управления выходом продукта и избирательностью.
В химической практике одним из самых распространенных приемов увеличения скорости реакций является нагревание. Для необратимых гомогенных процессов увеличение скорости реакций с ростом температуры обусловлено только повышением константы скорости реакции.
В обратимых процессах изменение температуры сказывается и на значении движущей силы процесса через изменение константы равновесия и равновесных концентраций реагентов, входящих в состав математического выражения 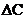 . Для процессов с параллельными и последовательными реакциями увеличение температуры существенно может влиять на избирательность при одновременном ускорении основной и побочных реакций.
. Для процессов с параллельными и последовательными реакциями увеличение температуры существенно может влиять на избирательность при одновременном ускорении основной и побочных реакций.
Скорость необратимых реакций прямо пропорциональна константе скорости, связь которой с температурой чаще всего может быть описана уравнением Аррениуса:
|
|
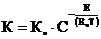 ;
;
где: К – константа скорости реакции;
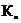 - предэкспоненциальный множитель (
- предэкспоненциальный множитель ( ; объем/моль х время);
; объем/моль х время);
Е – энергия активации, кДж/моль;
Т – температура,К;
R – универсальная газовая постоянная (8,314 Дж/моль х К).
Энергия активации элементарной реакции Е – это минимальное превышение 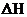 энергией средней внутренней энергии молекул, необходимое для того, чтобы произошло химическое взаимодействие, т.е. Е – это энергетический барьер, который должны преодолеть молекулы при переходе из одного состояния реакционной системы в другое.
энергией средней внутренней энергии молекул, необходимое для того, чтобы произошло химическое взаимодействие, т.е. Е – это энергетический барьер, который должны преодолеть молекулы при переходе из одного состояния реакционной системы в другое.
Характер влияния температуры на скорость необратимых реакций не зависит от их теплового эффекта. Таким образом, повышение температуры увеличивает скорость как экзотермических, так и эндотермических необратимых реакций. Их скорость прямо пропорциональна константе скорости, изменение которой описывается уравнением Аррениуса.
В отличие от необратимых реакций влияние температуры на скорость обратимых реакций имеет более сложный характер, так как скорость прямой и скорость обратной реакций характеризуется разными энергиями активации, а значит и разной «чувствительностью» к изменению Т. Для обратимой экзотермической реакции 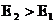 , для эндотермической – энергия активации прямой реакции (
, для эндотермической – энергия активации прямой реакции (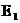 ) выше, чем обратной (
) выше, чем обратной (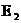 ).
).
В случае экзотермической реакции влияние температуры на константу скорости и константу равновесия противоречиво: с ростом Т увеличивается константа скорости и уменьшается константа равновесия. Это приводит к экстремальной зависимости изменения скорости процесса от температуры.
При проведении процессов с обратимой эндотермической реакцией влияние температуры на константу скорости и движущую силу процесса однозначно: с ростом Т увеличивается и константа скорости и константа равновесия.
Общая закономерность влияния температуры на скорость обратимых реакций заключается в том, что при малых степенях преобладает фактор повышения константы скорости прямой реакции, а при высоких температурах сказываются термодинамические ограничения, затормаживающие рост эндотермических процессов и уменьшающие значения степеней превращения в экзотермических процессах.
Для каждого производственного процесса существуют ограничения повышения температуры, обусловленные или термостойкостью конструкционных материалов, из которых изготовлены реакторы, или затратами энергии на поддержание высокой температуры. Кроме этого, повышение температуры выше некоторого предела Тмакс может привести к возникновению побочных реакций и, как следствие, к сильному снижению выхода продукта.
|
|
|
|
|

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!